低氧胁迫下大豆芽菜富集γ-氨基丁酸培养液组分优化*
2014-12-25王淑芳杨润强宋玉顾振新
王淑芳,杨润强,宋玉,顾振新
(南京农业大学食品科技学院,江苏南京,210095)
γ-氨基丁酸(GABA)是一种4碳非蛋白质氨基酸,具有降血压、调节心率、缓解压力等生理功能[1]。当植物在热击、冷击、盐、机械刺激和低氧等胁迫条件下,谷氨酸脱羧酶(GAD)和二胺氧化酶(DAO)被强烈激活,从而导致GABA积累[2]。研究表明,植物来源的GAD是1种钙调素(CaM)结合蛋白,其活性受Ca2+/CaM调控[3]。植物受到盐胁迫时,细胞液中Ca2+浓度升高[4],促使CaM转录水平提高,激活一系列生理反应。磷酸吡哆醛(PLP)作为GAD的辅基对其活性的发挥起重要作用[5]。从米胚中分离纯化得到的GAD脱除辅基后,活性完全丧失,但在含有PLP的体系中,活性可以恢复到90%以上[6]。通常认为,盐胁迫促进GABA的积累源于GAD活性的激活[7]。但近年来的研究表明,盐胁迫条件下,植物体内游离态多胺(PAs)含量升高,多胺氧化酶(PAO)、DAO活性也随之升高。
逆境条件下,植物籽粒的萌发和生长受到抑制、呼吸改变、蛋白酶、淀粉酶活性提高,同时合成GABA抵御胁迫。Yin等[8]报道,NaCl胁迫下发芽大豆中GABA大量富集;VB6作为PLP的结构类似物可激活发芽糙米中 GAD活力,从而富集 GABA[9];Ca不仅与CaM形成Ca2+/CaM参与GAD活力的激活,而且可提高DAO活力[10]。因此,在大豆籽粒低氧胁迫下发芽时,采用同时含有NaCl、VB6和CaCl2的培养液,将对GABA的富集具有显著作用。本研究优化了培养液组成,在优化的组分下,研究大豆发芽过程中主要生理生化指标和GABA含量的动态变化,以及GABA合成关键酶的变化情况,旨在探明大豆芽菜GABA富集的同时,明确其他主要营养成分变化情况。
1 材料与方法
1.1 材料和试剂
大豆(云鹤YH-NJ),2013年产自中国吉林省,购自江苏省农业科学院,置 -20℃冰箱贮存,备用。GABA标准品(纯度≥99%)美国Sigma公司;乙腈,上海陆都化学试剂厂;β-巯基乙醇,国药集团化学试剂有限公司;EDTA,国药集团化学试剂有限公司;磷酸吡哆醛,Sigma公司;丙三醇,国药集团化学试剂有限公司;聚乙烯吡咯烷酮,国药集团化学试剂有限公司;过氧化物酶,上海国源生物技术有限公司;腐胺,美国Sigma公司。
1.3 主要仪器设备
Orion818型 pH测试仪,美国 Orion Research,Inc.;755B型分光光度计,上海精密科学仪器有限公司;液相色谱仪 Agilent 1200,安捷伦公司;TDL-40B离心机,上海安亭科学仪器厂;PYX-DHS-BS型隔水电热恒温培养箱,上海跃进医疗器械厂。
1.4 大豆芽菜培养
取30 g大豆籽粒,用1%的NaClO水溶液浸泡消毒15 min,去离子水冲洗至pH中性,于30℃黑暗条件下浸泡6 h后置于24℃、相对湿度85%的发芽机中,以水为培养液发芽4 d,得大豆芽菜。
1.5 实验设计
将芽菜置于带盖的培养瓶(φ 5 cm×18.5 cm)中,加入10 mmol/L柠檬酸-柠檬酸钠缓冲溶液(pH 5.0),通入空气(0.9 L/min),培养2 d。选取 NaCl(A)、VB6(B)和CaCl2(C)作为研究对象,采用3因素3水平实验设计,评价各因素之间的交互作用,实验因素水平表见表1。

表1 Box-Behnken试验因素水平表Table 1 Coded values of variables used in Box-Behnken design
1.6 生长动力学曲线
大豆经预处理后,置于优化后的培养液中胁迫培养2 d。每隔12 h取样,样品用蒸馏水清洗并用吸水纸吸干表面水分,液氮速冻后待测。以预处理方式培养为对照。
1.7 测定指标与方法
芽长:采用游标卡尺测量,每30株大豆芽菜作为一个样本。
呼吸速率:采用小篮子法测定[11]。
可溶性蛋白含量:采用考马斯亮蓝法测定,以牛血清白蛋白为标准[11]。
游离氨基酸:采用茚三酮溶液显色法测定,以亮氨酸为标准[11]。
GABA含量:参照 Bai等[12]的方法测定。
GAD活性:参照张磊[13]的方法测定。
DAO活性:参照Yang等[14]的方法测定。
1.8 数据处理与统计分析
试验重复3次,结果以“平均值±标准差”表示。应用SPSS 16.0作差异显著性分析。Box-Behnken试验结果采用设计专家8.0软件分析。
2 结果与分析
2.1 培养液组分优化
对浓度 NaCl(mmol/L)(A)、VB6(μmol/L)(B)和CaCl2(mmol/L)(C)进行了3因素3水平响应面分析试验,试验设计与结果见表2。
采用Design Expert软件对表中数据进行二次多元回归拟合,得到GABA含量对编码自变量A、B和C的二次多项回归方程:
Y=0.941 09+0.003 890 83A+0.0405 64B+0.148 08C+0.000 267 5AB+0.001 197 92AC+0.000 487 5 BC-0.000 330 444A2-0.000 439 056B2-0.018 478C2
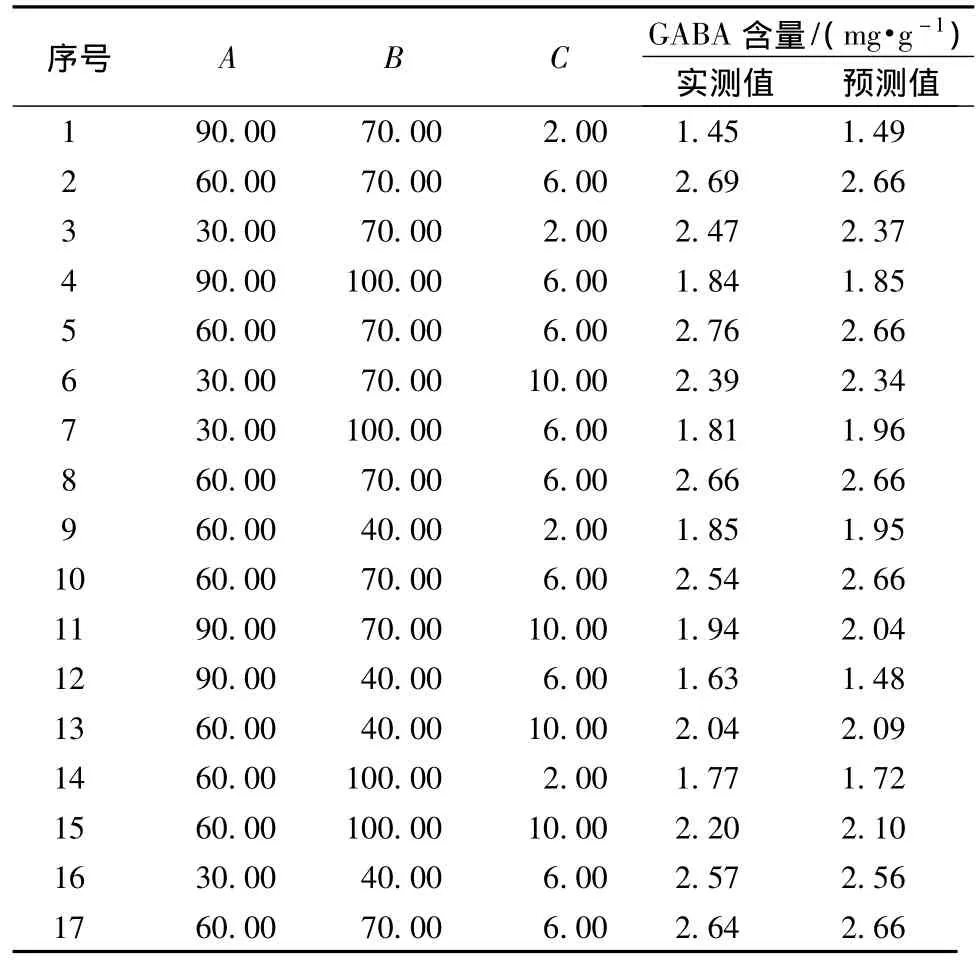
表2 Box-Behnken试验设计和结果Table 2 Design and response of the Box-Behnken
对上述回归模型进行方差分析(表3)。结果表明,模型是显著的(P<0.001),回归模型的决定系数为0.958,说明该模型能够解释95.8%的变异。因此,可用此模型对GABA含量进行分析和预测。对回归模型进行方差分析,F值为17.82,回归模型极其显著(P<0.005)。模型的失拟性检验不显著(P>0.05),说明二次模型相关性良好。模型的信噪比(adeq precision)为11.668,其值远大于4。所有的统计分析特征值表明,模型具有实践指导意义。

表3 回归模型方差分析Table 3 Analysis of Variance with regression model
根据回归分析所得二次方程,在试验设定范围内,分析任意两变量之间的交互作用,同时固定其他变量的取值,可得等高线图。图1-A表示CaCl2浓度为6.0 mmol/L时,NaCl和 VB6浓度对大豆芽菜GABA含量的影响。NaCl的一次项(P<0.005)和二次项(P<0.005)极其显著影响GABA含量,NaCl和VB6的交互作用显著。NaCl浓度一定时,GABA含量随VB6浓度增加先升高后降低。VB6浓度较低(40~70 mmol/L)时,图1-A中等高线分布较密,表明此时NaCl浓度对GABA含量的影响较大。当NaCl浓度42.49 mmol/L,VB6浓度 62.60 μmol/L 时,GABA含量达到最高值。
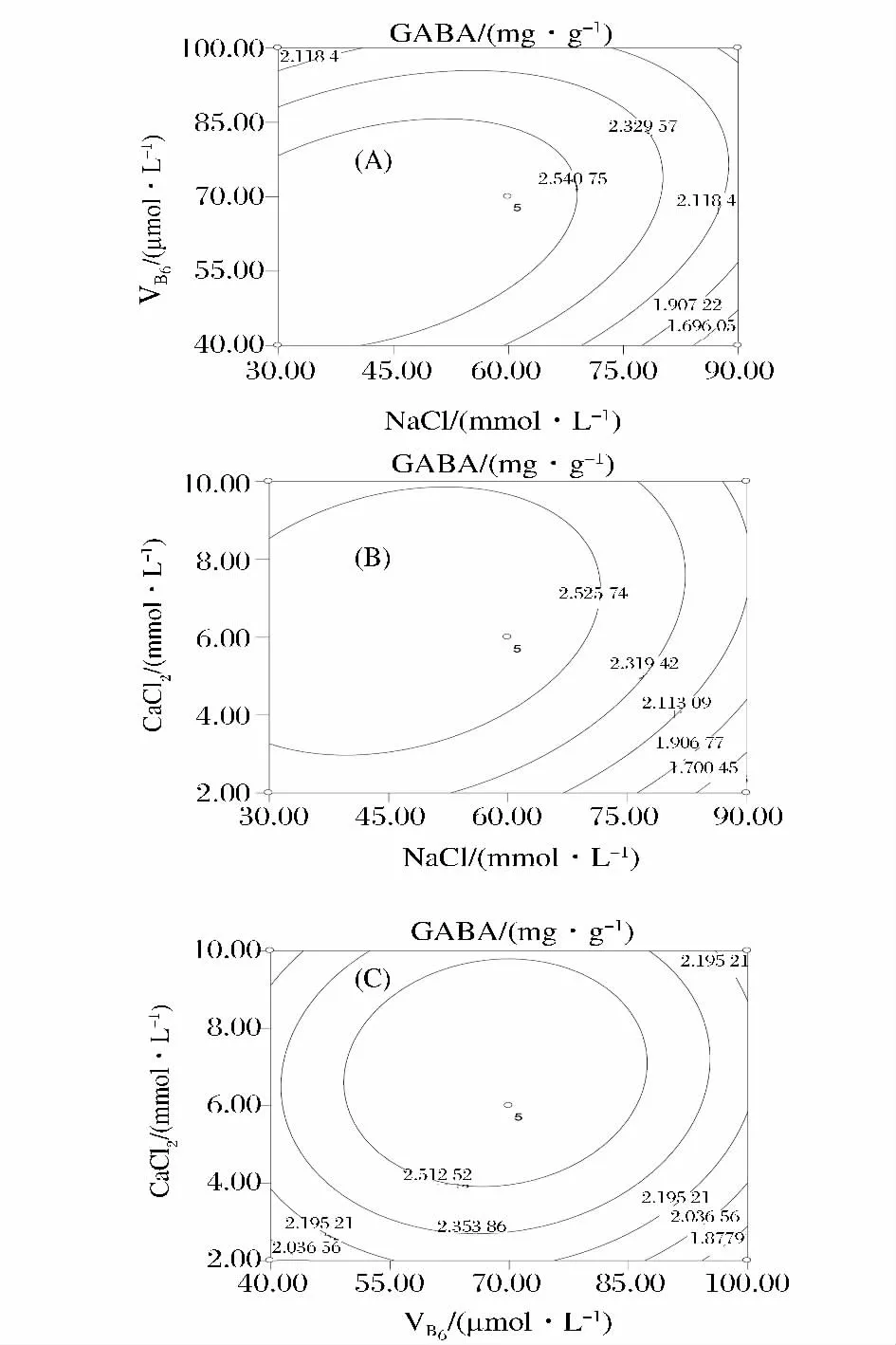
图1 NaCl、VB6及 CaCl2的交互作用对GABA含量的影响Fig.1 Contour plots showing the effect of interaction between NaCl,VB6and CaCl2on GABA content
图1-B表示,VB6浓度在70 μmol/L条件下,NaCl和CaCl2浓度对GABA含量的影响。CaCl2的一次项(P<0.05)和二次项(P<0.05)显著的影响大豆芽菜中GABA的含量,但NaCl和CaCl2浓度的交互作用不显著(P=0.064 0)。在一定的NaCl浓度下,GABA含量随着CaCl2浓度的增加呈现先增高后降低的趋势,浓度为6.21 mmol/L时达到最高值。同样,在一定CaCl2浓度下,GABA含量随着NaCl浓度的增加呈现先增加后降低的趋势,浓度为42.49 mmol/L达最大值。
CaCl2和VB6对大豆芽菜GABA含量的交互作用不显著(图1-C)。与VB6相比,CaCl2浓度对GABA含量的影响较大。当CaCl2浓度一定时,GABA含量随VB6浓度增加呈逐渐升高的趋势。CaCl2浓度为6.21 mmol/L、VB6浓度为 62.20 μmol/L 时,GABA 含量达到峰值。由此可见,培养液添加适当浓度的CaCl2和VB6可提高大豆芽菜中GABA含量。
2.2 培养液组分验证试验
对大豆芽菜GABA含量的二次多项数学模型解逆矩阵后得出,在低氧联合盐胁迫培养条件下,当培养液组分中NaCl浓度42.49 mmol/L、VB6浓度62.60 μmol/L、CaCl2浓度6.21 mmol/L时,大豆芽菜中GABA富集量的预测值为2.75 mg/g DW,实测值为2.77 mg/g DW,高于随机选择组。相关性分析表明,实测值与预测值接近,表明实验所拟合的模型可用来预测培养液组分和试验响应值之间的关系(表4)。
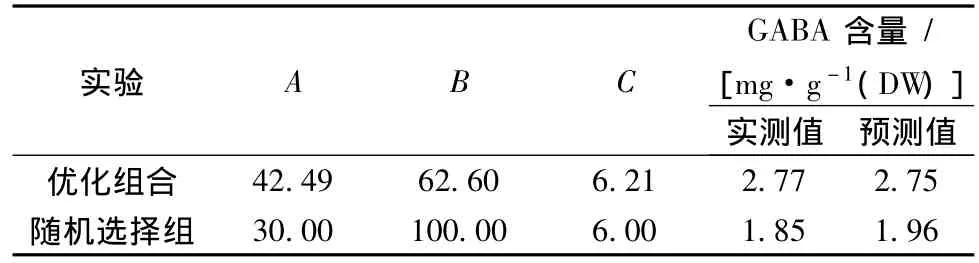
表4 验证试验设计和结果Table 4 Arrangement and result of validation trials
2.3 大豆发芽生长动力学曲线
如图2-A所示,大豆芽长随发芽时间延长而逐渐增长,胁迫条件下,大豆芽长增长缓慢,发芽132 h时,芽长仅为对照组的70%左右。这表明胁迫条件下大豆芽的生长受到了抑制。发芽96 h内,大豆呼吸速率随发芽时间延长而增大,发芽96 h后,胁迫条件下大豆芽菜呼吸速率低于对照。可见,低氧胁迫,不利于大豆芽菜的呼吸作用(图2-B)。由图2-C可见,大豆发芽过程中可溶性蛋白含量逐渐降低,非胁迫组发芽144 h时可溶性蛋白含量比发芽0 h减少57.08 mg/g。而胁迫条件下大豆芽菜中可溶性蛋白含量迅速降低,发芽144 h时,可溶性蛋白含量比发芽0 h减少167.08 mg/g,仅为对照组的45.45%。这表明胁迫处理条件下大豆芽菜中更多的可溶性蛋白被分解利用。大豆芽菜游离氨基酸含量呈上升趋势。胁迫培养144 h时,游离氨基酸含量比对照高94%,是发芽0 h的12.57倍。可见,低氧胁迫处理可促使大豆芽菜生成更多的游离氨基酸(图2-D)。
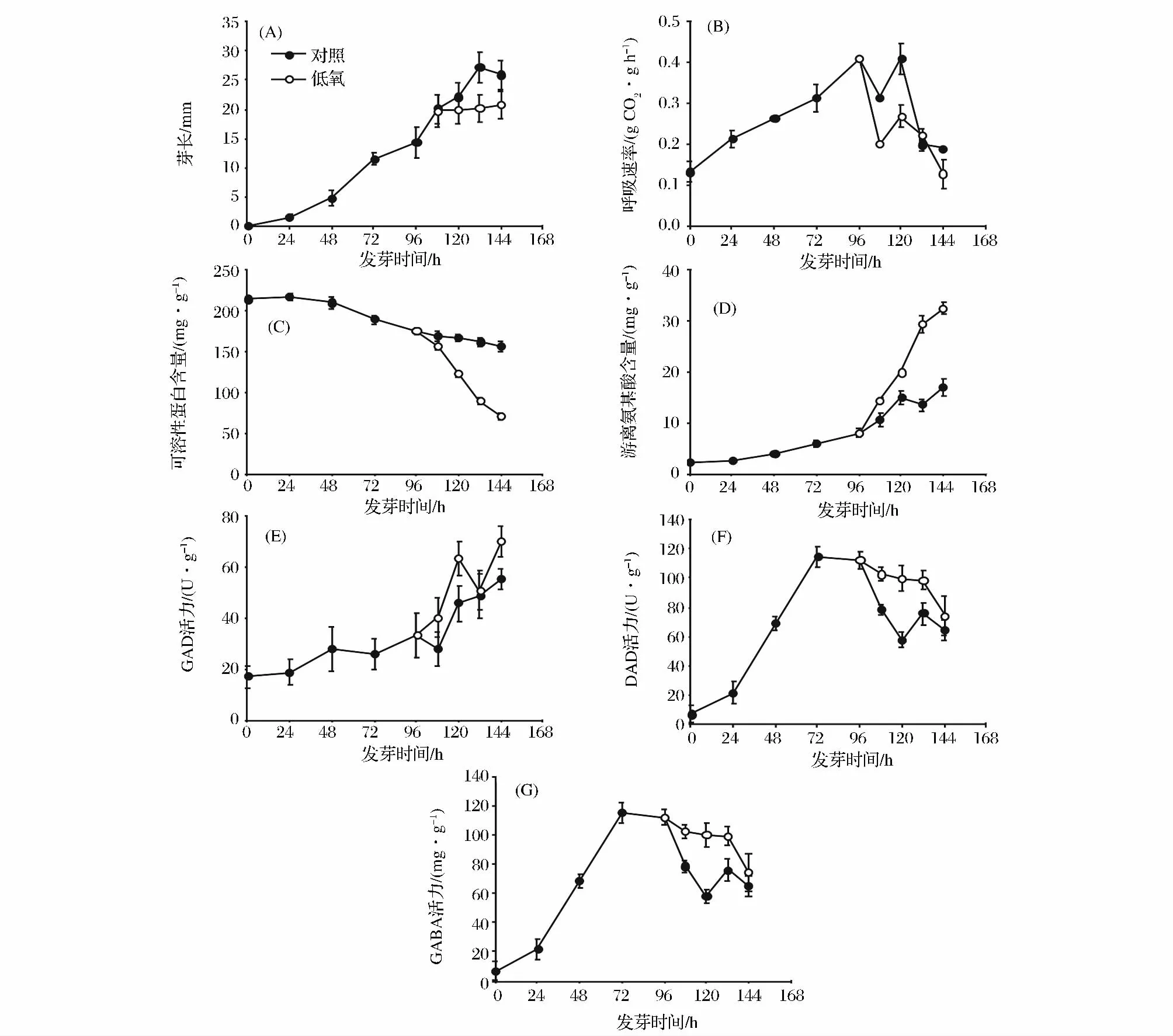
图2 大豆发芽期间主要生理生化变化Fig.2 The main physiological and biochemical changes of soybean during germination
随发芽时间延长,大豆芽菜GAD活性逐渐增大。发芽0~96 h,大豆芽菜GAD活性缓慢增长,96~144 h大豆芽菜GAD活性增加迅速,发芽144 h时,活性达到最大值。低氧胁迫条件下GAD活性达到最大值时比非胁迫处理高14.66 U/g DW,这说明低氧胁迫对大豆芽菜中GAD活性有激活作用(图2-E)。胁迫条件下,大豆DAO活性随培养时间延长呈先升高后降低的趋势(图2-F)。培养72 h时,大豆DAO活性达到最大值。发芽96~144 h,胁迫组DAO活性高于对照组,胁迫处理120 h时,DAO活性是对照组的1.7倍。由此表明,逆境胁迫提高了大豆DAO活性。由图2-G可知,大豆发芽0 ~144 h,GABA含量逐渐升高。发芽96 h时,胁迫处理大豆GABA含量急剧增加,胁迫处理144 h时,GABA含量为2.73 mg/g,显著高于非胁迫处理。可见,胁迫培养有利于大豆芽菜中GABA积累。
由表5可见,低氧胁迫下,大豆芽长与游离氨基酸、GAD活性、GABA含量呈正相关,与呼吸强度、可溶性蛋白、DAO活性呈负相关。由此可见,大豆胁迫培养96~144 h过程中,大豆芽长逐渐增长,但呼吸强度减弱,DAO活力下降。可溶性蛋白与游离氨基酸相关性在0.01水平上显著,这说明可溶性蛋白与游离氨基酸两者之间关系密切,在生命代谢过程中大分子蛋白被蛋白酶水解为小分子的游离氨基酸,供给代谢活动需要。GABA含量与可溶性蛋白、游离氨基酸相关性显著,可见含氮物质在大豆芽菜体内的代谢是随着可溶性蛋白的分解,游离氨基酸积累,GABA也逐渐积累的过程。
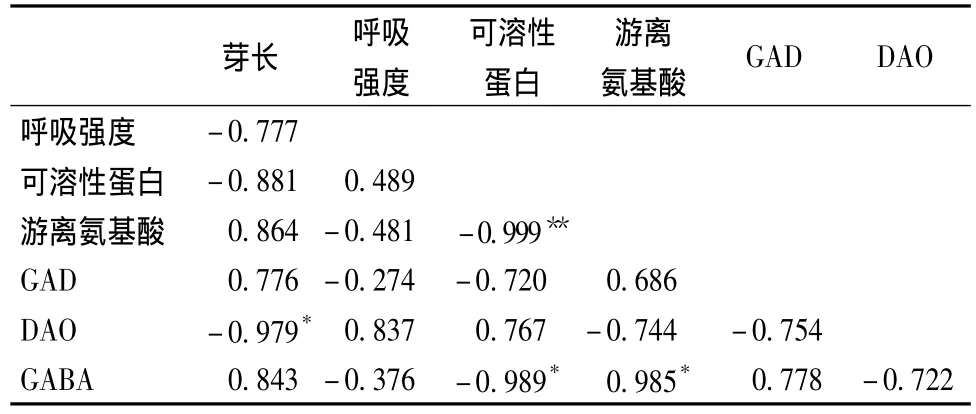
表5 低氧胁迫下大豆发芽期间生理生化指标和GABA含量的相关性Table 5 Correlations between physiological,biochemical parameters and GABA content in soybeans during germination under hypoxia
3 讨论
PLP是GAD的辅酶,VB6与PLP结构相似,起到与PLP相同的功能。张磊[13]研究米糠中GABA富集时,添加0.40 mmol/L VB6后GABA含量达到最大值,添加量大于或小于0.40 mmol/L,GABA富集量均显著下降。发芽蚕豆在VB6添加浓度为60 μmol/L时,GABA含量最大[15]。本实验采用响应面实验法得到VB6浓度62.60 μmol/L时,GABA富集量最大。
通常认为,盐胁迫促进GABA的积累源于GAD活性的激活[7]。但近年来的研究表明,盐胁迫条件下,植物体内游离态多胺含量升高,PAO、DAO活性也随之升高。李岩[9]研究表明,低氧胁迫下盐提高发芽蚕豆GAD和DAO活性,促进GABA富集,其中PAs降解对GABA富集的贡献率在37.6%~45.0%。植物细胞内Ca2+对GAD活性的调节主要是通过钙调素来完成的,但GAD提取后其活性是否受Ca2+影响,取决于分离得到的GAD是否结合有CaM。植物受到环境胁迫时均会引起胞质Ca2+浓度的增加[16],增加的Ca2+刺激了GAD活性,促进了GABA的积累。本研究发现,外源添加NaCl和Ca2+对大豆芽菜富集GABA有积极作用,但是,Ca2+调控大豆体内代谢机理有待从分子水平加以深入研究。
Koca等[17]报道,盐胁迫时发芽芝麻的芽长和根长受到不同程度的抑制。也有报道表明,GABA的合成能够调节植物的生长和发育[18]。在茎伸长研究中,机械刺激引起的生长抑制现象可被Ca2+鳌合剂和CaM拮抗剂所阻断。机械刺激能够短时增加胞内Ca2+和 GABA 水平[19],同时茎的伸长受到抑制[20]。GABA处理可刺激向日葵幼苗产生乙烯,促进ACC合成酶的转录[21]。用外源性GABA处理大豆可显著提高叶片中腐胺、亚精胺和精胺的含量[22]。以上结果表明,GABA对植物生长的调节作用是通过调控乙烯和多胺的合成及含量实现的[23]。推测环境胁迫可以升高胞内 Ca2+和 H+水平,激活 GAD、DAO,引起GABA积累,然后GABA与其受体结合从而调控植物的生长发育。本研究得出大豆在胁迫发芽过程中,芽长生长受到抑制,呼吸速率降低,这与前人研究结果相近。
植物体内蛋白质等含氮化合物的变化反映了环境胁迫下植物代谢过程中蛋白质损伤程度。植物体内催化生化反应的酶是可溶性蛋白,逆境条件下往往导致酶活性提高,蛋白质等生物大分子物质发生降解,可溶性蛋白含量下降[24],游离氨基酸含量的增加,为合成GABA提供充足的底物。同时,与脯氨酸、甜菜碱、蔗糖、多胺等相似,GABA可作为渗透调节物质起到抵御逆境胁迫作用[21]。从而,大豆芽菜在低氧联合NaCl胁迫下GABA大量富集。除了物质基础,GABA形成关键酶活性在胁迫条件下同样显著提高,本研究结果显示,低氧胁迫条件下 GAD和DAO活性显著高于对照,因此低氧胁迫下关键酶活性的提高也是GABA富集的关键因素。
4 结论
低氧胁迫下,NaCl、VB6和CaCl2显著促进大豆芽菜GABA积累;并且NaCl和VB6对GABA富集具有显著的交互作用。
[1] Mody I,De Koninck Y,Otis T,et al.Bridging the cleft at GABA synapses in the brain[J].Trends in Neurosciences,1994,17(12):517-525.
[2] XING S G,JUN Y B,HAU Z W,et al.Higher accumulation of γ-aminobutyric acid induced by salt stress through stimulating the activity of diamine oxidases in Glycine max(L.)Merr.roots[J].Plant Physiology and Biochemis-try,2007,45(8):560-566.
[3] Baum G,Chen Y,Arazi T,et al.A plant glutamate decarboxylase containing a calmodulin binding domain.Cloning,sequence,and functional analysis[J].Journal of Biological Chemistry,1993,268(26):19 610-19 617.
[4] Reddy V S,Reddy A S.Proteomics of calcium-signaling components in plants [J].Phytochemistry,2004,65(12):1 745-1 776.
[5] Salzmann D,Christen P,Mehta P K,et al.Rates of evolution of pyridoxal-5'-phosphate-dependent enzymes[J].Biochemical and Biophysical Research Communications,2000,270(2):576-580.
[6] 张晖.米胚谷氨酸脱羧酶性质及其富集 γ-氨基丁酸研究[D].无锡:江南大学,2004.
[7] Olsson P,Yilmaz J L,Sommarin M,et al.Expression of bovine calmodulin in tobacco plants confers faster germination on saline media[J].Plant Science,2004,166(6):1 595-1 604.
[8] YIN Y,YANG R,GU Z.NaCl stress and supplemental CaCl2regulating GABA metabolism pathways in germinating soybean [J].European Food Research and Technology,2014,238(5):781-788.
[9] 李岩.发芽蚕豆γ-氨基丁酸富集途径及高效富集技术研究[D].南京:南京农业大学,2009.
[10] YANG R,CHEN H.,GU Z.Factors influencing diamine oxidase activity and γ-aminobutyric acid content of fava bean(Vicia faba L.)during germination [J].Journal of Agricultural and Food Chemistry,2011,59(21):116 16-116 20.
[11] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[12] BAI Q,FAN G.,GU Z,et al.Effects of culture conditions on γ-aminobutyric acid accumulation during germination of foxtail millet(Setaria italica L.)[J].European Food Research and Technology,2008,228(2):169-175.
[13] 张磊.米糠中 γ-氨基丁酸富集技术及保健饮料制作研究[D].南京:南京农业大学,2008.
[14] YANG R,YIN Y,GUO L,et al.Sequence analysis of diamine oxidase gene from fava bean and its expression related to γ-aminobutyric acid accumulation in seeds germinating under hypoxia-NaCl stress[J].Journal of the Science of Food and Agriculture,2014,DOI:10.1002/jsfa.6461.
[15] 陈惠,杨润强,韩永斌,等.发芽蚕豆富集 γ-氨基丁酸的培养液组分优化[J].中国粮油学报,2012,26(11):27-31.
[16] Pandey S,Tiwari S,Upadhyaya K,et al.Calcium signaling:linking environmental signals to cellular functions[J].Critical Reviews in Plant Sciences,2000,19(4):291-318.
[17] Koca H,Bor M,zdemir F,et al.The effect of salt stress on lipid peroxidation,antioxidative enzymes and proline content of sesame cultivars[J].Environmental and Experimental Botany,2007,60(3):344-351.
[18] Bown A W,Shelp B J.The metabolism and functions of g-aminobutyric acid [J].Plant Physiology,1997,115(1):1-5.
[19] Gallego P P,Whotton L,Picton S,et al.A role for glutamate decarboxylase during tomato ripening:the characterisation of a cDNA encoding a putative glutamate decarboxylase with a calmodulin-binding site [J].Plant Molecular Biology,1995,27(6):1 143-1 151.
[20] Carroll A D,Fox G G,Laurie S,et al.Ammonium assimilation and the role of[gamma]-aminobutyric acid in pH homeostasis in carrot cell suspensions[J].Plant Physiology,1994,106(2):513-520.
[21] Kinnersley A M,Turano F J.Gamma aminobutyric acid(GABA)and plant responses to stress[J].Critical Reviews in Plant Sciences,2000,19(6):479-509.
[22] Turano F J,Kramer G F,WANG C Y.The effect of methionine,ethylene and polyamine catabolic intermediates on polyamine accumulation in detached soybean leaves[J].Physiologia Plantarum,1997,101(3):510-518.
[23] Bouche N,Fromm H.GABA in plants:just a metabolite[J].Trends in Plant Science,2004,9(3):110-115.
[24] ZHOU W,SUN Q J,ZHANG C F,et al.Effect of salt stress on ammonium assimilation enzymes of the roots of rice(Oryza sativa)cultivars differing in salinity resistance[J].Acta Botanica Sinica-English Edtion,2004,46(8):921-927.
