产角蛋白酶菌种的筛选及产酶条件的优化*
2014-12-25张旦旦余园张晓梅李恒许正宏史劲松
张旦旦,余园,张晓梅,李恒,许正宏,2,史劲松
1(江南大学药学院生物制药系,江苏无锡,214122)
2(江南大学工业生物技术教育部重点实验室,江苏无锡,214122)
角蛋白是一种广泛存在于自然界中的硬性蛋白,普通的溶剂和一般的蛋白酶(如胰蛋白酶、胃蛋白酶、木瓜蛋白酶等)都难以令其溶解,因此利用传统的物理或化学方法降解角蛋白存在提取效率低、耗能高、污染大、产物分子质量较小等缺陷[1-2]。角蛋白酶(Keratinase)是一类可特异性降解不溶性角蛋白的蛋白酶类,生产菌株多筛选自角蛋白含量丰富的家禽废弃物、毛发堆放地、羊圈土壤等,常见产角蛋白酶的细菌为链霉菌属和芽孢杆菌属,如地衣芽孢杆菌(Bacillus licheniformis)、短小芽孢杆菌(Bacillus pumilus)、弗氏链霉菌(Streptomyces fradiae)、密旋链霉菌(Streptomyces pactum)等[3-4]。不同来源的角蛋白酶的理化特性各有不同,但除部分高温嗜碱微生物来源的角蛋白酶外,大部分角蛋白酶为中性至碱性蛋白酶,最适作用温度在40 ~60℃[5]。
本文经过多次分离筛选,从7个不同来源的土壤样品中筛选到32株微生物,并对其中产酶较高的3株微生物进行分子生物学鉴定,其中1株为金色链霉菌(Streptomyces aureus),目前尚无该菌株产角蛋白酶的相关报道。
1 材料与方法
1.1 实验材料
1.1.1 出发菌株
金色链霉菌(Streptomyces aureus)K13,保藏号为CGMCC No.8047,本实验室筛选。
1.1.2 培养基
初筛固体培养基(g/L):羊毛粉 5,K2HPO41,NaCl 0.5,琼脂粉 20。
察氏/种子培养基(g/L):蔗糖 30,NaNO33,K2HPO41,MgSO4·7H2O 0.5,KCl 0.5,FeSO4·7 H2O 0.01。
初始发酵培养基(g/L):羊毛粉10,K2HPO40.4,NaCl 0.5。自然pH值,1×105Pa灭菌20 min。
自制羊毛粉:将羊毛浸泡于0.1 mol/L NaOH溶液中3 d后,用自来水冲洗干净,1×105Pa灭菌20 min,105℃烘干后,用粉碎机粉碎后经研钵研磨制成羊毛粉。
1.2 菌株的分离筛选与培养方法
1.2.1 角蛋白酶产生菌土样采集地点
土样1:农村多年无耕作的土壤
土样2:羊圈表层土壤
土样3:羊群活动频繁地区的表层土壤
土样4:树林深处湿润的土壤层
土样5:竹林深处的土壤层
土样6:家禽活动频繁地区的表层土壤
土样7:家禽活动频繁地区的深层土壤
1.2.2 菌株筛选方法
分别取上述土样1 g溶于10 mL无菌生理盐水中,摇匀制成土壤悬液;将土壤悬液稀释不同倍数后取200 μL涂布于上述筛选培养基的固体平板,30℃培养72 h;挑取较大的菌落,在初筛平板上反复划线分离,直至分离到单菌落进行摇瓶复筛,复筛培养基为上述的初始发酵培养基,220 r/min,30℃恒温培养72h后测定发酵上清液中的角蛋白酶活力。
1.2.3 菌株培养方法
种子制备方法:取平板单菌落1环接种于装有25 mL种子培养基的250 mL三角瓶中,置于恒温振荡摇床220 r/min,30℃培养48 h。
发酵方法:取2%种子液接种于装有50 mL发酵培养基的500 mL三角瓶中,置于恒温振荡摇床220 r/min,30℃培养 72 h。
1.3 角蛋白酶活力的测定
测定体系:取10 mL试管,依次加入2.0 mL 0.05 mol/L的Tris-HCl缓冲液(缓冲液具体pH值随实验而定),10 mg自制羊毛粉底物,37℃预热10 min后加入1.0 mL粗酶液,混匀,37℃恒温振荡水浴锅反应1 h(具体预热与反应温度随实验而定)。加入2.0 mL 0.4 mol/L的三氯乙酸终止反应,10 000 r/min离心10 min,取上清液于280 nm测定其吸光度值,采用37℃恒温振荡前添加三氯乙酸的反应管作对照。酶活计算公式如下:
X=△A280×100×n
式中:△A为反应液的吸光度值-对照液的吸光度值;X为样品的酶活力,U/mL;n为样品的稀释倍数。
酶活力单位定义:1 mL液体酶,在一定的温度和pH条件下转化羊毛粉底物,1 h使A280增加0.01个单位即为1个酶活力单位,以U/mL表示。
1.4 菌株鉴定方法
1.4.1 菌株形态学特征与生理生化特征鉴定[6]
将菌株接种察氏培养基平板中,30℃培养2~3d,观察其菌落特征、菌体形态和革兰氏染色特征,生理生化鉴定参照《伯杰细菌鉴定手册》。
1.4.2 菌株16S rDNA鉴定[3]
取对数生长期的菌液,提取其基因组DNA,以细菌16S rDNA通用引物(正向引物:5'-GAG AGT TTG ATC CTG GCT CAG-3’,反向引物:5'-CTA CGG CTA CCT TGT TAC GA-3’)扩增其16S rDNA。
细菌DNA的提取参照上海捷瑞生物工程有限公司细菌基因组提取试剂盒说明;PCR扩增产物的纯化参照上海捷瑞生物工程有限公司PCR产物纯化试剂盒说明;测序由上海生工生物工程有限公司完成。测序后,在GenBank中通过BLAST比对进行菌种鉴定。
1.5 粗酶性质
1.5.1 粗酶液的制备
将发酵液于10 000 r/min离心10 min,上清液即为粗酶液。
1.5.2 粗酶的最适作用温度、pH
维持其他条件不变,分别在不同温度(30、40、45、50、55、60、70、80℃)、不同 pH 值(pH 3.0 ~10.0,其中pH 3.0~7.0采用柠檬酸-柠檬酸钠缓冲液,pH 7.0~9.0采用Tris-HCl缓冲液,pH 9.0~10.0采用甘氨酸-氢氧化钠缓冲液)条件下,按1.3中方法测酶活力,以酶活最高者为100%绘制曲线,以确定该角蛋白酶的最适反应温度和pH。
1.5.3 角蛋白酶的SDS-keratin-PAGE电泳[7]
分别做2种蛋白胶,以普通蛋白胶做目标蛋白的还原性电泳(A);在普通蛋白分离胶中加入1%的角蛋白溶液,使其最终浓度为0.2%,在该蛋白胶上做目标蛋白的非还原性电泳(B),电泳条件均为:4℃,150 V恒压约50 min。蛋白胶A直接染色后脱色;B置于1%的TritonX-100中洗涤3次以去除SDS,每次10 min,然后置于pH 8.5的Tris-HCl缓冲液中55℃恒温反应10 h,将胶取出用考马斯亮蓝(R250)染色30 min后脱色。
1.6 金色链霉菌发酵产酶条件优化
1.6.1 菌株生长曲线和产酶曲线的测定
按1.2.3的培养方法进行菌株K13的发酵,每隔8 h取2 mL发酵液,置于5 mL离心管中,4 000 r/min离心5 min,沉淀置于鼓风干燥箱中80℃以上干燥至恒重;上清液于10 000 r/min离心10 min,取上清液按1.3的方法测角蛋白酶酶活。
1.6.2 培养基的单因素优化
在初始发酵培养基的基础上,保持其他条件不变,分别添加2%的碳源(葡萄糖、乳糖、蔗糖、可溶性淀粉、酵母粉)、0.2%无机氮源(NaNO3、NH4Cl、NH4HCO3)、1%有机氮源(牛肉膏、蛋白胨、酪蛋白、豆饼粉),进行摇瓶发酵(分别设置3组平行实验,取平均水平),以发酵64 h上清液的角蛋白酶活力为考核指标探索各因素对金色链霉菌K13发酵产酶的影响。
1.6.3 培养基的正交实验优化
根据单因素实验结果,选取葡萄糖(A)、蛋白胨(B)、NaNO3(C)、羊毛粉(D)4个影响角蛋白酶活力的主要因素,每个因素选取3个水平,进行L9(34)正交实验设计(表1),根据实验结果确定最佳培养基成分及水平,进行验证实验。

表1 正交实验设计因素水平表Table 1 Experimental variables and levels for orthogonal design
2 结果
2.1 产角蛋白酶微生物菌株的筛选与鉴定
2.1.1 产角蛋白酶微生物的初筛
从7个土壤样品中分离筛选角蛋白酶产生菌,经初步分离纯化共分离得到32株菌,菌株来源如表2所示。

表2 产角蛋白酶菌株的土壤初筛结果Table 2 Screening results of keratinase-producing strains
有羊毛存在的土壤中能利用角蛋白的微生物相对较丰富,其他土壤中也存在能利用羊毛角蛋白生长的微生物,但数量较少,表明微生物角蛋白酶为底物诱导型蛋白酶。根据镜检及菌落形态初步判断32株菌中有13株放线菌,18株细菌,1株真菌,选择生长良好的菌株继续分离培养,共得到18株菌的纯培养物。
2.1.2 产角蛋白酶微生物的复筛
将初筛得到的18株菌进行摇瓶发酵测其产酶活力,其中13号菌株(放线菌)产酶活力最高达3.9 U/mL,4号(放线菌)和22号(细菌)菌株次之,其他菌株产酶均较低,且稳定性不高(表3),选取13号菌株进行后续研究。
2.1.3 产酶菌株的鉴定
2.1.3.1 13号菌株形态学特征与生理生化特征鉴定
该菌株菌落形态为圆形,质地致密,表面干燥而多皱,无光泽,具有发达的基内菌丝和黄色孢子。革兰氏染色阳性,镜检有分枝的菌丝,孢子成链状生长。根据菌株生理生化特征(表4),并参照《伯杰细菌鉴定手册》初步鉴定该菌株为放线菌目链霉菌科链霉菌属。
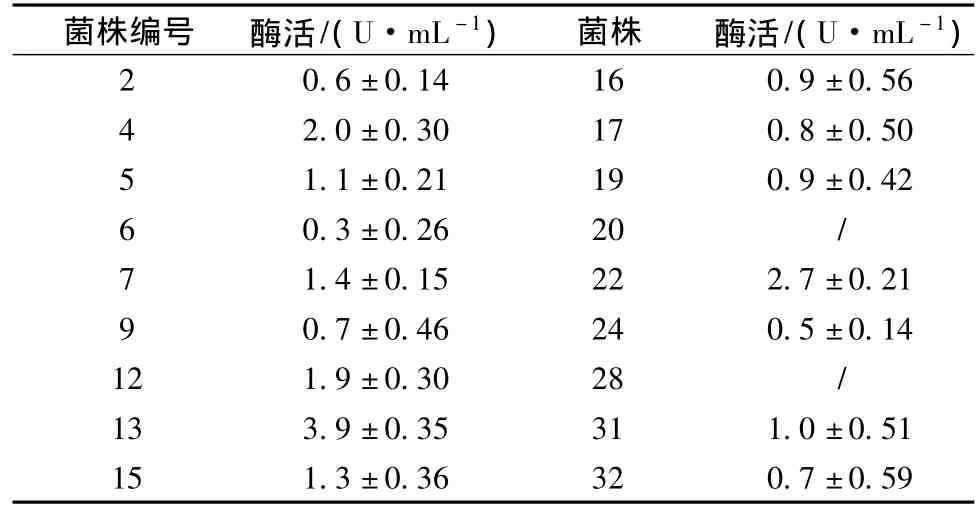
表3 各菌株酶活力测定结果Table 3 Keratinase activities of strains

表4 菌株K13的生理生化特征Table 4 Physiological and biochemical characters of strain K13
2.1.3.2 菌株的16S rDNA鉴定
按1.4.2所述实验方法获得13号菌株的16S rDNA,约1 600bp(图1A),经测序比对,该菌株16S rDNA与金色链霉菌(Streptomyces aureus)16S rDNA的同源性为99%,菌株系统进化树如图1B所示,结合菌株生理生化特征,将该菌株鉴定为金色链霉菌,命名为K13。文献报道,金色链霉菌通常作为抗生素产生菌被广泛研究,工业上作为一种四环类抗生素——金霉素的主要生产菌株[8],目前尚无该菌株产角蛋白酶的相关报道,本文将对其展开研究。
2.2 金色链霉菌K13角蛋白酶粗酶性质研究
2.2.1 粗酶的最适作用温度和pH的测定
分别考察该角蛋白酶粗酶的最适温度和pH,结果如图2所示:过高或过低的温度均对该酶活力有较大的抑制作用,中温(50~60℃)条件下该酶相对酶活力保持在90%以上,表明该酶为中温酶,最适作用温度为55℃;该酶在酸性条件(pH 3.0~6.0)下相对酶活力低于20%,碱性条件(pH 7.5~10.0)下相对酶活力均保持在80%以上,表明该酶为碱性角蛋白酶,最适作用pH为8.5,且在碱性条件下的pH适应范围较宽。
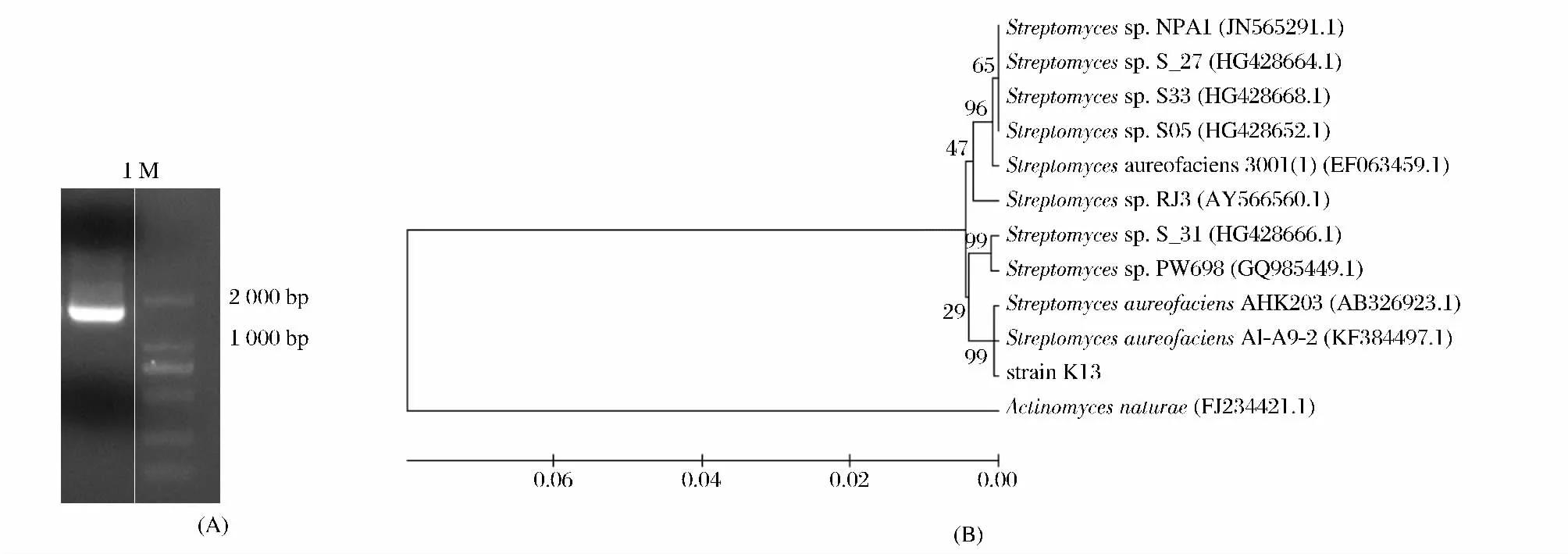
图1 菌株16S rDNA和系统进化树Fig.1 16S rDNA and phylogenetic tree of strain K13

图2 金色链霉菌角蛋白酶粗酶性质Fig.2 The crude enzymatic characteristics of keratinase produced by Streptomyces aureus K13
2.2.2 角蛋白酶的SDS-keratin-PAGE电泳
将发酵所得上清液用离心浓缩仪浓缩5~6倍,按1.5.3的方法进行分析,结果如图3所示,对比还原性电泳条带(A)与非还原性活性电泳条带(B),可知该菌株所产角蛋白酶分子质量约为46 kDa。

图3 角蛋白酶的SDS-keratin-PAGE电泳Fig.3 SDS-keratin-PAGE electrophoresis of keratinase
综合以上结论,金色链霉菌K13所产角蛋白酶为中温碱性角蛋白酶,分子质量约为46 kDa,最适温度为55℃,最适pH为8.5。比较目前已报道的角蛋白酶特性[5],菌株K13所产角蛋白酶与菌株Streptomyces gulbagensis DAS 131(分子质量46 kDa,最适温度45℃,最适pH 9.0)[9]的理化性质相似,后者在添加了3%淀粉的培养基中液态发酵7d,产酶活力达到最高14.3 U/mL。
2.3 金色链霉菌产角蛋白酶发酵条件初步探索
2.3.1 菌株产酶曲线的测定
考察金色链霉菌K13的生长及产酶曲线,如图4所示:菌株经过16 h的生长延滞期后进入对数生长期,并于64 h进入平稳期;该菌株产酶属于生长偶联型,酶合成伴随菌株生长而开始,并在菌株进入生长稳定期时(64 h)达到最高产酶4.15 U/mL;酶活力在80 h后迅速下降,可能是发酵后期,培养基营养匮乏,菌株利用自身合成的角蛋白酶以维持生长。
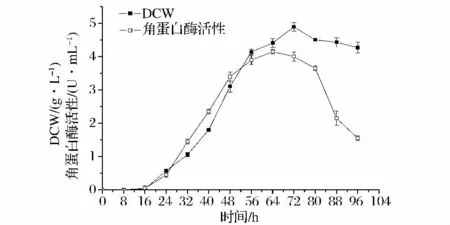
图4 金色链霉菌K13生长及产酶曲线Fig.4 Growth and keratinase-producing curve of Streptomyces aureus K13
2.3.2 发酵培养基的碳氮源优化
考察不同碳氮源对菌株产酶的影响,如图5所示。乳糖和酵母粉的添加一定程度抑制了产酶,而葡萄糖、蔗糖、可溶性淀粉均对产酶有促进作用,其中葡萄糖的促进效果最为明显,酶活力提高了110%;有机氮源蛋白胨和无机氮源NaNO3对产酶有促进作用,酶活力分别提高了63%和71%,其余氮源对产酶均有不同程度的抑制。以上结果表明,以羊毛角蛋白为底物发酵产角蛋白酶时添加合适的碳源或氮源对产酶有明显的促进作用。

图5 不同碳氮源对金色链霉菌K13发酵产角蛋白酶的影响Fig.5 Effects of different carbon and nitrogen sources on keratinase production by Streptomyces aureus K13
2.3.3 培养基组份的正交实验优化
根据单因素实验结果,选择葡萄糖、蛋白胨、硝酸钠和羊毛粉4个对产酶影响较为显著的因素,以角蛋白酶酶活(U/mL)作为响应值,进行正交试验优化,结果如表5所示。
表5根据极差(R)分析,4个因素的主次顺序为羊毛粉(D)>葡萄糖(A)>蛋白胨(B)>NaNO3(C),羊毛粉对酶活力的影响最大;由均值分析所得,最优组合方案为A3B3C3D1,即葡萄糖4%,蛋白胨3%,NaNO30.3%,羊毛粉0.5%,在最佳条件下进行3批次发酵实验,平均酶活力为(44.2±1.7)U/mL,较优化前(3.9 U/mL)提高了10.3倍。

表5 正交实验表Table 5 Results and analysis of orthogonal design
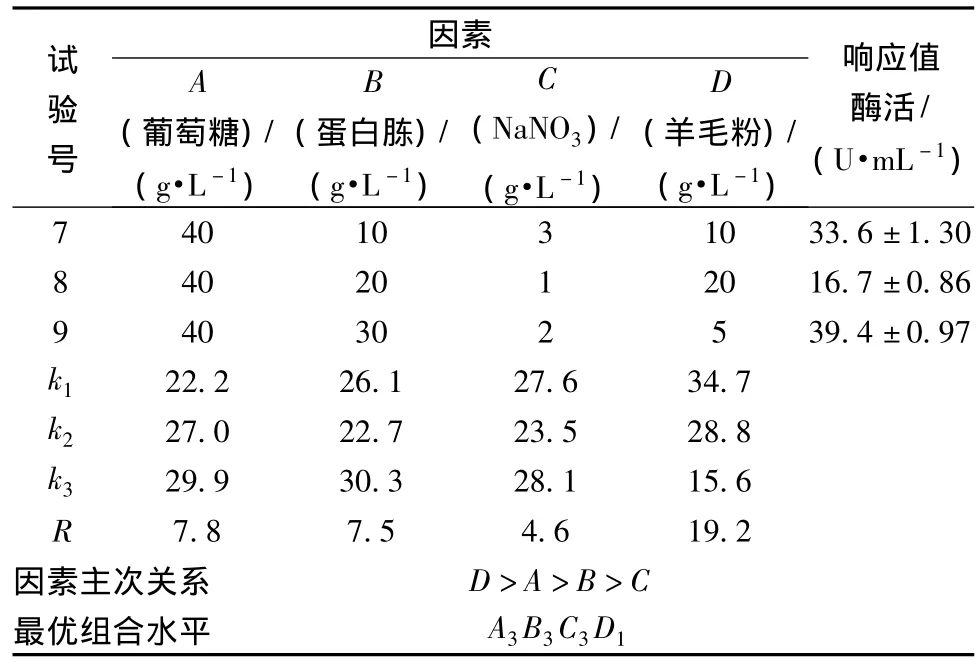
试验号因素A(葡萄糖)/(g·L-1)B(蛋白胨)/(g·L-1)C(NaNO3)/(g·L-1)D(羊毛粉)/(g·L-1)响应值酶活/(U·mL-1)7 40 10 3 10 33.6±1.30 8 40 20 1 20 16.7±0.86 9 40 30 2 5 39.4±0.97 k1 22.2 26.1 27.6 34.7 k2 27.0 22.7 23.5 28.8 k3 29.9 30.3 28.1 15.6 R 7.8 7.5 4.6 19.2因素主次关系 D>A>B>C最优组合水平 A3B3C3D1
3 讨论
本文以羊毛角蛋白为底物,从7个土壤样品中筛选获得1株角蛋白酶活性较高的菌株,经生理生化和分子生物学鉴定为金色链霉菌(Streptomyces aureus),命名为K13,对该菌株粗酶性质的研究发现:菌株K13所产角蛋白酶为中温碱性角蛋白酶,分子质量约为46 kDa,最适温度为55℃,最适pH为8.5,且在碱性条件下的pH适应范围较宽。从分子质量大小分析,菌株K13所产角蛋白酶与菌株Streptomyces sp.S7(44 kDa),Streptomyces gulbagensis DAS 131(46 kDa)极其相近,上述菌株均为链霉菌属,对羽毛有一定的降解能力,且EDTA对酶活性有一定的抑制作用[9-12];从最适pH与温度分析,相同或不同菌株来源的角蛋白酶均表现出不同性质,本文所述角蛋白酶的最适pH/温度与菌株Bacillus subtilis KD-N2(pH8.5,T55)相同,与Bacillus cereus DCUW(pH8.5,T50),Bacillus licheniformis K-508(pH8.5,T52),Chryseobacteriumsp.kr6(pH8.5,T50),Streptomyces thermoviolaceus(pH 8,T55)等菌株相似[5]。
笔者通过传统的菌种选育手段筛选到1株产角蛋白酶的金色链霉菌K13,经4因素3水平的正交实验优化,其产酶活性达到44.2 U/mL,该产酶水平较已报道的基因工程菌株[13-14]相去甚远,但在野生菌株[13-14]中仍有一定的优势,且目前尚无该菌株产角蛋白酶的相关报道。对该菌株产酶特性与代谢途径、酶蛋白分子结构及编码基因等的进一步研究,将有望获得新的角蛋白酶,并对探讨和完善金色链霉菌代谢产物及基因组结构意义重大。
[1] Williams C M,Richter C S,Mackenzie J M,et al.Isolation,identification and characterization of a feather-degrading bacterium[J].Appl Environ Microbiol,1990,56(6):1 509-1 515.
[2] 贾如琰,何玉凤,王荣民,等.角蛋白的分子构成、提取及应用[J].化学通报,2008(4):265-271.
[3] Brandelli A.Bacterial keratinases:useful enzymes for bioprocessing agroindustrial wastes and beyond[J].Food Bioprocess Technol,2008,2(1):105-116.
[4] 王秋影,廖美德.角蛋白酶的研究进展[J].中国饲料,2012,(22):12-16.
[5] Brandelli A,Daroit D J,Riffel A.Biochemical features of microbial keratinases and their production and applications[J].Appl Microbiol Biotechnol,2010,85:1 735-1 750.
[6] RE布坎南,NE吉本斯.伯杰细菌鉴定手册(第八版)[M].北京:科学出版社,l984:1 037-1 041.
[7] 史劲松.耐冷菌Bacillus cereus SYP A2-3产冷适蛋白酶的研究[D].无锡:江南大学,2006.
[8] 王鹏飞,谢昌贤,刘运添,等.氯化锂、紫外线对金色链霉菌(Streptomyces aureofaciens)产金霉素特性的诱变作用[J].微生物学杂志,2013,33(1):86-88.
[9] Syed D G,Lee J C,Li W J,et al.Production,characterization and application of keratinase from Streptomyces gulbargensis[J].BioresourceTechnol,2009,100(5):1 868-1 871.
[10] Tatineni R,Doddapaneni K K,Potumarthi R C.Purification and characterization of an alkaline keratinase from Streptomyces sp.[J].BioresourceTechnol,2008,99(6):1 596-1 602.
[11] 刘文涛,刘柏宏,张娟,等.枯草芽孢杆菌产角蛋白酶的发酵过程优化[J].食品与生物技术学报,2014,33(5):466-471.
[12] Wang J J,Rojanatavorn K,Shih J C H.Increased production of Bacilluskeratinase by chromosomal integration of multiple copies of the kerA Gene[J].Biotechnol and Bioeng,2004(4):459-464.
[13] 冀勇良,朱传合,刘丽英.短小芽孢杆菌产角蛋白酶液体发酵条件的优化[J].食品与发酵科技,2014,50(1):19-24.
[14] Cavello I A,Hours R A,Rojas N L,et al.Purification and characterization of a keratinolytic serine protease from Purpureocilliumlilacinum LPS#876[J].Process Biochem,2013,48(5-6):972-978.
