傣家酸鱼中乳酸菌的分离鉴定及乳酸发酵的初步研究*
2014-12-25张振宇李忠孝袁明龙袁明伟陈海云杜刚
张振宇,李忠孝,袁明龙,袁明伟,陈海云,杜刚
(云南民族大学云南省生物高分子功能材料工程技术研究中心,云南昆明,650500)
乳酸是世界上公认的三大有机酸之一,是重要的生物化工产品,在医药、食品等工业有广泛的应用[1]。目前工业上生产乳酸的方法主要有化学法、酶法和生物发酵法。生物发酵法生产乳酸因具有产品的光学纯度高,原料来源广泛,生产成本低廉和产品的生物相容性好等特点,成为国内外生产L-乳酸的重要方法。
随着世界聚乳酸产业的兴起,乳酸发酵日益受到人们的重视,乳酸生产菌种的选育技术更是受到普遍关注,已有诸多成功的实例表明菌种水平的提高是降低乳酸生产成本的关键措施之一。目前发酵法生产L-乳酸常用的微生物可分为两类:一类为乳酸菌(lactic acid bacteria,LAB),另一类为根霉菌属(Rhizopus sp.)。国外主要以淀粉、葡萄糖等糖类或牛乳为原料,以德氏乳杆菌、干酪乳杆菌或保加利亚乳杆菌为主进行L-乳酸的发酵生产;国内主要以淀粉为原料,以米根霉进行L-乳酸发酵生产的研究[2-4]。
已有从腌渍鱼、肉制品中分离选育乳酸菌种用于食品加工的报道[9-11],但直接用于乳酸发酵的则比较少见。本文从德宏傣家酸鱼中分离乳酸菌,以期获得用于乳酸发酵的优良菌种,为乳酸发酵生产提供新的微生物菌株资源。
1 材料与方法
1.1 酸鱼样品
样品采自云南省德宏傣族景颇族自治州3个地区3户采用传统工艺手工制作酸鱼的农家。
1.2 培养基
MRS培养基:葡萄糖20 g,蛋白胨10 g,牛肉膏10 g,酵母提取物5 g,吐温 -80 1 mL,柠檬酸三铵2 g,CH3COONa 1 g,MnSO40.25 g,MgSO40.58 g,KH2PO42 g,蒸馏水1 000 mL,pH 自然。
产酸菌株筛选培养基[11]:葡萄糖 20 g,蛋白胨5 g,酵母提取物5 g,CH3COONa 1 g,柠檬酸三胺2 g,吐温 -80 1 mL,K2HPO42 g,KH2PO42 g,MgSO40.2 g,FeSO40.01 g,MnSO40.25 g,NaCl 0.01 g,琼脂16 g,CaCO316 g,溴甲酚紫 0.4 g,蒸馏水 1 000 mL,pH 6.5。
乳酸发酵培养基:葡萄糖100 g,蛋白胨10 g,酵母提取物 5 g,吐温 -80 1 mL,柠檬酸三胺 2 g,CH3COONa 1 g,K2HPO42 g,KH2PO42 g,MgSO40.2 g,FeSO40.01 g,MnSO40.25 g,NaCl 0.01 g,CaCO360 g,蒸馏水 1 000 mL,pH 6.5。
明胶液化培养基[7]:MRS培养基分装为每支5 mL,每支加0.6 g明胶。
产 H2S 培养基[7]:蛋白胨 10 g,牛肉膏 5 g,葡萄糖 2 g,半胱氨酸 0.5 g,NaCl 5 g,蒸馏水 1 000 mL,pH 7.3。
1.3 实验仪器与设备
ScoutⅡ型电子天平,奥豪斯国际贸易上海有限公司;LDZX-40BI型立式自动电热压力蒸汽灭菌锅,上海申安医疗器械厂;SW-CJ-ZFD型无菌操作台,苏净集团安泰公司;快速混匀器,常州国华电器有限公司;奥立龙-868型离子酸度计,上海斯坦福生物科技发展有限公司;101A型电热鼓风干燥箱,上海实验仪器厂有限公司;HP-900型隔水式恒温培养箱,上海一恒科技有限公司;ZHWY-2102型恒温培养振荡器,上海智城分析仪器制造有限公司;双目显微镜,上海华岩仪器设备有限公司;Nikon ECLIPSE E200显微镜,北京冠普佳科技有限公司;海尔 BCD-218A/D型冰箱,青岛海尔股份有限公司;UNICO 7200型分光光度计,尤尼柯上海仪器有限公司;Agilent 1200型高效液相色谱,安捷伦科技有限公司;TGL-15B高速冷冻离心机,上海安亭科学仪器厂;5331型PCR仪,德国Eppendorf股份公司;Tanon 2500型凝胶成像系统,上海天能科技有限公司等。
1.4 实验方法
1.4.1 产酸菌株的分离纯化
在无菌条件下,称取酸鱼样品1 g加入99 mL无菌生理盐水中,匀浆后作梯度稀释。分别吸取不同梯度稀释液各200 μL涂布于改良MRS培养基上,每个稀释度做3个平行,在32℃下培养48~72 h。随机挑取菌落,进行反复划线分离纯化,挑取单菌落接种于产酸菌株筛选平板中央,用封口膜包裹平板,于32℃恒温箱中培养,筛选出产生黄色透明水解圈的菌株。观察菌株的菌落形态特征及显微形态特征。
1.4.2 产酸菌株的生理生化特征
通过明胶液化试验、产H2S试验、吲哚试验、过氧化氢酶试验、葡萄糖发酵产气、七叶苷水解、淀粉水解等生理生化试验实验对菌株进行初步的鉴定[7]。
1.4.3 16S rDNA的PCR扩增及测序
菌株用 MRS斜面转接3次后,接种于30 mL MRS培养基,32℃培养 24 h,取 5 mL培养物于12 000 r/min离心10 min收集菌体,液氮冻融-CTAB法提取基因组 DNA。采用通用引物27f:5'-AGAGTTTGATCCTGGCTCAG-3';1495r:5'-CTACGGCTACCTTGTTACGA-3',以基因组DNA为模板进行16S rDNA的PCR扩增。PCR反应体系如下:Taq MIX 12 μL,引物各 1 μL,模板 2 μL,加无酶水补足20 μL。程序如下:95℃预热5 min,94℃变性1 min,55℃退火30 s,72℃延伸2 min,经30个循环后72℃末端延伸10 min,4℃保存。PCR产物经琼脂糖凝胶电泳检测后外送测序,序列用 NCBI的 Blast在GenBank基因库中进行同源性比对,用MEGA软件进行系统发育分析。
1.4.4 发酵分析
1.4.4.1 生长曲线与产酸能力试验
将分离得到的乳酸菌以相同的接种量接种于MRS培养基,32℃,120 r/min条件下培养,每隔2 h取样测定OD580nm值及pH值,绘制成生长曲线和pH曲线。
1.4.4.2 乳酸的定性分析
采用TLC法对发酵液(发酵培养基中不添加CaCO3)进行分析,展开剂为甲醇∶氯仿(1∶2,v/v),上行法一次展开,展层后用0.2%溴甲酚绿∶0.05%甲基红∶0.5 mol/L NaOH(1∶1∶0.15,v/v)溶液喷雾显色,蓝紫色背景下呈现橙黄色斑点,根据发酵液呈现斑点的Rf值与乳酸标准品比较,从而对乳酸进行定性[8];同时用HPLC法对发酵液进行检测,根据标准品保留时间定性。色谱条件如下:色谱柱:Agilent E-clipse XDB-C18,5 μm,4.6 mm ×150 mm;流动相,水∶甲醇(95∶5,v/v,甲酸调 pH 为 3);流速,1 mL/min;柱温,室温;进样量,5 μL;检测波长,210 nm。
1.4.4.3 乳酸的定量分析
菌株用MRS培养基做种子后按5%接种量分别接至乳酸发酵培养基,用250 mL锥形瓶装液100 mL进行发酵;35℃,140 r/min振荡培养72 h后取样,用EDTA络合滴定法[8]对发酵液中乳酸钙进行定量,再按照公式进行乳酸折算。
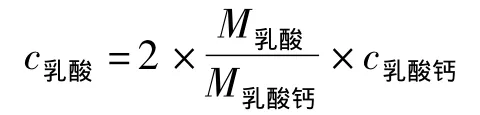
式中,c为物质的量浓度;M乳酸表示乳酸的摩尔质量,取90.08 g/mol;M乳酸钙表示乳酸钙的摩尔质量,取308.3 g/mol。
2 结果与分析
2.1 产酸菌株的分离纯化
3份酸鱼样品经MRS平板分离纯化得到10株纯化菌株。在产酸菌株筛选平板上,菌株sy1、sy3、sy4在平板中央产生明显的变色溶钙圈(如图1所示),表明3株菌为产酸菌株。形态学观察发现,sy1为链状长杆菌、较细长;sy3、sy4均为短杆菌、较小;以上3株菌均为革兰氏阳性菌;结果见表1。对菌株sy1、sy3、sy4进行了部分生理生化实验,初步判断3株菌均为乳酸菌,结果见表2。

图1 初筛平板Fig.1 Results of preliminary screening

表1 菌株形态学观察Table 1 Results of the morphological identification

表2 菌株的生理生化特征Table 2 Results of physiological and biochemical identification
2.2 16S rDNA序列分析
3株菌16S rDNA PCR产物1%琼脂糖凝胶电泳检测结果如图2所示,显示在1 500bp左右均有条带,说明各菌株目标片段均被成功扩增,将PCR原液外送测序。测序结果用Blast在GenBank基因库中进行同源性比对,从列出结果中挑选同源性最高且对比菌株为该种模式株的作为鉴定结果,3株乳酸菌16S rDNA序列同源性比对结果见表3。

图2 16S rDNA PCR产物检测Fig.2 Results of 16s rDNA PCR product detection
提取相似度在98%以上的相关模式株的序列,利用MEGA5.2软件将测得序列与GenBank中的登录菌株16S rDNA序列进行分析,以邻域连接法构建系统发育树,获得菌株sy1、sy3、sy4的分类地位及系统发育地位。由表3和图3可知,菌株sy1、sy3、sy4与登录菌株Lactobacillus plantarum KLDS 1.0728同源性均达到99%,并与其聚在一起,所以将3株菌均鉴定为植物乳杆菌(L.plantarum)。菌株提交Gen-Bank,获得登录号,其中菌株sy1登录号为KJ801850,菌株 sy3登录号为 KM023152,菌株 sy4登录号为KJ801851。

表3 分离乳酸菌16S rDNA序列鉴定结果Table 3 The identification result of LAB based on 16S rDNA sequencing
2.3 发酵分析
从图4的生长曲线可看出,菌株sy3生长适应期较短,接种4~12 h为对数增长期,12 h后进入稳定生长期,其最终菌体量是最大的;菌株sy1生长适应期较长,前10 h为适应期,10~18 h为对数增长期,20 h后进入稳定生长期;菌株sy4整个生长曲线较平缓,6~14 h为对数增长期,14 h后进入稳定生长期。从图5的pH变化情况来看,菌株sy3产酸最快,接种后前8 h急剧产酸,8 h后pH下降趋于平缓;菌株sy1前10 h产酸缓慢,12~18 h产酸迅速,18 h后趋于平缓;菌株sy4整个pH变化曲线最为平缓。可看出,图4和图5的变化趋势相符,反映出3株菌生长情况和产酸量之间具有正相关性,产酸量随菌株生长情况一致呈现出慢-快-慢的趋势。

图3 基于16S rDNA序列的系统发育树Fig.3 Phylogenetic tree of three lactic acid bacteria strains

图4 乳酸菌生长曲线Fig.4 Growth curves of three lactic acid bacteria strains

图5 乳酸发酵pH曲线Fig.5 pH curves of three lactic acid bacteria strains
2.3.2 发酵产物分析
采用TLC法对发酵液进行分析,菌株sy1、sy3、sy4发酵液经点样、展层、显色,显示蓝紫色背景下,各样品在乳酸标准品Rf值处均有清晰可见的黄色斑点;同时 HPLC法分析显示各发酵液在保留时间2.15 min附近均有峰出现,这与相同色谱条件下乳酸标准品保留时间2.148 min相符,如图6和图7所示。以上2种色谱分析方法结果一致,从而对发酵产物进行定性。

图6 HPLC检测乳酸标准品Fig.6 HPLC detection of standard lactic acid
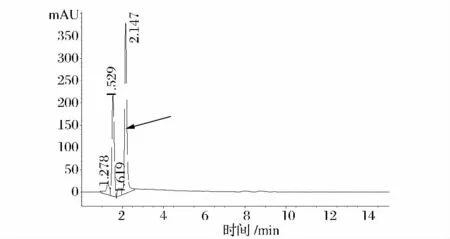
图7 HPLC检测发酵液中乳酸Fig.7 HPLC detection of lactic acid in fermentation broth
摇瓶发酵72 h,经EDTA定钙法测定,sy1发酵液中乳酸钙质量浓度为113.34 g/L,sy3发酵液中乳酸钙质量浓度为130.13 g/L,sy4发酵液中乳酸钙质量浓度为118.09 g/L。经折算,菌株sy1乳酸产量为66 g/L,菌株sy3乳酸产量为76 g/L,菌株sy4乳酸产量为69 g/L。以上结果同图5中菌株的pH变化情况一致。
3 结论
本文从傣家传统酸鱼制品中分离筛选出sy1、sy3、sy4 3株乳酸菌,经伯杰氏细菌鉴定手册有关菌种的鉴定方法结合16S rDNA序列分析,3株菌均鉴定为植物乳杆菌,从鉴定结果初步推断植物乳杆菌是傣家酸鱼发酵的优势乳酸菌群。
乳酸发酵结果表明,3株菌在24 h培养周期内即能迅速产生乳酸,能在pH低于3.5以下生长。在初始糖浓度为100 g/L的摇瓶发酵中,经72 h发酵,检测到菌株 sy1、sy3、sy4 乳酸产量分别为 66、76、69 g/L,糖酸转化率较高,表明所分离菌株具有较好的乳酸发酵性能。虽然与现有生产菌株相比乳酸发酵效率略低,但可作为出发菌株做进一步的乳酸发酵研究,本实验为乳酸生产提供了新的微生物菌株资源。
[1] Tay A,Yang S T.Production of L(+)-lactic acid from glucose and starch by immobilized cells of Rhizopus oryzae in a rotating fibrous bed bioreactor[J].Biotechnology and Bioengineering,2002,80(10):1-12.
[2] Datta R.Technological and economical potential of poly(lactic acid)and lactic acid derivatives[J].FEMS Micr Reviews,2006,16(2-3):221-231.
[3] Hujanen M,Linko S,Linko Y Y,et al.Optimization of media and cultivation conditions for L(+)(s)-lactic acid production by Lactobacillus casei NRRL B-441[J].Appl Micr Biot,2001,56(1-2):126-130.
[4] Narayanan N,Roychoudhury P K,Srivastava A.L-(+)lactic acid fermentation and its product polymerization[J].Electron J Biotechn,2004,7(2):167-179.
[5] Ricardo-Pinheiro de SO,Martinez FAC.Lactic acid properties,applications and production:A review[J].Trends in Food Science& Technology,2013,30:70-83.
[6] 郑佐兴,刘祖同,孙之荣.乳酸生产菌的选育及发酵的研究[J].清华大学学报(自然科学版),1999,30(6):37-43.
[7] 凌代文,冬秀珠.乳酸细菌分类鉴定及试验方法[M].北京:中国轻工业出版社,1999.
[8] 金超.蔗糖发酵生产L-乳酸的研究[D].南宁:广西大学,2006:11-12.
[9] 聂小华,陈学云,侯鲁娜,等.盐干带鱼中乳酸菌的分离鉴定及其生物学特性研究[J].食品工业科技,2010,31(11):165-167.
[10] 林胜利,张琦琳,聂小华.发酵鱼制品中乳酸菌的筛选鉴定及其初步应用[J].食品与发酵工业,2012,38(2):61-65.
[11] 谢静,熊善柏,曾令彬,等.腊鱼加工中的乳酸菌及其特性[J].食品与发酵工业,2009,35(6):32-36.
[12] 邹建春,赵俊仁,张蓉,等.风干武昌鱼中微生物变化及理化性质的分析[J].安徽农业科学,2010,38(28):16 024-16 025.
[13] 张小平,田鸿,严以兰.川西高原牧区牦牛酸乳中的几株乳杆菌发酵特性及系统发育研究[J].食品科学,2010,31(1):152-156.
