氧化钇对磷酸根的吸附及机理研究
2014-12-23孔祥武姜恒宫红
孔祥武,姜恒,宫红
(辽宁石油化工大学 化学化工与环境学部,辽宁 抚顺 113001)
工业生产过程中排放出的废水、残渣中常含有一定量的磷,磷是造成水体富营养化的主要元素之一[1]。由于在某些水体中即使含有低浓度的磷也将诱发水华,如何有效地将磷浓度控制在极低水平已是待解决的技术难题[2]。
大量研究表明,稀土氧化物和稀土盐类具有良好的吸附能力。近年来以稀土元素为主要吸附成分的新型吸附剂的研究成为国内外研究的热点之一[3-7]。氧化钇价格低廉,用途广泛,Li Yongxiu等[8]研究表明,氧化钇超细颗粒焙烧后具有大的比表面积和多孔结构,因此将氧化钇应用在废水除磷中切实可行。王芳芳等[9]用壳聚糖/氧化钇复合材料对Cr(Ⅵ)的吸附研究表明,对Cr(Ⅵ)的去除达到了很好的效果。本实验采用800 ℃焙烧后的氧化钇作为吸附剂,研究对磷酸盐的吸附效果及吸附机理。
1 实验部分
1.1 试剂与仪器
氧化钇(Y2O3,800 ℃焙烧3 h);磷酸二氢钾、抗坏血酸、四水合钼酸铵、氢氧化钠、浓硫酸、盐酸均为分析纯;半水酒石酸锑钾,化学纯。
Spectrum GX 傅里叶变换红外光谱仪;722S 型分光光度计;D/max-RB 型X 射线衍射仪;4-10 型马弗炉;FA2104 型电子天平;JJ-1 型精密增力电动搅拌器;80-2 型台式离心机;DF-101S 集热式恒温加热磁力搅拌器。
1.2 实验方法
1.2.1 静态吸附将200 mL 磷酸二氢钾溶液倒入锥形瓶中,用NaOH (6 mol/L)和HCl (1∶1)调节pH 值。加入Y2O3,在恒温条件下均匀搅拌。每隔一段时间取样,离心,吸取上清液于50 mL 容量瓶中,然后加入2 mL 钼酸铵和1 mL 抗坏血酸,定容,摇匀,静止反应10 min 后测其吸光度,根据标准曲线计算出磷酸根的浓度。计算吸附率和吸附量。
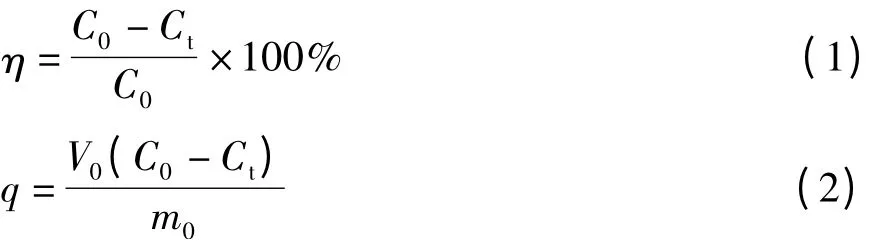
式中 η——吸附率,%;
C0——溶液中磷酸根的初始浓度,mg/L;
Ct——吸附后溶液中磷酸根的剩余浓度,mg/L;
V0——待吸附溶液的体积,mL;
m0——吸附剂的质量,mg。
1.2.2 动态吸附称取一定体积的Y2O3装入夹套吸附柱中(1 cm×30 cm)作为固定相,将KH2PO4以一定的流速流过固定相,接取流出液,当流出液的磷酸盐浓度为10 mg/L(Ct/C0=0.1)为穿透,当流出液的磷酸盐浓度为90 mg/L(Ct/C0=0.9)为饱和,流出液每10 mL 为一份,测定每份流出液磷酸根的浓度。按Thomas 动态吸附模型[10]计算动态吸附的饱和吸附量和速率常数。
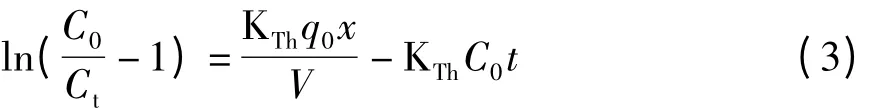
式中 KTh——Thomas 速率常数,mL/(mg·h);
q0——吸附平衡时单位质量的Y2O3吸附磷酸盐的质量,mg/g;
x——吸附柱中吸附剂的质量,g;
V——流速,mL/h;
t——时间,h;
Ct,C0——t 时刻流出液的质量浓度和原溶液的质量浓度,mg/L。
2 结果与讨论
2.1 不同稀土氧化物静态吸附磷酸盐效果
在温度为35 ℃,pH = 2,初始浓度C0=100 mg/L 的200 mL 磷酸盐溶液,吸附时间为90 min,稀土氧化物的投加量为0.1 g 的条件下,用一系列稀土氧化物对磷酸盐进行吸附,结果见表1。
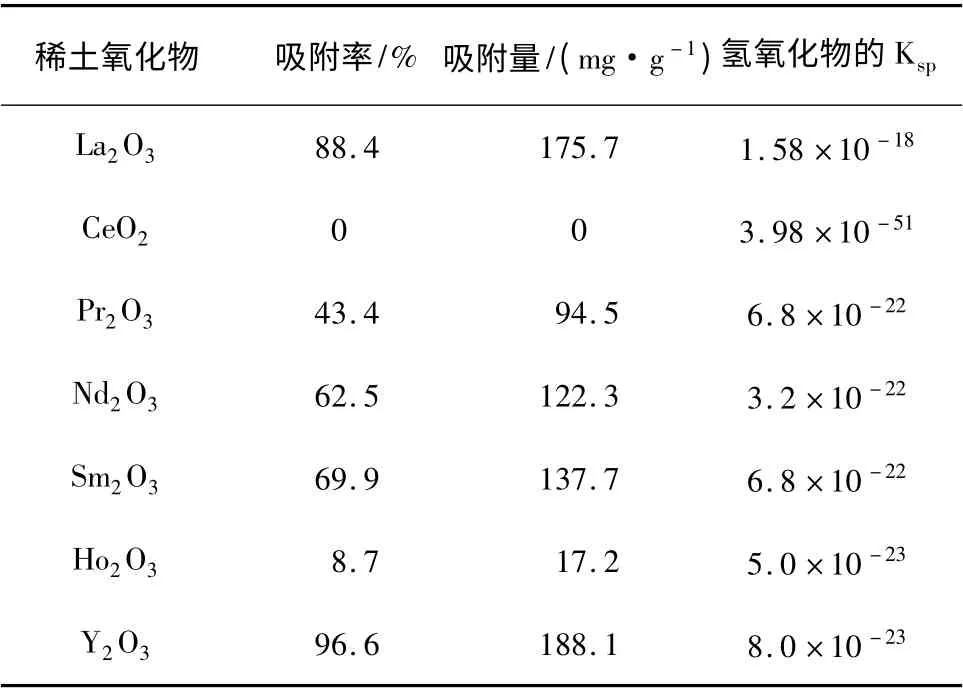
表1 不同稀土氧化物吸附磷酸根效果Table 1 Effects of different rare earth on phosphate adsorption
由表1 可知,氧化钇的吸附效果最好。其中氧化镧在水溶液中不稳定,生成了氢氧化镧,主要通过氢氧化镧对磷酸盐进行吸附[11]。氧化钇在水溶液中不生成氢氧化钇。
2.2 静态吸附中pH 值对吸附量的影响
向初始浓度100 mg/L 的200 mL 磷酸盐溶液中加入0.1 g Y2O3,温度为35 ℃,700 r/min 下恒温搅拌吸附2 h。图1 为pH 值对Y2O3吸附磷酸盐的影响。
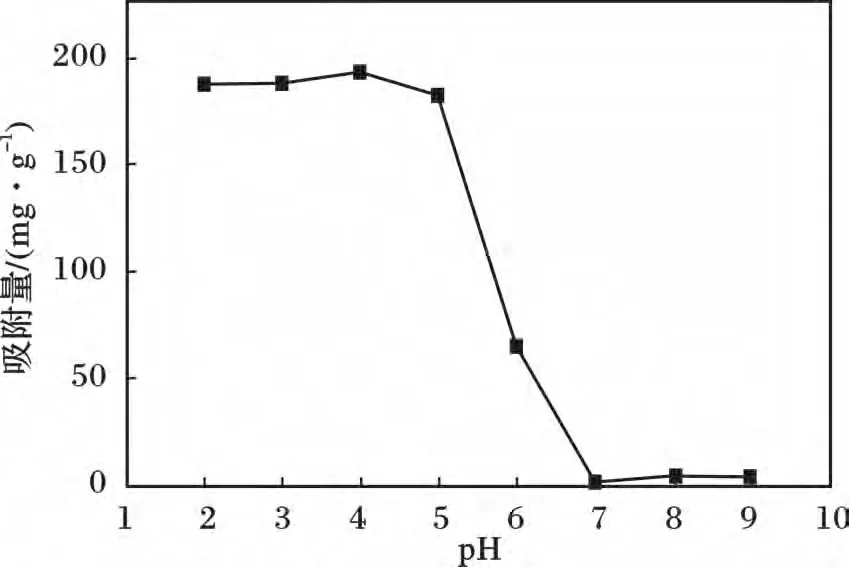
图1 pH 值变化对Y2O3 吸附磷酸盐的影响Fig.1 Effect of pH on phosphate adsorption by Y2O3
由图1 可知,在pH 2 ~5 时,Y2O3对磷酸盐表现出很强的吸附能力,pH=4 时吸附量达到最大,为193.2 mg/g,随着pH 的增大,吸附量明显降低。
2.3 吸附动力学分析
在Y2O3投加量为0.08 g,磷酸盐溶液pH =3,温度为35 ℃条件下,采用准一级、准二级和颗粒内扩散动力学模型,对不同初始浓度的磷酸盐进行静态吸附除磷动力学过程分析,结果见表2。
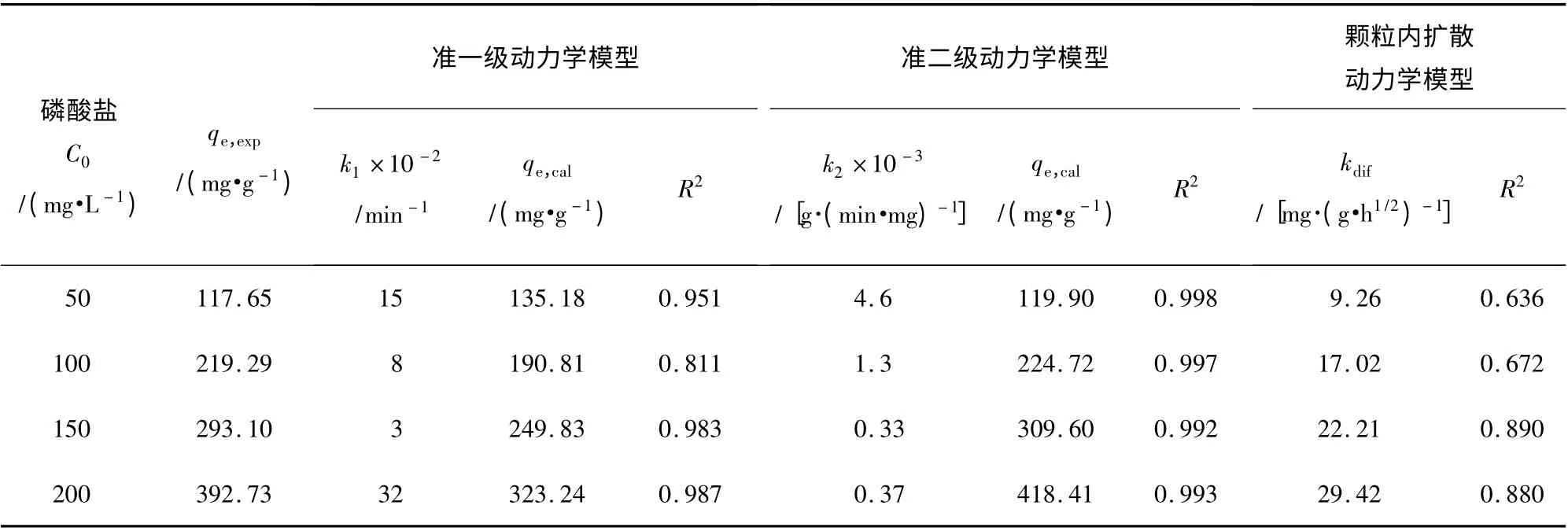
表2 不同初始磷酸盐浓度下的Y2O3 吸附除磷动力学参数及相关系数Table 2 Kinetics parameters and correlation coefficients for phosphate adsorption onto Y2O3 at different initial phosphate concentrations
由表2 可知,吸附过程更加符合准二级吸附动力学,说明磷酸盐在Y2O3表面主要发生了化学吸附[12]。
2.4 氧化钇对磷酸盐的动态吸附
称取1 cm3的Y2O3装入夹套吸附柱中作为固定相,将pH = 3 浓度为100 mg/L 的KH2PO4以20 mL/h的流速流过固定相,此时体积空速为20 h-1,并且保持夹套吸附柱的温度为35 ℃,流出液每10 mL 为一份,测定每份流出液磷酸根的浓度,结果见图2。
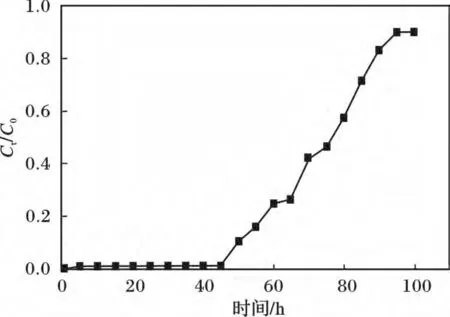
图2 Y2O3 去除PO43-的动态吸附穿透曲线Fig.2 The breakthrough curves of-by Y2O3
由图2 可知,前40 h 内Ct/C0均小于0.1,在50 h 时达到穿透点,90 h 时到达饱和点。说明在体积空速为20 h-1时,Y2O3对磷酸盐的动态吸附效果很好。
图3 为Y2O3动态吸附PO43-Thomas 模型模拟图,通过Thomas 模型对氧化钇动态吸附磷酸盐实验数据进行拟合,得到KTh=0.872 7 mL/(mg·h),q0=150.46 mg/g,R2=0.929 6,Thomas 模型对Y2O3动态吸附拟合结果较好,在体积空速为20 h-1时,动态吸附的饱和吸附量可达到150.46 mg/g。
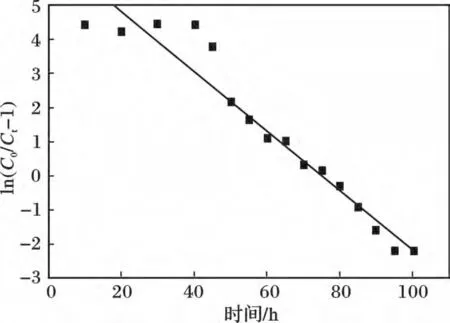
图3 Y2O3 动态吸附PO43-Thomas 模型模拟Fig.3 Dynamic adsorption process of PO43- by Y2O3 were fitted by the Thomas model
2.5 磷酸盐静态吸附放大实验
将5 g Y2O3加入到pH =2 的200 mL 的5 g/L磷酸盐溶液中,在温度35 ℃条件下吸附90 min,吸附磷酸盐后的产物记为Y2O3-P。测得吸附后溶液的磷酸根浓度为1.588 g/L,计算吸附磷酸根的质量为0.752 4 g。通过过滤、水洗、甲醇洗,100 ℃烘干2 h,得到5.642 9 g 产物。另外,为探究Y2O3在酸性溶液的稳定性,将5 g Y2O3加入到pH =2(用稀盐酸调节)的20 mL 水中,在80 ℃烘干24 h,所得产物记为Y2O3-W。Y2O3-P、Y2O3扫描电镜分析结果见图4。

图4 氧化钇吸附前(a)及吸附后(b)的电镜图Fig.4 SEM photograph of Y2O3 before phosphate adsorption(a)and SEM photograph of Y2O3 after phosphate adsorption (b)
由图4 可知,吸附前孔隙多,表面粗糙;吸附后,氧化钇表面较为平坦,表面空隙被填满。可见磷酸盐通过物理吸附或化学吸附,从溶液中转移到氧化钇表面。
Y2O3、Y2O3-W 和Y2O3-P 红外光谱见图5。
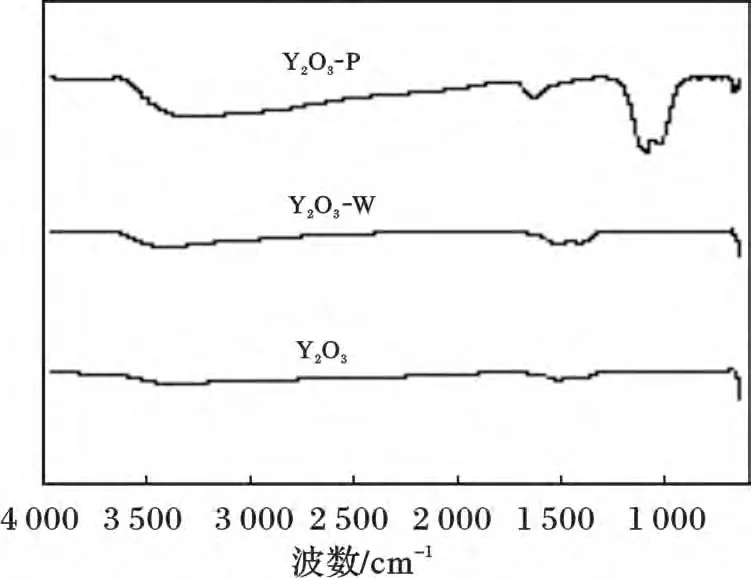
图5 Y2O3、Y2O3-W、Y2O3-P 的IR 谱图Fig.5 The IR curves of Y2O3,Y2O3-W and Y2O3-P
由图5 可知,Y2O3和Y2O3-W 的谱图没有明显变化,Y2O3-P 的1 076 cm-1处有强而宽PO43-弯曲振动峰,并且在1 007 cm-1处出现了肩峰,说明Y2O3对磷酸盐具有较强的吸附能力。
图6 为Y2O3-P、Y2O3-W、Y2O3的XRD。
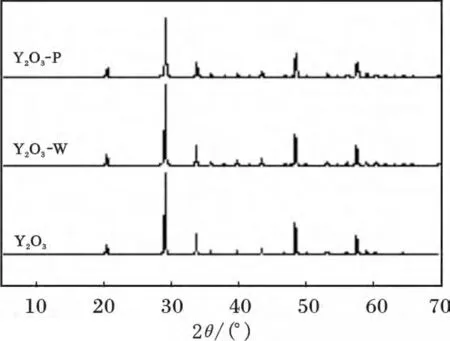
图6 Y2O3、Y2O3-W、Y2O3-P 的XRD 谱图Fig.6 XRD curves of Y2O3,Y2O3-W and Y2O3-P
由图6 可知,Y2O3在酸性条件的水中及吸附磷酸盐后未发现其他物相,说明Y2O3在酸性的水溶液中是一种稳定的化合物,且吸附过程中并不是通过生成氢氧化钇或直接生成磷酸钇进行吸附。
2.6 吸附机理探讨
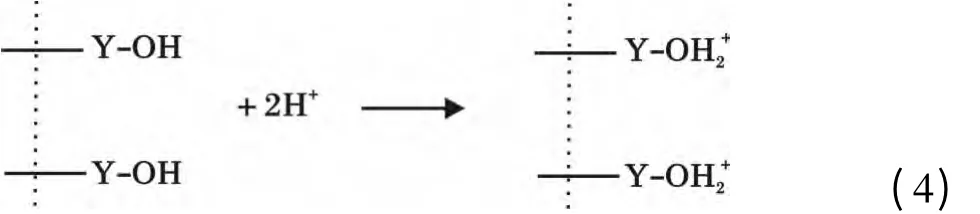
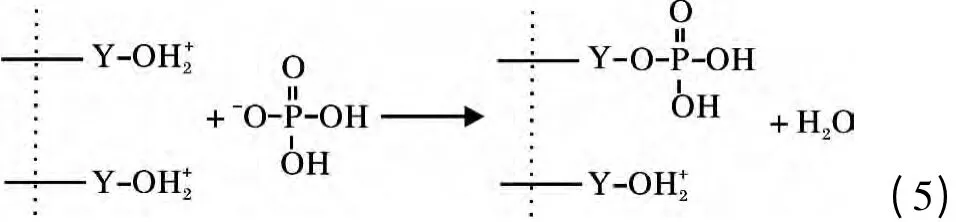
将0.08 g Y2O3投入到150 mg/L 的200 mL 磷酸盐溶液,溶液pH =3,待吸附完全后,用6 mol/L的NaOH 调溶液pH=14,解吸4 h,计算出解吸率仅为3.69%,说明Y2O3与磷酸盐结合很牢固,吸附的主要过程并非发生物理吸附而是化学吸附,并不是通过生成氢氧化钇或直接生成磷酸钇进行吸附。和很多氧化物一样,Y2O3存在表面羟基[13],在吸附过程中Y2O3在磷酸盐溶液中与水分子接触后表面立即与水结合,相界面发生荷电离子转移,使得氧化钇表面羟基化,表面羟基可离子化而表现出Lewis 酸碱性,进而可与溶液中的配体进行反应。在pH <7时,Y2O3的表面羟基被质子化,与H2PO4
-和HPO42-生成单齿单核和双齿双核表面络合物[14],其机理如下:
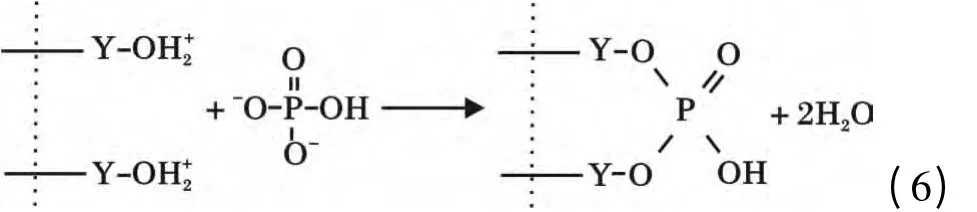
随着pH 的增大,Y2O3表面电性由正变负,磷酸盐更多的转变为PO43-,二者间的斥力很大,不利于磷酸根离子与Y2O3的结合,故吸附量明显降低。
3 结论
(1)在静态吸附中,在pH 较低时,Y2O3表现出很强的吸附能力,pH=4 时吸附效果最好,吸附量为193.2 mg/g,随着pH 的增大,吸附量明显降低。
(2)用Thomas 模型对Y2O3动态吸附拟合的结果较好,在体积空速为20 h-1时,动态吸附的饱和吸附量可达到150.46 mg/g。
(3)Y2O3对磷酸盐有较高的吸附速率,吸附属于准二级动力学模型,吸附过程主要为化学吸附。
(4)Y2O3在酸性水溶液中是一种稳定的化合物,吸附过程中并不是通过生成氢氧化钇或直接生成磷酸钇进行吸附。Y2O3在磷酸盐溶液中表面羟基化,在pH <7 时表面羟基质子化,与和生成单齿单核和双齿双核表面络合物。
[1] 梁语燕,李元慈,董岁明.煤炉渣对污水中磷离子吸附作用研究[J].应用化工,2013,42(10):1870-1872.
[2] 印露,雷国元,李陈君,等. 焙烧态镁铝铁类水滑石对磷酸根离子的吸附[J].环境化学,2012,31(7):1049-1056.
[3] 郭会超,李文军,王环颖,等. 几种水合金属氧化物的磷酸根吸附性能[J]. 环境科学与技术,2011,34(3):15-18.
[4] 丁文明,黄霞,张力平. 水和氧化镧除磷的试验研究[J].环境科学,2003,24(5):110-113.
[5] 焦中志,张昱,杨敏,等. 稀土铈基无机吸附剂对氟的吸附性能[J].环境化学,2002,21(4):365-370.
[6] Zhang Ling,Wan Lihua,Chang Ning,et al. Removal of phosphate from water by activated carbon fiber loaded with lanthanum oxide[J]. Journal of Hazardous Materials,2011,190:848-855.
[7] 赵春红,任卿,宁平,等.稀土吸附剂在水处理方面的研究进展[J].中国稀土学报,2005,23(S1):90-93.
[8] Li Yongxiu,Lin Xiaoyun,Wang Yizheng,et al.Preparation and characterization of porous yttrium oxide powders with high specific surface area[J]. Journal of Rare Earth,2006,24:34-38.
[9] 王芳芳,葛明桥,王亚洲,等.有机-无机复合材料壳聚糖/氧化钇对Cr(Ⅵ)的吸附动力学与热力学研究[J].化工新型材料,2012,40(8):97-106.
[10] 邹卫华,韩润平,陈宗璋,等. 锰氧化物/石英砂(MOCS)对铜和铅离子的动态吸附[J]. 应用化学,2006,23(3):299.
[11]罗芳,詹凤平,江映翔,等.固定化活性氧化镧除磷的实验研究[J].工业水处理,2010,30(6):11-14.
[12]Ho Y S,McKay G.Pseudo-second order model for sorption processes[J]. Process Biochemistry Biochemistry,1999,34(5):451-465.
[13]赵雷洪,郑小明,费金华.稀土氧化物固体碱催化剂的表面性质[J].催化学报,1996,17(3):227-231.
[14]夏汉平,高子勤.磷酸盐在土壤中的竞争吸附与解吸机制[J].应用生态学报,1993,4(1):89-93.
