异甘草素对低氧PC12细胞凋亡相关基因Bcl-2、Bax的表达
2014-12-20付亚杰李长栋荔志云孙建军
付亚杰,李长栋,荔志云,季 玮,孙建军
低氧是临床各种疾病中极常见的一类病理过程,脑的低氧也是导致机体死亡的重要原因之一。氧自由基的产生、细胞内Ca2+超载、神经递质的毒性作用、相关酶类的变化、炎症反应、线粒体功能的异常、细胞凋亡等都是造成缺血低氧性脑损害的因素。异甘草素(ioshquiritigenin,ISL)为甘草中有效成分之一。文献报道,异甘草素具抗脂质过氧化[1]、松弛血管[2]、抑制血小板聚集、抗病毒、抗肿瘤[3]及雌激素样活性[4]、抗细胞凋亡[5]等多种药理作用。本研究采用体外培养PC12细胞,建立细胞低氧损伤模型,采用Flow cytometry方法检测PC12细胞的凋亡;采用RTPCR技术分析Bc1-2和Bax mRNA水平的表达变化,探讨其对低氧神经细胞的保护作用机制。
材料与方法
1 实验细胞
PC12细胞为兰州大学基础医学院惠赠,本实验室传代培养。
2 主要仪器和试剂
二氧化碳培养箱(美国Thermo Revco公司);超净工作台(美国Sigma公司);低温高速台式离心机(UNIVERSAL116型,德国Hetaeus公司):倒置相差显微镜(CKX41-A32PH型,日本Olympus公司);紫外分光光度(德国Heraeus公司);洁净工作台(SW-CJ-2FD型,苏州洁净化设备有限公司);微量移液器(大龙医疗设备上海有限公司):酶标仪(Bio-Tek公司);-80℃超低温冰箱(MDF-381型,日本三洋有限公司);4℃冰箱(青岛海尔公司):电子天平(AG-135型,瑞士梅特勒公司);电热恒温水箱(江苏仪器厂);稳压稳流电泳仪(北京六一仪器厂),日本Olympus公司);水平电泳槽(北京六一仪器厂);胎牛血清(FBS)(购于浙江天杭生物科技有限公司);异甘草素(天津马克生物技术有限公司产品HPLC≥98%,批号:GC-20120203);Annexin V-FITC/PI双染细胞凋亡检测试剂盒(南京凯基公司);LDH检测试剂盒(南京凯基公司);SOD检测试剂盒(南京凯基公司)。
3 PC12细胞的培养方法
将装有PC12细胞的冻存管从液氮中取出,迅速投入37℃温水中,边震荡边观察,在1min内将冻存管中液体完全融化。超净工作台内将细胞移入离心管,加入新鲜DMEM培养基3~5ml,1000r/min离心5min,弃上清,加入4ml含10%胎牛血清的培养基,吹打均匀,将细胞移入60mm培养皿中,于37°C,5%CO2培养箱中培养过夜,第2d换液,弃掉未贴壁细胞。当细胞铺满瓶底70%~80%时,吸净培养基,磷酸盐缓冲液(PBS)清洗1遍,加入1ml 0.25%胰酶消化细胞,显微镜下观察,当细胞圆缩,周边折光性增强时,吸净胰酶,加入含10%胎牛血清的DMEM培养基,吹打细胞,使细胞均匀悬浮于培养液中,将细胞传至新的细胞培养皿中。
4 ISL对正常PC12细胞形态及活力的影响
取对数生长期、突起较多的细胞,胰酶消化,1000r/min离心5min,弃上清,用含10%血清的DMEM培养基重悬细胞,细胞计数板计数,调整密度为1×105个/ml,随机接种于96孔培养板中,每孔100μl,四周边孔加200μl PBS填充,过夜,待细胞贴壁。将实验组分为正常组,添加ISL组,后者分别加入终浓度为5、10、20、40、80μg/ml的ISL,每组5个复孔,置于37°C、5%CO2培养箱内培养48h后,显微镜下观察细胞形态学改变,四甲基偶氮唑蓝法(MTT)检测不同浓度ISL对PC12细胞的影响。
5 细胞处理、分组与低氧模型建立
取对状态良好、突起较多的细胞,胰酶消化,1000r/min离心5min,弃上清,用含10%血清的DMEM培养基重悬细胞,细胞计数板计数,调整密度为1×105个/ml,随机接种于96孔和6孔培养板中,96孔板每孔100μl,6孔板每孔1.5ml;之后分为C(对照组)、H(模型组,即单纯低氧组)、H1(ISL低剂量组)、H2(ISL中剂量组)、H3(ISL高剂量组),每组5个复孔,待细胞贴壁后,对C、H组不加入ISL,对H1、H2、H3组分别加入2、4、8μg/ml的ISL,加药完成后放入低氧环境中培养,开始计时,按低氧后6、12、24h收取细胞,同时实验,见表1。
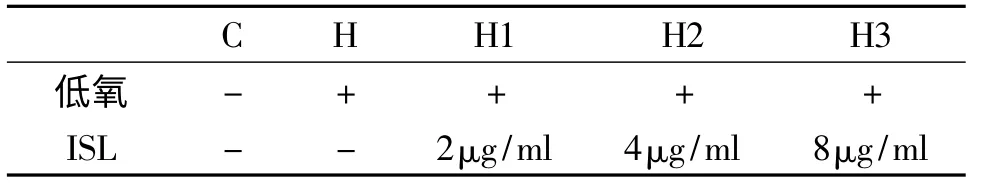
表1 实验分组及给予的干预条件
低氧装置为自制三气通气箱,置于37°C、5%CO2培养箱内中,其内充以95%N2+5%CO2混合气体,外接传感器来来控制氧含量,进气口装有过滤膜,以此装置制备PC12细胞低氧模型。
6 指标检测
6.1 流式细胞技术检测PC12细胞调亡 用不含乙二胺四乙酸(EDTA)的胰酶消化收集细胞,PBS洗涤细胞2次(1500rpm离心5min),加入500μl的Binding Buffer悬浮细胞,加入5μl Annexin V-FITC混匀后,加入5μl Propidium Iodide,混匀。室温、避光、反应5~15min,在1h内进行流式细胞仪的检测。
6.2 RT-PCR法检测Bcl-2、Bax mRNA的变化 取各时间点培养结束后的细胞,提取总RNA,检测RNA的完整性,检测其浓度,取800ng总RNA进行TaKaRa PrimeScript RT Master Mix试剂盒合成cDNA,反应体系为20μl,反应条件为37℃15min,85℃5s。通过荧光定量PCR扩增,反应体系为20μl,95℃3min,95℃10s,60℃30s,分别检测Bcl-2、Bax mRNA的表达水平。
6.3 RT-PCR
(1)引物设计(大连宝生物服务有限公司合成),基因和引物序列(5'-3')如下:

(2)反 应 体 系:SYBR Premix10μl,引 物(25pmol/ul)0.6μl×2,cDNA 2μl,ddH2O 6.8μl;总体积20μl。
(3)反应步驟:95℃,3min预变性;95℃,10s变性;60℃,30s退火延伸,40个循环。
7 统计学处理
结 果
1 PC12细胞的形态学观察
正常状态下分化的PC12表现出神经元的特性,细胞形态为梭形、多角形,细胞突起长,细胞胞膜光滑,细胞间建立突触连接交联成网状(图1),传代4h后细胞贴壁生长,细胞分裂迅速,每2~3d即可传代,生命力旺盛,适于实验。
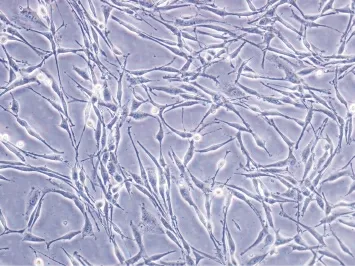
图1 分化型PC12细胞(×400)
2 ISL对正常PC12细胞形态及活力旳影响
实验表明,ISL浓度在10μg/ml以下的实验组细胞存活率与正常组之间没有统计学差异,而20、40及80μg/ml剂量组对PC12细胞有一定的毒性作用(图2)。因此我们选择10μg/ml以下的3个剂量,即2、4、8μg/ml剂量作为给药浓度并进行后续研究。

图2 MTT法测定ISL对正常PC12细胞活力的影响。不同浓度ISL培养48h,数据以±s表示,n=5;与未加药组相比:**P<0.01
3 低氧对PC12细胞活力的影响及ISL的作用
加入MTT培养4h后细胞内生成蓝紫色结晶甲臜(图3)。左为模型组低氧24h后,出现多量的圆形“空泡”(如箭头所示),此为死亡的细胞,而在右图,ISL 8μg/ml组低氧24h后,几乎未见空泡形成,而且多数细胞仍保持正常形态,有突起,未聚集成团。
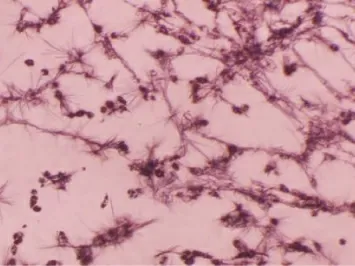
图3 加入MTT培养4h后生成蓝紫色结晶甲臜的情况(×400)。左为模型组,右为ISL 8μg/ml组
MTT结果显示,对照组细胞开始计时后即进入对数期生长,细胞随时间不断分裂增殖,活力随时间增强;而模型组细胞活力明显减弱;ISL组低氧后细胞活力较低氧组增强,细胞存活率增高,两者之间有显著性差异。ISL 8μg/ml组低氧24h效果最为显著(表2)。
表2 ISL对PC12细胞低氧后细胞活力的影响(n=5,±s)
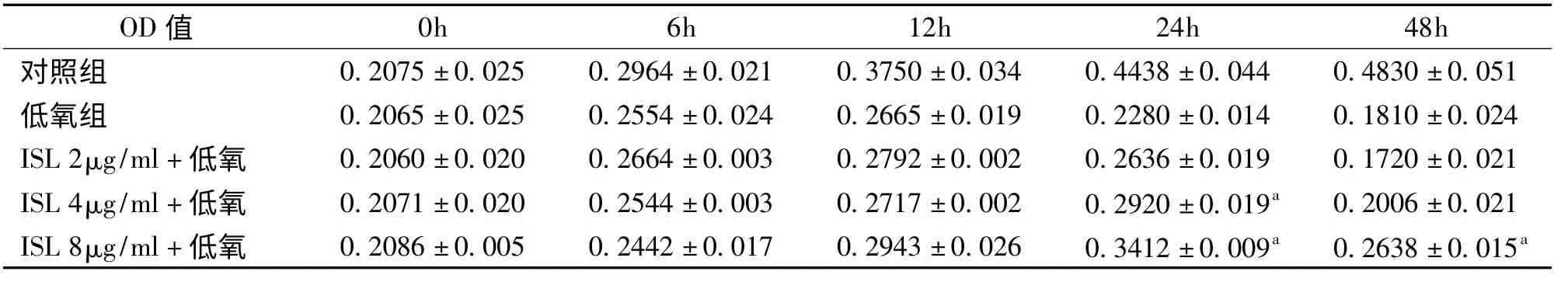
表2 ISL对PC12细胞低氧后细胞活力的影响(n=5,±s)
测定波长为490nm,与低氧组比较:a P<0.05
?
4 AnnexinⅤ/PI双染检测PC12细胞凋亡
细胞低氧损伤后,用AnnexinⅤ/PI双染进行荧光标记,通过流式细胞仪区分活细胞、凋亡细胞和坏死细胞,在双变量流式细胞仪的散点图上,左下象限为活细胞,右上象限显示非活坏死细胞,右下象限为调亡细胞。检测发现:低氧24h后,模型组调亡细胞率(36.79±1.26)%较之正常组明显增加,而ISL 8μg/ml组,其调亡细胞数量减少(17.52±1.03)%,活细胞数量较模型组明显增多。提示ISL对低氧损伤引起的细胞调亡具有保护作用。此外,流式细胞仪结果显示对照组细胞有些许调亡和坏死,可能与胰酶消化、吹打等操作损伤PC12细胞有关(表3、图4)。
表3 低氧对PC12细胞调亡的影响以及ISL的作用(±s,n=5)

表3 低氧对PC12细胞调亡的影响以及ISL的作用(±s,n=5)
与对照组比较:##P<0.001;与低氧组比较:**P<0.001
?

图4 低氧对PC12细胞调亡的影响及ISL的作用。与对照组比较:##P<0.001;与低氧组比较:**P<0.001
5 各组Bcl-2 mRNA表达变化
RT-PCR检测低氧24h后细胞,单纯低氧组Bcl-2 mRNA表达低于对照组(P<0.01),加药低氧组的Bcl-2 mRNA与模型组相比,表达均有所升高(P<0.01)(图5)。

图5 各处理组Bcl-2 mRNA的表达变化(24h)。与对照组比较:##P<0.001;与模型组比较:**P<0.001
6 各组Bax mRNA表达变化
低氧24h后,模型组Bax表达高于对照组(P<0.01),加药低氧组的Bax与模型组相比,表达均有所降低(P<0.01)(图6)。

图6 各处理组Bax mRNA的表达变化(24h)。与对照组比较:##P<0.001;与低氧组比较:**P<0.001
讨 论
甘草是一种应用广泛的传统中药。现代药理表明,甘草除具有镇痛、镇咳、抗炎、抗溃疡、抗变态反应等[6]作用外,还具有明显的神经保护作用[7]。ISL为甘草中有效成分之一,其化学名称为4,2',4'-三羟基查耳酮,为甘草中的一种有效单体,属黄酮类化合物。
在神经细胞低氧损伤的过程中,神经元的坏死与凋亡同时发生,因此区别坏死和调亡的细胞就成为研究低氧损伤程度及ISL作用方式的重要内容。本课题用Annexin V/PI双染细胞,流式细胞仪检测不同浓度ISL作用下低氧细胞的调亡率,实验发现ISL可降低低氧诱导的细胞调亡,并有一定的浓度依赖性。
Bcl-2最初发现位于滤泡性淋巴瘤t(14,18)染色质处,Bcl-2基因的表达产物主要位于线粒体膜、核膜、粗面内质网上[8]。当细胞受到某种有害因素刺激出现病理改变时,它会发挥抗凋亡作用。Vaux等[9]首次报道Bcl-2能够抑制细胞凋亡,延长细胞生存期。当神经细胞低氧时,细胞内外环境发生改变,致使一些因子成为诱导凋亡发生的因素。研究发现,在受损伤的脑中Bcl-2可抑制神经元及神经胶质细胞的凋亡,其表达增加可防止细胞受外界因素刺激后启动凋亡[10]。Bcl-2抑制缺血低氧性神经细胞损伤的可能机制有:降低细胞内钙[11],阻断Caspase依赖的内在凋亡启动通路[12],阻断凋亡诱导因子(AIF)依赖的神经细胞凋亡通路[13],抗氧化应激作用[14]。1993年,Oltvai等[15]首先发现Bax基因作为一个调控Bcl-2的相关基因,与Bcl-2约有21%的氨基酸序列同源,故认为Bax为Bcl-2家族成员。与Bcl-2抑制细胞凋亡相反,Bax能够促进细胞凋亡,它可能是通过形成Bcl-2-Bax复合物来实现的。Bax并不阻断凋亡,而是对抗Bcl-2抑制凋亡的作用。Bcl-2家族蛋白通过调控线粒体途径,对细胞凋亡发挥作用,其过程十分复杂,任何影响Bcl-2以及Bax表达的因素均可影响细胞的凋亡。我们的实验发现,低氧损伤使PC12细胞Bcl-2 mRNA表达下降,Bax mRNA表达升高,最终使PC12细胞走向凋亡。在低氧损伤中给予ISL,可升高PC12细胞Bcl-2 mRNA的表达,降低Bax mRNA的表达,Bcl-2通过激活抗凋亡机制,稳定线粒体,减轻低氧细胞凋亡,这可能是ISL保护神经细胞抗低氧损伤的机制之一。
本研究显示,ISL能够在基因层面上调Bcl-2 mRNA、下调Bax mRNA的表达,从而减少细胞凋亡。
[1]Cabrerizo S,De La Cruz JP,Lopez-Villodres JA,et al.Role of the inhibition of oxidative stress and inflammatory mediators in the neuroprotective effects of hydroxytyrosol in rat brain slices subjected to hypoxia reoxygenation[J].J Nutr Biochem,2013,24(12):2152-2157.
[2]Zhan C,Yang J.Protective effects of isoliquiritigenin in transient middle cerebral artery occlusion-induced focal cerebral ischemia in rats[J].Pharmacol Res,2006,53(3):303-309.
[3]詹春,杨静,詹莉,等.异甘草素对脑缺血再灌注小鼠认知功能障碍及能量代谢的影响[J].中国药理学通报,2005,21(2):213-216.
[4]张明发,沈雅琴.甘草粗提物及其黄酮类成分的抗肿瘤作用[J].现代药物与临床,2010,25(2):124-129.
[5]Hajirahimkhan A,Simmler C,Yuan Y,et al.Evaluation of estrogenic activity of licorice species in comparison with Hops used in botanicals for menopausal symptoms[J].Plos One,2013,8(7):1-11.
[6]Hwang CK,Chun HS.Isoliquiritigenin isolated from licorice Glycyrrhiza uralensis prevents 6-hydroxydopamine-induced apoptosis in dopaminergic neurons[J].Biosci Biotechnol Biochem,2012,76(3):536-543.
[7]Zhao X,Mei W,Gong M,et al.Antibacterial activity of the flavonoids from dalbergia odorifera on ralstonia solanacearum[J].Molecules,2011,16(12):9775-156.
[8]Reed JC.Bcl-2 and the regulation of programmed sell death[J].JCell Biol,1994,124(1-2):1-6.
[9]Vaux DL,Cory S,Adanms JM,et al.Bcl-2 gene promotes haemopoietic cell survival and cooperates with c-myc to immortalize per-B cell[J].Nature,1988,335(6189):440-442.
[10]Nam SC,Philip MB,Catherine JP,et al.Human Bcl-2 protects against AMPA receptor-mediated apoptosis[J].Neurochem,2000,74(4):1613-1620.
[11]Oiaz-Prieto N,Herrera-Peco I,de Diego AM,et al.Bcl-2 mitigates Ca2+entry and mitochondrial Ca2+overload through downregulation of L-type Ca2+channels in PC12 cells[J].Cell Calcium,2008,44(4):339-352.
[12]Zhao H,Yenari MA,Cheng D,et al.Bcl-2 overexpression protects against neuron loss within the ischemic margin following experimental stroke and inhibits cytochrome Ctranslocation and caspase-3 activity[J].J Neurochem,2003,85(4):1026-1036.
[13]Zhao H,Yenafi MA,Cheng D,et al.Bcl-2 transfection via herpes simplex virus blocks apoptosis inducing factor translocation after focal ischemia in the rat[J].J Cereb Blood Flow Metab,2004,24(6):681-692.
[14]Lee M,Hyun DH,Marshall KA,et al.Effect of overexpression of Bcl-2 on cellular oxidative damage,nitric oxide production,antioxidant defenses,and the proteasome[J].Free Radic Biol Med,2001,31(12):1550-1559.
[15]Oltvai ZN,Milliman CL,Korsmeyer SL.Bcl-2 heterodimerizes in vivo with a conserved homdog,Bax,that accelerates programmed cell death[J].Cell,1993,74(4):609-619.
