酿酒酵母全蛋白的提取
2014-12-16方芳赵华咸漠刘辉
方芳,赵华,咸漠,刘辉
1(天津科技大学生物工程学院,天津,300457)
2(中国科学院生物基材料重点实验室,中国科学院青岛生物能源与过程研究所,山东青岛,266101)
酵母菌是人类利用最早的微生物,广泛应用于食品、医药和生命科学等领域。近年来,随着数十种酵母基因组测序的完成,蛋白质组学研究成为酵母生物学机制研究的热点。双向电泳技术(2-DE)是蛋白质组学研究中的重要技术,样品制备是双向电泳的关键步骤。在样品制备过程中,细胞破碎效果、裂解液中的蛋白溶解度、蛋白的修饰和降解等因素将直接影响到2-DE的准确度和重复性[1]。由于蛋白质样本的类型和来源、所处的状态以及实验目的和要求各不相同,目前并没有一个通用的制备方法。要实现对低丰度蛋白的检测,尽可能完全地破碎细胞,高效地溶解蛋白,避免低丰度蛋白的大量损失是至关重要的。如果所采用的制备方法的蛋白释放率低,那么低丰度蛋白的损失会比较大,从而影响到低丰度蛋白在2-DE电泳中的分辨率以及检测鉴定。
文献报道的酿酒酵母2-DE样品制备方法很多,如玻璃珠机械破碎、超声破碎、表面活性剂处理、高压破碎、酶法、沉淀法等,但是总体上蛋白释放率在5%左右甚至更低[2-4],远低于酵母细胞的蛋白含量,蛋白图谱中35 kDa以下的低丰度蛋白数量少、总的蛋白点个数也不多并且低丰度蛋白的分辨率很低。因此现有方法还无法完全满足对低丰度蛋白检测的需求。同时虽然有少数关于酵母细胞破碎方法比较的报导,如超声破碎、玻璃珠破碎以及二者相结合的方法[5],超声破碎、超声结合表面活性剂处理[6]等,但是还缺乏对样品制备方法的综合比较和分析。考虑到酿酒酵母细胞壁机械强度大,破壁和胞内蛋白提取困难的特点,为了提高蛋白溶解度以及低丰度蛋白在双向电泳图中的分辨率,本文以蛋白浓度和蛋白释放率为指标,综合考虑操作的简便性等因素,比较了制备酿酒酵母全蛋白的常用方法,初步确定了玻璃珠方法为较理想的制备方法,在此方法的基础上,对重要的操作参数(如破碎次数、玻璃珠用量、装液比)通过单因素和正交试验进行了优化,并通过2-DE验证,得出了蛋白点全面、溶解度高、低丰度蛋白清晰、适用于蛋白质2-DE分析的酿酒酵母菌全蛋白制备方法。
1 材料与方法
1.1 原料
酿酒酵母菌(Saccharomyces cerevisiae YB332),基因型:MATa NMT1 ura3 his3A200 ade2 lys2-801 leu2 FAA1 FAA2 FAA3 FAA4,来源:华盛顿大学药学院分子生物学和药理学实验室。
1.2 培养基
YPD液体培养基:酵母膏1%,蛋白胨2%,葡萄糖2%。
1.3 主要材料与试剂
玻璃珠:Sigma-G9268。
双向电泳胶条:GE Healthcare ImmobilineTMDryS-trip(pH=4 ~7,24 cm)。
裂解液:8 mol/L尿素,2 mol/L硫脲,4%(w/v)CHAPS,1%(w/v)DTT,0.8% 两性电解质 pH 3 ~11,1 mmol/L PMSF,35 mmol/L Tris,5 mmol/L EDTA,DTT、两性电解质临用前再加。
SDS-Tris HCl 缓冲液:0.1 mol/L Tris-HCl,pH 7.0,1.0%(w/v)SDS,1 mmol/L PMSF。
1.4 仪器设备
IS-RDS3恒温振荡器,Crystal Incubator Shaker;IS-RDS3恒温振荡器,上海福玛;Cary 50-UV-Vis紫外分光光度仪,Varian;Vortex-Genie-2涡旋振荡仪;E1061高压破碎仪,Constant Systems LTD;VCX130超声破碎仪,Sonics;Ettan双向电泳系统(Ettan IPG-phor3,Ettan DALT six)GE Healthcare。
1.5 酵母培养
酵母细胞接种于5 mL YPD液体培养基进行种子培养,220 r/min,30℃培养20 h。取1 mL菌液转接到100 mL YPD液体培养基中,220 r/min,30℃培养27 h左右,OD600=1.2左右,低温离心收集菌体。
1.6 全蛋白制备方法
1.6.1 方法 1
参照Curto等[2]的方法并做适当修改。取50 mg干重的菌体沉淀,用 10 mL Tris-HCl(pH 8.8,50 mmol/L)清洗菌体,6 000 r/min离心10 min,弃上清液,重复2次,向上述离心管中加入0.6g酸洗玻璃珠,1 mL裂解液于旋涡振荡仪上振荡30 s,冰浴30 s,重复60次,4℃,13 000r/min离心10 min收集上清液,待测蛋白浓度。
1.6.2 方法 2
参考Sudar等[5]超声破碎的参数并做适当修改,将待破碎溶液放在含有冰水混合物的烧杯中进行超声破碎,超声条件为60 W,20 kHz,工作3 s,冰浴3 s,工作30 min,超声完后4℃离心收集上清液。
1.6.3 方法 3
按方法1向菌体与裂解液混合物中加入玻璃珠,然后按方法2操作条件进行破碎[2,5]。
1.6.4 方法 4
参考Kolkman等[7]操作条件并做适当修改,用0.35 g酸洗玻璃珠破碎65 mg菌体沉淀,破碎60 s,冰浴30 s,6 次,加入650 μL 95 ℃ SDS-Tris HCl缓冲液,将样品煮沸10 min,在冰上冷却后,加入2 mL裂解液在冰中振荡1 h,6 000 r/min离心10 min,收集上清液。
1.6.5 方法 5
按照Harder等[6]报道的方法,向50 mg干重的样品中加入95℃ SDS-Tris HCl缓冲液超声60 W,20 kHz,超声3次,每次1 s,之后将样品煮沸5 min后加入2 mL裂解液冰浴冷却,在冰盒中振荡1 h,6 000 r/min离心10 min,收集上清液。
1.6.6 方法六
的方法并做适当修改,2 mL裂解液悬浮50 mg菌体沉淀,使用Constant Systems LTD高压破碎仪在20KPSI条件下破碎上述菌悬液,破碎3次,离心收集上清液[8]。
1.7 蛋白浓度测定
采用Bradford方法在紫外分光光度仪中测定595 nm处的吸光值来检测蛋白浓度。
1.8 蛋白释放率的测定
蛋白释放率的测定可以通过测量上清液中可溶性蛋白的含量来确定细胞破碎的程度。蛋白释放率:

1.9 双向电泳
操作步骤参考文献[9]。
2 结果与讨论
2.1 蛋白制备方法的比较
按照文献报道的方法,进行酿酒酵母全蛋白制备,结果见表1。由表1可知,方法1蛋白浓度和蛋白释放率比较理想,分别是 0.92±0.01 g/L 和6.31% ±0.05%,该方法采用玻璃珠破碎,操作简便,样品间不会交叉污染,不需要高压设备,不添加SDS等试剂,低温提取过程也有利于蛋白充分溶解[10-13]。方法2采用超声破碎,蛋白释放率最低,为5.57% ±0.11%,与 Iida 等[14]报道的蛋白释放率(4.67% ±0.14%)接近。虽然有超声破碎酵母的报道[15],但是由于酵母细胞壁厚,单纯超声破碎酵母细胞的方法总体效率都不高。方法3采用超声和玻璃珠相结合的破碎方法,虽然在超声过程中添加玻璃珠能够提高超声的空化作用,但结果表明,其蛋白提取效果与方法1相比较并没有显著性差异,从操作简便性考虑,方法1优于方法3。方法4采用玻璃珠和表面活性剂SDS以及高温处理酵母细胞,蛋白释放率为5.85%±0.04%,蛋白浓度为0.78 ±0.03 g/L。该方法操作简便,有利于大量样品的处理,但是操作过程需要将样品煮沸,可能造成蛋白的损失,不利于提高蛋白的释放率和终浓度。另外该方法采用了SDS阴离子去污剂,其缺点是能与蛋白质形成带负电的复合物,可能会影响到2-DE等电聚焦过程。方法5采用超声结合表面活性剂SDS和高温处理酵母细胞,其效果与方法四接近。方法6采用高压细胞破碎仪破碎酵母,蛋白浓度和蛋白释放率分别为0.83±0.05 g/L和5.96% ±0.08%,该方法非常简便,易于操作。
通过比较蛋白浓度和蛋白释放率,并综合考虑操作的简便性等特点,方法1的蛋白制备效果较好,但是其蛋白浓度和蛋白释放率还需要优化,因此在此基础上考察了破碎次数、装液比、玻璃珠用量对蛋白制备效果的影响。
2.2 破碎次数对蛋白提取的影响
破碎次数与菌体破碎程度、蛋白释放率和终浓度密切相关。本文在装液比50%,玻璃珠0.6 g,破碎30 s,冰浴30 s的条件下,考察了破碎次数30、45、60、75、90次对酿酒酵母蛋白提取的影响。由图1(a)可知,破碎60次,酿酒酵母的蛋白释放率和蛋白浓度都达到了最大值,反而随着破碎次数的增加,蛋白释放率和蛋白浓度下降很快,原因可能是随着破碎次数的增加延长了操作时间,致使蛋白酶抑制剂失活,部分蛋白被降解。
2.3 玻璃珠用量对蛋白提取的影响
玻璃珠的用量也是影响蛋白提取的重要参数。本文在破碎次数60次,装液比为50%,菌体干重为50 mg条件下,考察玻璃珠用量对蛋白释放率和蛋白浓度的影响。由图1(b)可知,玻璃珠在0.3~1.0 g的变化范围内,蛋白释放率和浓度都是逐渐上升的,但是,玻璃珠质量大于1.0 g时,蛋白释放率和浓度都不再增加,得到了玻璃珠最佳用量为1.0 g。
2.4 装液比对蛋白提取的影响
装液比(即裂解液、玻璃珠和菌体的总体积与离心管容积的比例)会影响玻璃珠的转速以及剪切力的大小,从而影响破碎效果。因此本文在破碎60次,玻璃珠1.0 g条件下,考察了装液比20%、40%、50%对蛋白制备的影响。从图1(c)可知,蛋白释放率和蛋白浓度都随着装液比的降低而升高,考虑到实际可操作性,本实验没有继续降低装液比,选择20%为最适装液比。
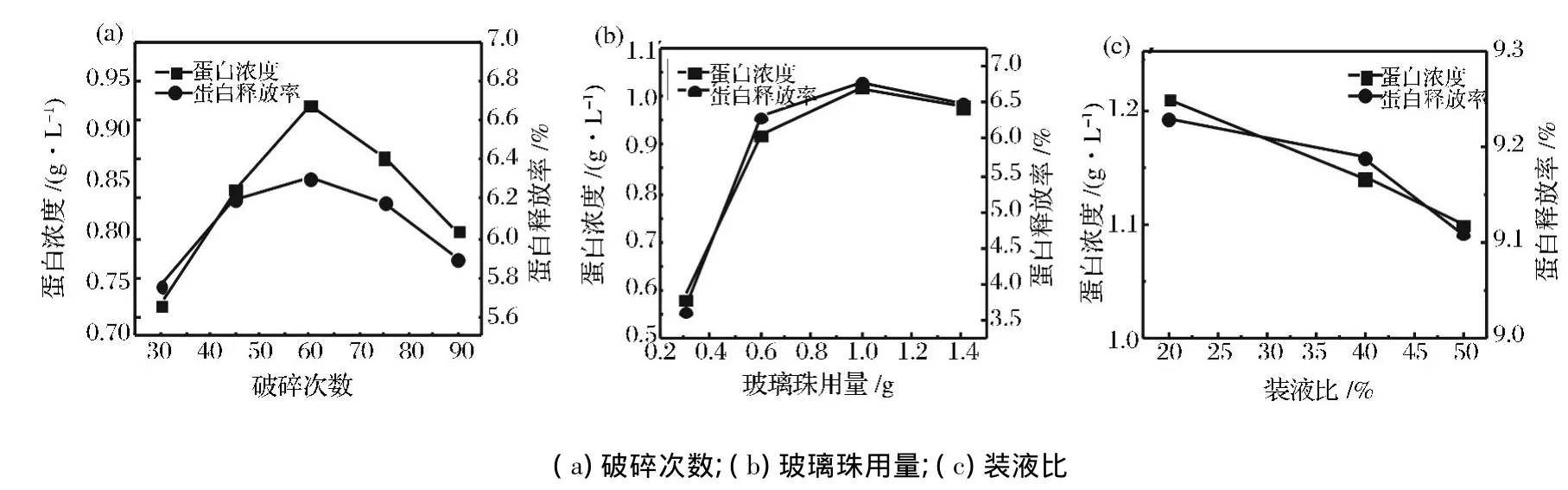
图1 不同变量对蛋白浓度和蛋白释放率的影响Fig.1 Effects of variables on the concentration and yield of protein
2.5 玻璃珠破碎条件的正交试验优化
在单因素实验的基础上,以破碎次数、玻璃珠用量、装液比为因素,采用L9(33)正交表分别以蛋白浓度、蛋白释放率和基于以上两个指标的归一化处理为指标进行优化设计,因素水平见表2,结果见表3。
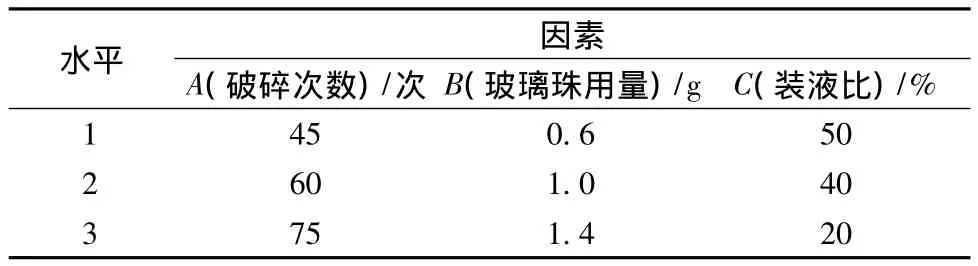
表2 因素水平设计Table 2 The factors and levels in design
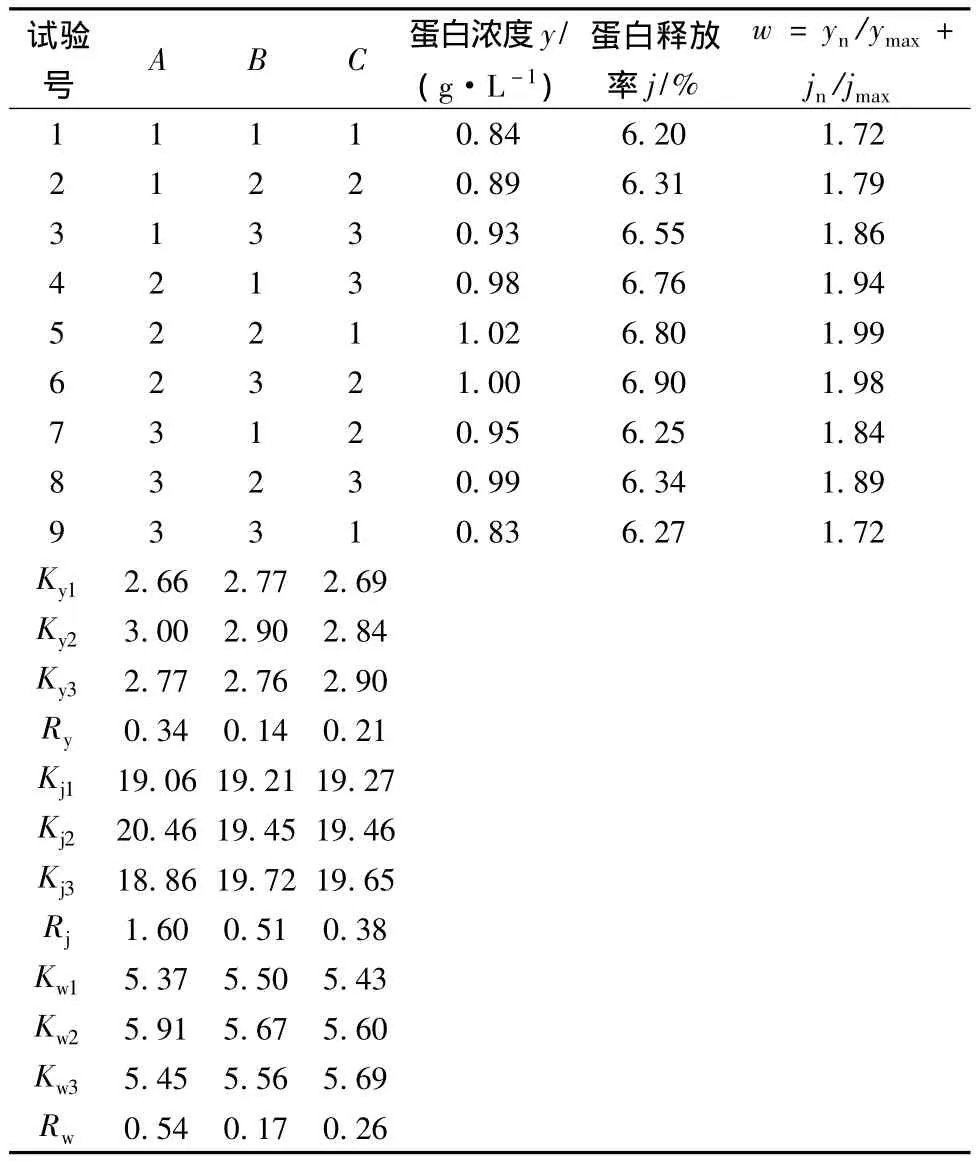
表3 正交试验设计与结果Table 3 The orthogonal experimental design and results
由表3可知,3个因素对蛋白浓度的影响从大到小依次是破碎次数、装液比、玻璃珠用量,最优组合是A2B2C3。影响蛋白释放率的因素大小依次为破碎次数、玻璃珠用量、装液比,最优组合是A2B3C3。采用了归一化处理,综合评价两个指标,对玻璃珠破碎效果影响因素从大到小依次为破碎次数、装液比、玻璃珠用量,最优条件是 A2B2C3,即破碎60次,玻璃珠1.0 g,装液比20%。采用此最优条件破碎50 mg干重的酵母菌体菌体,测定其蛋白浓度和蛋白释放率分别是1.21g/L和9.23%,均高于正交试验中的各组试验。
2.6 最优蛋白制备方法的验证
本文分别采用优化前后的制备方法获得蛋白样品,并通过蛋白质双向电泳进行了验证,结果如图2(1)、(2)所示。由图2可知,优化后的电泳图像蛋白点清晰,优化前后的电泳图像中蛋白点个数有明显的变化,从124个蛋白增加到181个蛋白;35 kDa以下的低丰度蛋白明显增加,由原来的26个蛋白点增加到53个,提高了1倍;(35~100)kDa大小的低丰度蛋白比优化前的分辨率高,有利于结果的分析和质谱鉴定。此外,采用优化后的方法,双向电泳结果平行性好,可重复,说明该制备方法可以很好的满足酿酒酵母蛋白质组学研究要求。

图2 电泳图像Fig.2 Electrophoresis images
3 结论
为了提高双向电泳样品蛋白质的溶解度,抽提最大量的总蛋白,减少蛋白质的损失,找到适合酿酒酵母双向电泳样品制备的方法,本文按照文献报道,比较了6种酿酒酵母全蛋白制备的方法,并选择方法1对其进行正交试验优化,得到的最佳条件为:50 mg干重的酿酒酵母菌体,1 mL裂解液,玻璃珠1 g,装液比20%,涡旋振荡30 s,冰浴30 s,重复以上操作60次,蛋白释放率达到了9.23%,蛋白浓度1.21 g/L,均比较理想,采用该方法提取的全蛋白,进行双向电泳验证,得到了蛋白点清晰、低丰度蛋白分辨率高的图像,并且双向电泳图像具备平行性,重复性好,说明该蛋白制备方法可以很好的用于蛋白质组学研究。
参考文献
[1] 胡威,朱力,商娜,等.细菌蛋白质组双向电泳中“串联珠”现象初探[J].军事医学,2011,35(001):48-53.
[2] Curto M,Valledor L,Navarrete C,et al.2-DE based proteomic analysis of Saccharomyces cerevisiae wild and K+transport-affected mutant(trk1,2)strains at the growth exponential and stationary phases[J].Journalof Proteomics,2010,73(12):2 316-2 335.
[3] Isola D,Marzban G,Selbmann L,et al.Sample preparation and 2-DE procedure for protein expression profiling of black microcolonial fungi[J].Fungal Biology,2011,115:971-977.
[4] 孔明惠,曹佐武,徐放.一种高效干冻研磨破碎酵母细胞的方法[J].安徽农业科学,2010,38(29):16 124-16 126.
[5] Sudar M,Valinger D,Findrik Z,et al.Effect of different variables on the efficiency of the baker's yeast cell disruption process to obtain alcohol dehydrogenase activity [J].Applied Biochemistry and Biotechnology,2013,169(3):1 039-1 055.
[6] Harder A,Wildgruber R,Nawrocki A,et al.Comparison of yeast cell protein solubilization procedures for two-dimensional electrophoresis[J].Electrophoresis,1999,20(4-5):826-829.
[7] Kolkman A,Olsthoorn M M,Heeremans C E,et al.Comparative proteomeanalysisofSaccharomycescerevisiae grown in chemostat cultures limited for glucose or ethanol[J].Mol Cell Proteomics,2005,4(1):1-11.
[8] 王曦,李彩梅,劳文燕,等.重组汉逊酵母细胞破碎技术研究[C].成都:中国生物制品年会暨第十一次全国生物制品学术研讨会:2011-09-21.
[9] 于影,余志晟,白志辉,等.东方伊萨酵母降解染料蛋白质组的双向电泳条件优化[J].环境科学,2011,32(2):548-553.
[10] Mayerhoff Z DVL,Franco T T,Roberto I C.A study of cell disruption of Candida mogii by glass bead mill for the recovery of xylose reductase[J].Separation and Purification Technology,2008,63(3):706-709.
[11] Lo″rincz A.Ultrasonic cellular disruption of yeast in water-based suspensions [J]. Biosystem Engineering,2004,89(3):297-308.
[12] Borthwick K A J,Coakley W T,McDonnell M B,et al.Development of a novel compact sonicator for cell disruption[J].Journal of Microbiological Methods,2005,60(2):207-216.
[13] Agrawal P B,Pandit A B.Isolation of α-glucosidase from Saccharomyces cerevisiae cell disruption and adsorption[J].Biochemical Engineering Journal,2003,15(1):37-45.
[14] Iida Y,Tuziuti T,Yasui K,et al.Protein release from yeast cells as an evaluation method of physical effects in ultrasonic field [J].Ultrasonics Sonochemistry,2008,15(6):995-1 000.
[15] Cortez E V,Almeida Felipe M G,Roberto N C,et al.Extraction by reversed micelles of the intrecellular enzyme xylose reductase[J].Applied Biochemistry and Biotechnology,2001,91(1-9):753-759.
