采后ASM处理对苹果果实抗坏血酸-谷胱甘肽循环系统的影响
2014-12-16李灿婴葛永红朱丹实靳韪华
李灿婴,葛永红,* ,朱丹实,靳韪华
(1.渤海大学化学化工与食品安全学院,辽宁锦州121013;2.甘肃农业大学食品科学与工程学院,甘肃兰州730070)
由扩展青霉(Penicillium expansum)侵染引起的青霉病是苹果贮藏期间的主要侵染性病害之一,在贮藏中后期腐烂发生率较高[1]。目前主要依靠人工合成的杀菌剂如甲基托布津、苯来特、多菌灵等来防止果实采后病害的发生。由于杀菌剂残留、环境污染及诱导病原物产生抗药性等问题,因此开发新型、安全的采后病害防治技术是当前生产中亟待解决的问题[2-3]。
苯丙噻重氮(acibenzolar-S-methyl,ASM)属水杨酸类似物,其本身对病原菌生长没有直接的抑制,而是通过激发果实体内的系统抗性来提高抗病性[4]。ASM不仅可以有效地减轻苹果、甜瓜、番茄等多种果蔬的田间病害,而且还可降低苹果、梨、芒果、葡萄、甜瓜等果蔬的采后病害[5-7]。ASM诱导果实抗病性的机理主要涉及活性氧代谢、活化苯丙烷代谢及产生病程相关蛋白等[4]。ASM处理使鸭梨果实具有较高的苯丙氨酸解氨酶(PAL)和几丁质酶(CHT)活性,积累了较高水平的H2O2和酚类物质[8]。“象牙”和“台农”2个品种芒果用ASM处理后产生速率、H2O2含量都明显高于对照[9],采后ASM处理还能诱导甜瓜果实活性氧的积累[10]。但有关ASM处理对苹果青霉病控制的报道很少,并且对于ASM处理后抗坏血酸-谷胱甘肽循环系统的变化研究不够深入。
本实验以苹果为试材,通过采后ASM浸泡处理对果实损伤接种P.expansum,测量常温贮藏期间果实的病斑直径,研究其对苹果青霉病的控制效果,并探讨其对抗坏血酸-谷胱甘肽循环系统中主要酶活性和抗氧化剂含量的影响。
1 材料与方法
1.1 材料与仪器
实验用富士苹果2012年9月采自景泰县条山农场,在八成熟时采收,纸箱包装后当天运回实验室进行处理。供试 ASM由 Novatis公司提供(有效浓度50%)。
P.expansum分离自自然腐烂的苹果果实,马铃薯葡萄糖琼脂(PDA)培养基25℃培养待用。
UV-2450型分光光度计 日本岛津;H-1850R型离心机 长沙湘仪离心机仪器有限公司;WYX-A微型旋涡混合器 上海跃进医疗器械厂。
1.2 实验方法
1.2.1 处理方法 苹果用2%次氯酸钠浸泡消毒后用自来水冲洗净果实表面并晾干后均分两份,每份90个果实,然后分别用自来水(内含 0.05%的Tween80)和 100mg·L-1的 ASM 溶液(内含 0.05% 的Tween80)浸泡10min后捞出晾干表面水分装箱待用。
1.2.2 孢子悬浮液的配制 参照 Bi等的方法[11]。取25℃下培养7d的带菌PDA平皿一个,加入含0.05%Tween80的无菌水约10mL,用玻璃棒刮下PDA平板上的P.expansum孢子,然后转入50mL三角瓶中,在WYX-A微型旋涡混合器上振荡15s,再用双层纱布过滤,滤液用血球计数板计数算出孢子悬浮液的浓度,稀释至1×105个·mL-1。
1.2.3 损伤接种 参照 Ge等的方法[7]。选取自来水和ASM处理后常温贮藏24h的果实,经75%酒精表面消毒后,用灭菌铁钉在果实表面等距离刺孔4个(深3mm,直径3mm)。取10μL孢子悬浮液分别接入孔内。晾干后入包装箱,室温贮藏观察发病率,用十字交叉法测定病斑直径。
1.2.4 取样 参照 Bi等的方法[11]。分别于处理后第2、4、6、8、10d 用直径 5mm 打孔器取果实皮下10~15mm处果肉组织3g,用锡箔纸包好,液氮速冻后,在-80℃超低温冰箱中保存待用。每次取样用10个果实。
1.2.5 H2O2含量测定 H2O2参照 Patterson等方法并修改[12]。H2O2反应体系包括 1mL 上清液,0.1mL 20%的四氯化钛(溶于浓盐酸,V/V),0.2mL浓氨水,在508nm处测定吸光值。以H2O2溶液制作标准曲线,H2O2含量以μmol H2O2·g-1FW表示。
1.2.6 过氧化氢酶(CAT)活性测定 参照Ren等方法[10]。以每分钟 OD 值变化0.01为1U,CAT的活性表示为U·g-1FW。
1.2.7 抗坏血酸过氧化物酶(APX)活性测定 参照Nakano和Asada方法并修改[13]。酶促反应体系由2mL 100mmol·L-1磷酸缓冲液(pH7.5,含 1mmol·L-1EDTA),0.8mL 3mmol·L-1抗坏血酸,200μL 粗酶液和0.5mL H2O2(0.5mmol·L-1)组成,最后加入 H2O2启动酶促反应。在290nm的吸光度值,连续测定2min。以每分钟 OD值变化 0.01为 1U,酶活性表示为U·g-1FW。
1.2.8 谷胱甘肽还原酶(GR)活性测定 参照Halliwell和 Foyer方法并修改[14]。酶促反应体系由3mL、100mmol·L-1的磷酸缓冲液,0.1mL、5mmol·L-1氧化型谷胱甘肽(GSSG),30μL、3mmol·L-1NADPH和0.2mL酶液组成(最后加入 NADPH启动酶促反应)。在340nm的吸光度值,连续测定2min。以每分钟OD值变化0.01为1U,以U·g-1FW表示。
1.2.9 单脱氢抗坏血酸还原酶(MDAR)、脱氢抗坏血酸还原酶(DHAR)活性测定 参照Nakano和Asada的方法并修改[13]。DHAR 反应体系包含 2mL、40mmol·L-1磷酸缓冲溶液(pH8.0),300μL、0.1mmol·L-1EDTANa2,400μL、2mmol·L-1还原型谷胱甘肽 (GSH),400μL、0.5mmol·L-1DHA 和 100μL 粗酶液,混匀后立即记录290nm处的OD值,以每分钟变化0.01为1U,以U·g-1FW表示DHAR的活性。
MDAR 反应体系包括 2mL、40mmol·L-1磷酸缓冲溶液(pH8.0),0.2mL、10mmol·L-1抗坏血酸钠,0.1mL、40μmol·L-1硫酸铜,0.5mL 粗酶液,最后加入0.2mL、0.2mmol·L-1NADPH 启动酶促反应,混匀后立即记录340nm处的OD值,以每分钟OD值变化0.01为1U,以U·g-1FW表示MDAR的活性。
1.2.10 抗坏血酸(AsA)和还原型谷胱甘肽(GSH)含量测定 AsA含量测定参照Tanaka等的方法并修改[15]。反应体系包括提取液 200μL,150mmol·L-1磷酸缓冲液(pH7.4)500μL,10%TCA 400μL,44%磷酸400μL,4%2,2-二联吡啶(溶于 70% 乙醇)400μL,3%FeCl3200μL。反应混合液 37℃温浴 60min,测525nm处吸光度。标准曲线用L-AsA标定。AsA含量以 μg AsA·g FW-1表示。
GSH含量的测定参照Ren等方法并修改[10]。反应体系由 1mL 上清液,1mL 0.1mol·L-1的磷酸缓冲液(pH7),0.5mL 4mmol·L-1DTNB 溶液(由 0.1mol·L-1,pH7的磷酸缓冲液配制)组成。将混合液于25℃下保温反应10min后,在412nm处测定吸光度值。用GSH制作标准曲线,GSH含量用μmol GSH·g FW-1表示。
1.3 数据分析
全部实验数据用Microsoft Excel 2007以及SPSS16.0软件进行数据统计分析。并计算标准偏差(±SE)或进行LSD分析。实验重复3次。
2 结果与分析
2.1 采后ASM处理对果实损伤接种P.expansum病斑直径的影响

图1 采后ASM处理对苹果损伤接种P.expansum病斑直径的影响Fig.1 Effect of postharvest ASM treatment on lesion diameter in apple fruit inoculated with P.expansum
ASM处理后24h接种 P.expansum,果实从接种后第3d开始明显发病,发病率达到100%,并且随着贮藏时间的延长病斑直径逐渐增大,但是ASM处理果实的病斑直径显著低于(p≤0.05)对照,如在贮藏第 5、6d 分别低于对照 8.8%和 7.1%(图 1)。
2.2 ASM处理对苹果果实H2O2含量的影响
在贮藏期间苹果果实中H2O2含量总体呈先升高后下降的趋势,采后ASM处理明显提高了果实H2O2含量,并且促进了H2O2含量高峰的提前出现,在第6d达到最大,是对照的1.34倍(图2)。
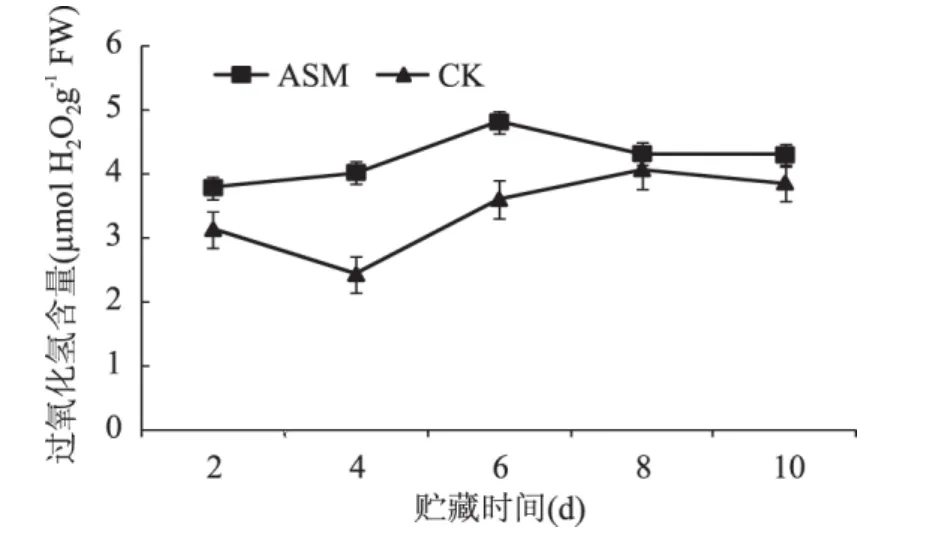
图2 采后ASM处理对果实H2O2含量的影响Fig.2 Effect of postharvest ASM treatment on the content of H2O2
2.3 ASM处理对苹果果实CAT活性的影响
对照苹果果实在贮藏期CAT活性呈先缓慢升高后下降趋势,ASM处理抑制了果实CAT活性的升高,在整个贮藏期均低于对照(图3),如贮藏第4d,处理果实CAT活性低于对照24.8%。
2.4 ASM处理对苹果果实APX活性和AsA含量的影响
在整个贮藏期间,APX活性呈先上升后下降趋势,并且ASM处理显著提高了果实APX活性,贮藏第6d出现高峰(图4A)。由图4B可知,采后ASM处理显著增加了果实中AsA含量,并且在贮藏第6d达到最大,而对照果实AsA含量没有明显的高峰出现。
2.5 ASM处理对苹果果实MDAR和DHAR活性的影响

图3 采后ASM处理对苹果果实CAT活性的影响Fig.3 Effect of postharvest ASM treatment on the activity of CAT
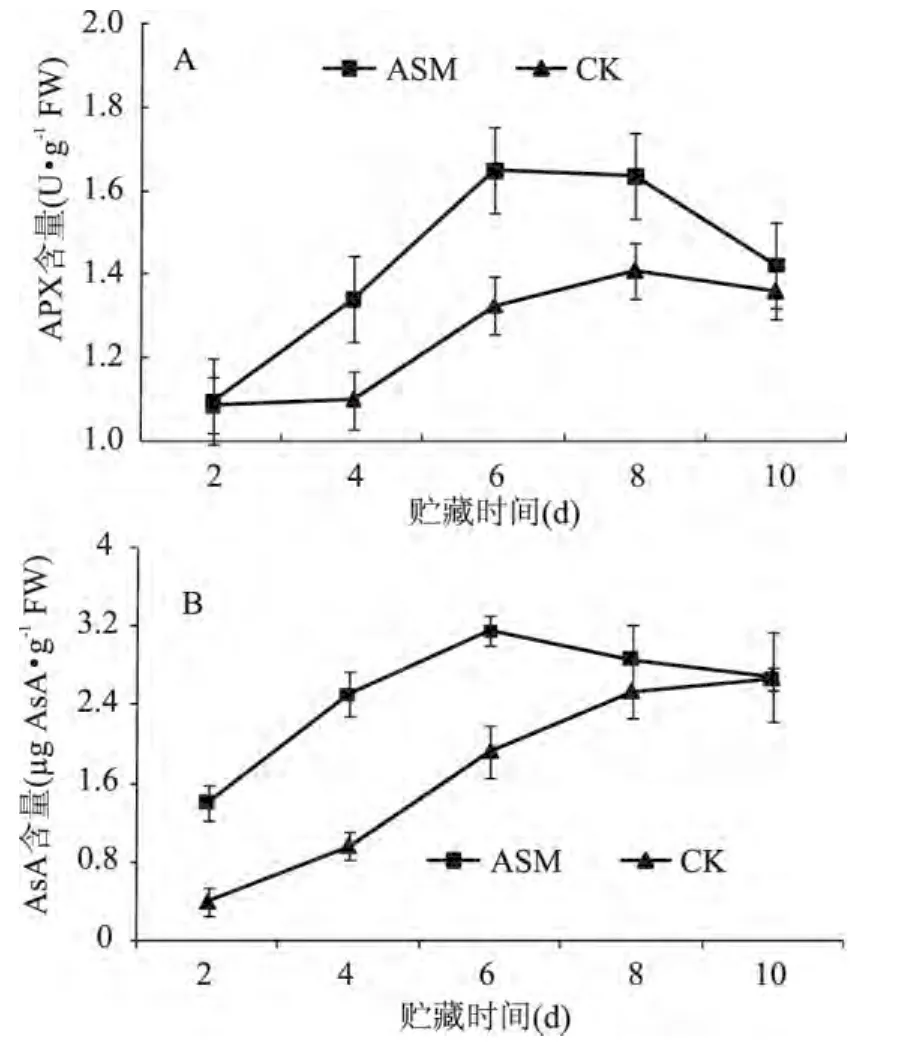
图4 采后ASM处理对果实APX(A)活性和AsA(B)含量的影响Fig.4 Effect of postharvest ASM treatment on APX(A)activity and AsA(B)content
随着贮藏时间的延长,对照和ASM处理苹果果实中MDAR活性呈先升高后下降趋势,ASM处理显著提高了MDAR活性,并且在第4d达到最大,高出对照23.1%(图 5A)。DHAR活性的变化趋势和MDAR基本一致,ASM处理显著提高了苹果果实中DHAR活性,在贮藏第6d达到最大,高出对照28.2%(图5B)。
2.6 ASM处理对苹果果实GR活性和GSH含量的影响
GR活性总体呈现先升高后降低的趋势,ASM处理明显提高了苹果果实GR活性,并且在贮藏第6d达到最大(图6A)。对照和ASM处理果实GSH含量均呈先上升然后缓慢下降的趋势,处理果实在贮藏第6d达到最大,GSH含量是对照的1.24倍(图6B)。
3 讨论
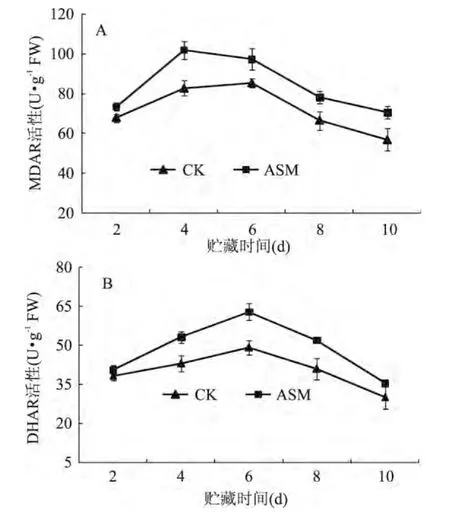
图5 采后ASM处理对果实MDAR(A)和DHAR(B)活性的影响Fig.5 Effect of postharvest ASM treatment on MDAR(A)and DHAR(B)activities
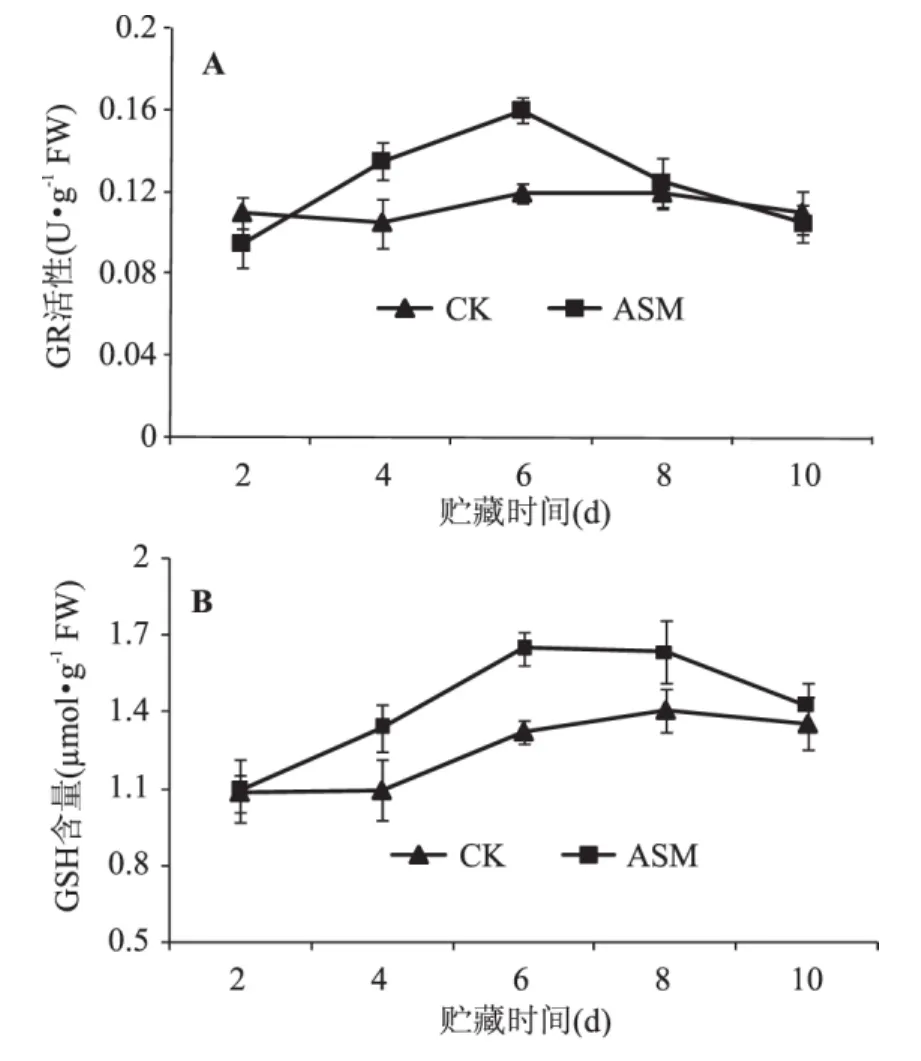
图6 采后ASM处理对果实GR(A)活性和GSH(B)含量的影响Fig.6 Effect of postharvest ASM treatment on the activity of GR(A)and GSH(B)content
本实验发现采后100mg·L-1ASM处理显著降低了苹果果实损伤接种P.expansum的病斑直径,这种抗病性的提高可能与ASM诱导的果实体内活性氧代谢有关。研究表明,ASM 处理诱导了梨[8]、桃[16]、甜瓜[10]、芒果[17]等果实的抗病性,并且促进了活性氧的积累。本实验发现采后ASM处理诱导了苹果果实体内H2O2含量的提高,并且抑制了CAT活性。在梨、甜瓜桃、芒果等果实体内也发现了类似的现象[10,16-18]。ASM 诱导的 H2O2的积累主要发生在处理后的早期,其积累与细胞膜的完整性密切相关,并且含量受果实体内抗氧化酶和抗氧化剂含量的影响[10,16-17,19]。CAT 可以专一地作用于 H2O2,将 H2O2分解为H2O和O[20]2,本实验发现,ASM处理抑制了果实CAT活性,从而促进了果实体内H2O2的积累。果实体内H2O2含量的提高有以下几方面的作用,可以直接杀死侵染的病原物,作为信号分子启动其他防卫反应,参与细胞壁结构的木质化及结构蛋白的交联等。
AsA-GSH循环是果实体内直接清除ROS的酶促催化系统,在此过程中,APX以AsA为基质将H2O2转变成H2O,同时产生两分子活泼的MDHA,MDHA在 MDHAR存在时可以还原为 AsA,同时MDHA又能够进一步氧化形成 DHA,而 DHA在DHAR存在的情况下能够以GSH为底物又还原成AsA,同时 GSH被氧化为 GSSG,GSSG又可以以NADPH为电子供体,通过GR的催化再重新还原成GSH,因而APX和GR是此循环中的两个关键酶,可以保持果实体内AsA和GSH的平衡,并在抗氧化系统中发挥着重要的作用[21-22]。本实验结果显示,ASM处理提高了果实APX和GR活性,从而提高了果实活性氧的清除能力。AsA和GSH是AsA-GSH循环中两个重要的抗氧化物质,本身具有直接清除ROS的作用[21-22]。本实验结果表明,ASM处理能够使果实的AsA和GSH含量保持在相对较高的水平,并且保持了较高的MDAR和DHAR活性,从而促进了AsA-GSH循环运转的效率,有效维持了AsA和GSH的循环系统,进而维持了较高抗氧化能力,使过量的ROS能够及时的被清除。
4 结论
采后100mg·L-1ASM处理显著降低损伤接种苹果果实P.expansum的病斑直径,抑制了果实体内CAT活性,从而提高果实H2O2含量。同时ASM处理通过提高AsA-GSH循环系统中抗氧化酶活性和抗氧化剂水平消除过量H2O2对果实伤害。
[1]邵兴锋,屠康,静玮,等.热处理对红富士苹果贮藏期间青霉病的抑制效果[J].园艺学报,2007,34(3):743-746.
[2]Tripathi P,Dubey N K.Exploitation of natural products as an alternative strategy to control postharvest fungal rotting of fruit and vegetables[J].Postharvest Biology and Technology,2004,32(3):235-245.
[3]Droby S,Wisniewski M,Macarisin D,et al.Twenty years of postharvest biocontrol research:it is time for a new paradigm?[J].Postharvest Biology and Technology,2009,52:137-145.
[4]葛永红,毕阳,李永才,等.苯丙噻重氮(ASM)对果蔬采后抗病性的诱导及机理[J].中国农业科学,2012,45(16):3357-3362.
[5]Gondim D M F,Terao D,Martins-Miranda A S,et al.Benzothiadiazole-7-carbothioic acid S-methyl ester does not protect melon fruits against Fusarium pallidoroseum infection but induces defense responses in melon seedlings[J] .Journal of Phytopathology,2008,156(10):607-614.
[6]Quaglia M,Ederli L,Pasqualini S,et al.Biological control agents and chemical inducers of resistance for postharvest control of Penicillium expansum Link.on apple fruit[J].Postharvest Biology and Technology,2011,59(3):307-315.
[7]Ge YH,Bi Y,Li X.Induces resistance against Fusarium and pink rots by acibenzolar-S-Methyl in harvested muskmelon(cv.Yindi)[J].Agricultural Sciences in China,2008,7(1):58-64.
[8]曹建康,姜微波.采后ASM诱导处理对鸭梨果实黑霉病的控制[J].园艺学报,2005,32(5):783-787.
[9]潘永贵,刘新华,黎寿英.采后BTH处理对芒果果实活性氧和抗氧化酶活性的影响[J].中国食品学报,2012,12(2):111-117.
[10]Ren Y L,Wang Y F,Bi Y,et al.Postharvest BTH treatment induced disease resistance and enhanced reactive oxygen species metabolism in muskmelon(Cucumis melo L.)fruit[J].European Food Research and Technology,2012,234:963-971.
[11]Bi Y,Tian S P,Zhao J,et al.Harpin induces local and systemic resistance against Trichotherium roseum in harvested hami melons[J].Postharvest Biology and Technology,2005,38:183-187.
[12]Patterson B D,MacRae E A,Ferguson I B.Estimation of hydrogen peroxide in plant extracts using titanium(IV)[J].Analytical Biochemistry,1984,139(2):487-492.
[13]Nakano Y,Asada K.Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts[J].Plant and Cell Physiology,1981,22(5):867-880.
[14]Halliwell B,Foyer C H.Properties and physiological function of a glutathione reductase purified from spinach leaves by affinity chromatography[J].Planta,1978,139(1):9-17.
[15]Tanaka K,Suda Y,Kondo N,et al.O3tolerance and the ascorbate-dependent H2O2decomposing system in chloroplasts[J].Plant and Cell Physiology,1985,26(7):1425-1431.
[16]Liu H X,Jiang W B,Bi Y,et al.Postharvest ASM treatment induces resistance of peach(Prunus persica L.cv.Jiubao)fruit to infection by Penicillium expansum and enhances activity of fruit defense mechanisms[J].Postharvest Biology and Technology,2005,35:263-269.
[17]Zhu X,Cao J,Wang Q,et al.Postharvest infiltration of ASM reduces infection of mango fruits(Mangifera indica L.cv.Tainong)by Colletotrichum gloeosporioides and enhances resistance inducing compounds[J].Journal of Phytopathology,2008,156:68-74.
[18]Cao J K,Jiang W B.Induction of resistance in Yali pear(Pyrus bretschneideri Rehd.)fruit against postharvest diseases by acibenzolar-S-methyl sprays on trees during fruit growth[J].Scientia Horticulturae,2006,110:181-186.
[19]Cao S F,Hu Z C,Zheng Y H,et al.Effect of BTH on antioxidant enzymes,radical-scavenging activity and decay in strawberry fruit[J].Food Chemistry,2011,125:145-149.
[20]马春花,张敏,李明军,等.外源AsA对苹果果实采后衰老及AsA-GSH循环的影响[J].云南农业大学学报:自然科学版,2012,27(3):384-390.
[21]Noctor G,Foyer C H.Ascorbate and glutathione:keeping active oxygen under control[J].Annual Review of Plant Physiology and Plant Molecular Biology,1998,49:249-79.
[22]Shigenaga T,Yamauchi N,Funamoto Y,et al.Effects of heat treatment on an ascorbate-glutathione cycle in stored broccoli(Brassica oleracea L.)florets[J].Postharvest Biology and Technology,2005.38:152-159.
