化学抗菌剂对哈茨木霉防治鱼腥草白绢病的协同作用
2014-12-03伍贤进牛友芽李胜华
伍贤进,牛友芽,周 ,魏 林,李胜华,魏 麟
(1.怀化学院 生命科学系/民族药用植物资源研究与利用湖南省重点实验室/湘西药用植物与民族植物学湖南省高校重点实验室,湖南 怀化 418008;2.湖南省植物保护研究所,湖南 长沙 410125)
鱼腥草(Houttuynia cordataThunb.)为三白草科蕺菜属多年生药食兼用草本植物[1].研究和临床实践表明,鱼腥草具有抗菌[1,2]、抗炎[1,3]、抗病毒[1,4]、抗氧化[5]等多种药理作用,能清热解毒、消肿排脓、利尿通淋,可用于治疗肺脓溃疡、肺热咳喘、热痢热淋、水肿、脚气、尿路感染、白带过多、痈肿疮毒等症[1].鱼腥草嫩茎叶和根状茎风味独特、营养丰富、养生保健作用良好,是颇具特色的食品,而且根状茎一年四季可采[1].因此,鱼腥草用量很大,湖南、贵州、四川等地均进行了大面积人工栽培[1,6].野生鱼腥草对病虫害的抵抗力较强,很少发生病虫危害,但人工栽培后白绢病的发病非常普遍,可导致成片死亡,严重影响产量和品质[1,6,7,8].但目前对鱼腥草白绢病的防治并无十分有效的办法[1,6,7,8,9],而且由于安全性的需要,鱼腥草病害防治用药要求十分严格[1,8,9].生物防治和选择低毒、低残留的化学药剂是鱼腥草白绢病防治的重要措施[1,8,9].木霉菌是自然界中普遍存在的一类真菌,大多数对植物病原真菌具有拮抗作用[10,11].哈茨木霉是木霉菌属中研究较多且已走向商品化的种群,其安全性和有效性已广为认可,在花生、辣椒白绢病防治中已取得较好效果[12,13],对鱼腥草白绢病的防治也有报道[6,14].三唑酮是一种高效、低毒、低残留的杀菌剂,已证明对鱼腥草白绢病病原菌有一定的抑菌效果[1,8].虽然三唑酮对包括哈茨木霉在内的真菌有一定抑制作用,但也有其能增强哈茨木霉防治辣椒白绢病的报道[13],但应用到鱼腥草中效果如何还有待研究.为了能充分发挥化学防治和生物防治的各自优势,寻找防治鱼腥草白绢病的安全有效方法,本研究探讨了三唑酮对哈茨木霉防治鱼腥草白绢病的协同作用.
1 材料与方法
1.1 鱼腥草与哈茨木霉
供试鱼腥草(Houttuynia cordataThunb.)品种为怀化学院选育的“湘白鱼腥草” (湖南省作物品种审定委员会,品种登记号:XPD017-2009),用根状茎为繁殖材料,按规范化栽培技术规程要求栽培于怀化市鹤城区杨村乡湖南正清制药集团鱼腥草规范化栽培基地[1].
哈茨木霉(Trichoderma huzirum)T2-16 由湖南省植物保护研究所提供.
1.2 培养基
PDA 培养基:马铃薯200 g、蔗糖或葡萄糖20 g、琼脂15~20 g、蒸馏水1 000 ml.
1.3 鱼腥草白绢病病原菌的分离
在栽培基地取患白绢病的鱼腥草植株,在超菌工作台中用剪刀将茎剪成约0.5 cm 长的小段,将小段缘纵切面剪开,放入75%的酒精中浸泡1-2 min 后,取出放入无菌水中清洗3次,用镊子夹入PDA 培养基中培养,每皿放入4 片,成正方形排列,于27 ±1℃恒温培养箱中恒温培养3 d,待培养皿中长出辐射状的菌丝,再用接种针挑取无污染的菌丝放入另一PDA 平板培养基中再培养3 d,即分离得到白绢病病原菌.
1.4 哈茨木霉协同化学抗菌剂的筛选
根据鱼腥草化学防治的情况[1,8,9],以下化学抗菌剂用于协同抗菌剂的候选.50% 多菌灵可湿性粉剂、25%甲霜灵可湿性粉剂 (上海脱联化工有限公司),15%三唑酮可湿性粉剂 (江苏七洲绿色化工有限公司),70%施普乐甲托超微复合可湿性粉剂 (简称“甲托”,天津施普农药技术发展有限公司),40%土净净粉剂(山西临汾有机化工厂).
分别将5种化学抗菌剂配制浓度为50 μg/ml的PDA 培养基,将白绢病病原菌和哈茨木霉T2-16 接种到培养基中培养观察菌丝的生长情况及菌核出现的情况,筛选出白绢病生长抑制性强但对哈茨木霉T2-16的生长的抑制性较弱的化学抗菌剂,每种抗菌剂均重复3次.
1.5 化学抗菌剂与哈茨木霉对鱼腥草白绢病病原菌协同抑制作用
在PDA 平板培养基上,一端接种已培养3 d的直径为5 mm的哈茨木霉菌块,对称一端接种相同条件下培养3 d的直径亦为5 mm的鱼腥草白绢病病原菌块,在25℃下恒温培养,观察哈茨木霉对白绢病病原菌生长的影响情况.另用含有浓度为50 μg/ml 筛选出的化学抗菌剂的PDA 平板培养基上重复同样操作.两种培养基下均以不接种哈茨木霉为对照,所有处理均在25℃下恒温培养,观察菌苔的生长情况以及菌核的出现情况,每个处理均重复5次.
1.6 鱼腥草白绢病的协同防治
1.6.1 哈茨木霉孢子粉制剂的制备
将稻草秸秆粉碎成粉末,按照1∶0.6 比例加入浓度为5%的(NH4)2SO4溶液,搅拌均匀,用罐头瓶分装,高压蒸汽灭菌并冷却至室温后接种哈茨木霉,27±1℃恒温箱中培养培养7 d,即得到深绿色木霉孢子粉制剂,培养期间每天将罐头瓶摇匀.
1.6.2 白绢病菌核制备
将白绢病病原菌丝在PDA 平板培养基中培养7 d至菌丝上布满深褐色颗粒状菌核.
1.6.3 鱼腥草白绢病的防治
将生长良好的盆栽鱼腥草接种白绢病菌核培养3 d后分成A、B、C、D 四组,每组四盆,进行如下处理:A组每盆喷洒浓度为250 μg/ml的三唑酮溶液;B组每盆按30 g/m2播撒哈茨木霉孢子粉;C组每盆同时喷洒250 μg/ml的三唑酮溶液和播撒30 g/m2哈茨木霉孢子粉;D组盆为对照,不做任何处理.观察防治效果.
防治效果= (对照发病率-处理发病率)/对照发病率×100%
2 结果与分析
2.1 哈茨木霉和鱼腥草白绢病病原菌在PDA 培养基的生长情况
图1说明,哈茨木霉和鱼腥草白绢病病原菌均能在PDA 培养基上迅速生长,培养5 d 就几乎能将直径为9 cm的培养皿长满.
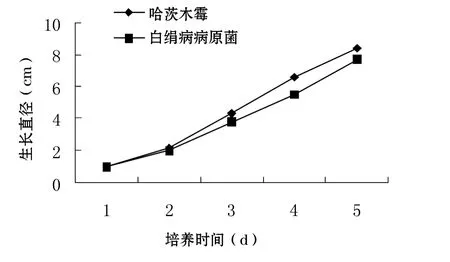
图1 哈茨木霉和鱼腥草白绢病病原菌在PDA 培养基中的生长情况
2.2 化学抗菌剂对鱼腥草白绢病病原菌和哈茨木霉生长的影响
表1显示不同化学抗菌剂对鱼腥草白绢病病原菌生长的影响差异较大,土净净的抑制作用最强,其次为三唑酮和甲托,而甲霜灵和多菌灵的抑制作用则不很明显.而对于哈茨木霉,5种化学抗菌剂均能抑制其生长,作用大小依次为土净净>甲托>甲霜灵>多菌灵>三唑酮(表2).鉴于三唑酮对哈茨木霉生长的抑制作用较小,而且对鱼腥草中白绢病病原菌生长的抑制作用较强,故可作为和哈茨木霉协同防治鱼腥草白绢病的化学抗菌剂.
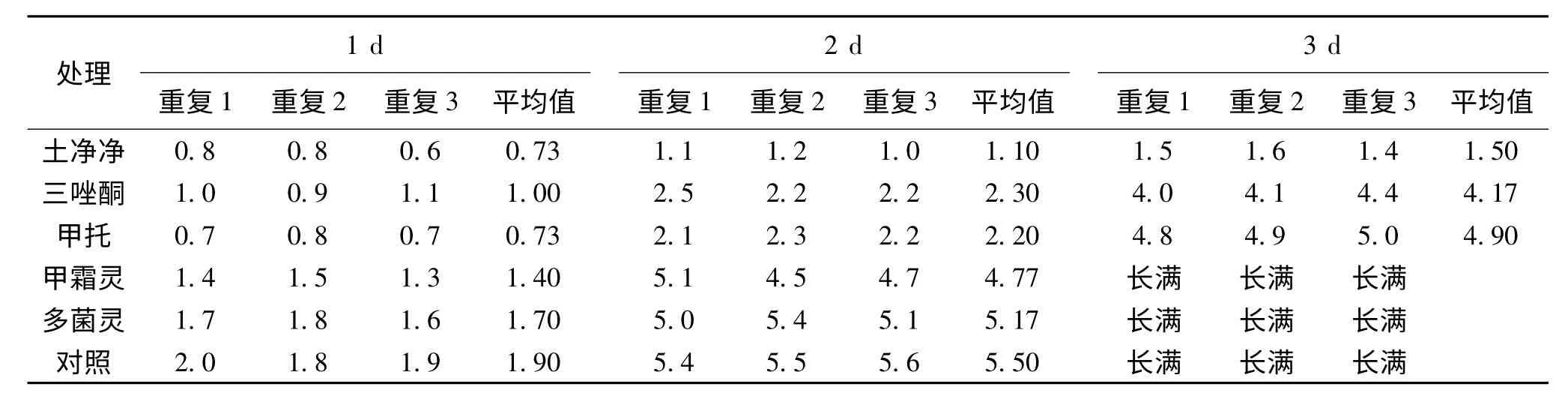
表1 不同化学抗菌剂对鱼腥草白绢病病原菌生长直径的影响(单位:cm)
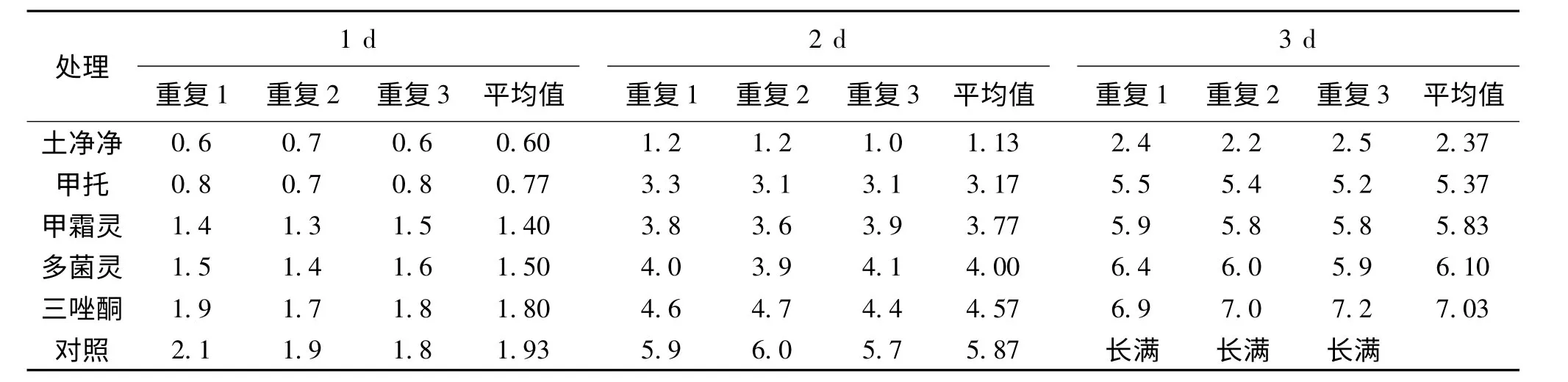
表2 不同化学抗菌剂对中哈茨木霉生长直径的影响(单位:cm)
2.3 三唑酮协同哈茨木霉对鱼腥草白绢病病原菌生长的影响
表3说明,哈茨木霉对鱼腥草白绢病菌生长有很强的拮抗作用,无哈茨木霉时培养4-5 d 病菌即长满培养皿并形成菌核,7 d 后菌核密布,而接种了哈茨木霉的培养皿在生长第2 d 两种菌的菌落就开始接触,之后白绢病病原菌菌落逐渐变小,到第5 d 病菌菌落仅为对照的1/2,且菌丝细弱、色淡、不产生菌核,到第7 d 时,病原菌菌丝几乎全部死亡.
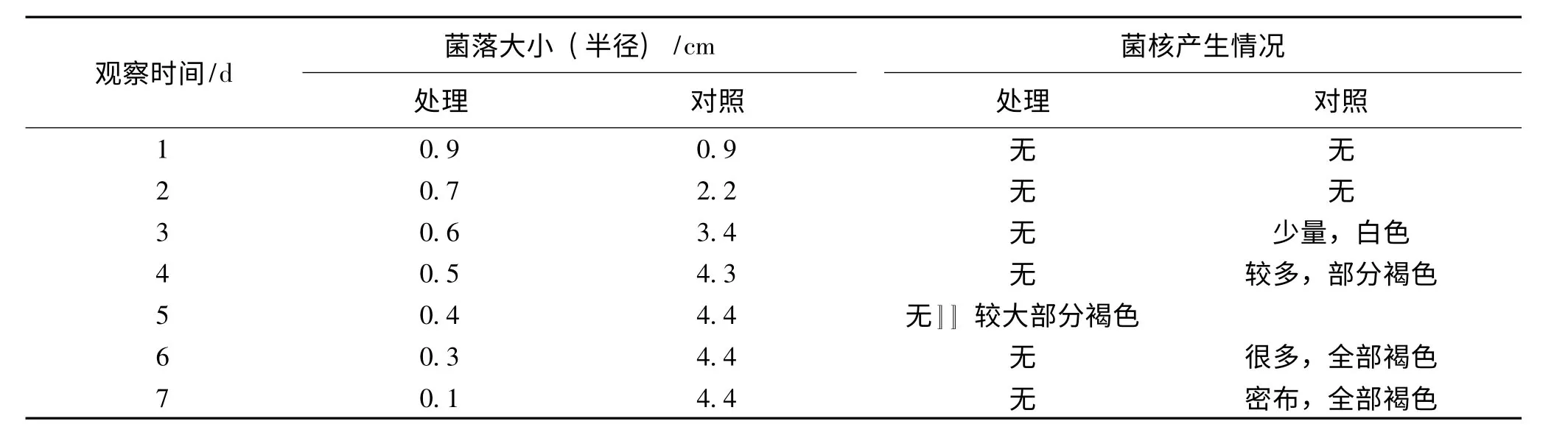
表3 哈茨木霉对鱼腥草白绢病病原菌生长的抑制作用
用50 μg/ml 三唑酮配制的PDA 培养基的培养结果见表4,比较表3和表4结果明显发现,加入三唑酮后鱼腥草白绢病病原菌生长所受抑制作用更明显,病菌衰退时间变短,菌核出现的时间也进一步推迟,说明哈茨木霉与三唑酮对鱼腥草白绢病病原菌的生长抑制作用具有明显的正协同作用.
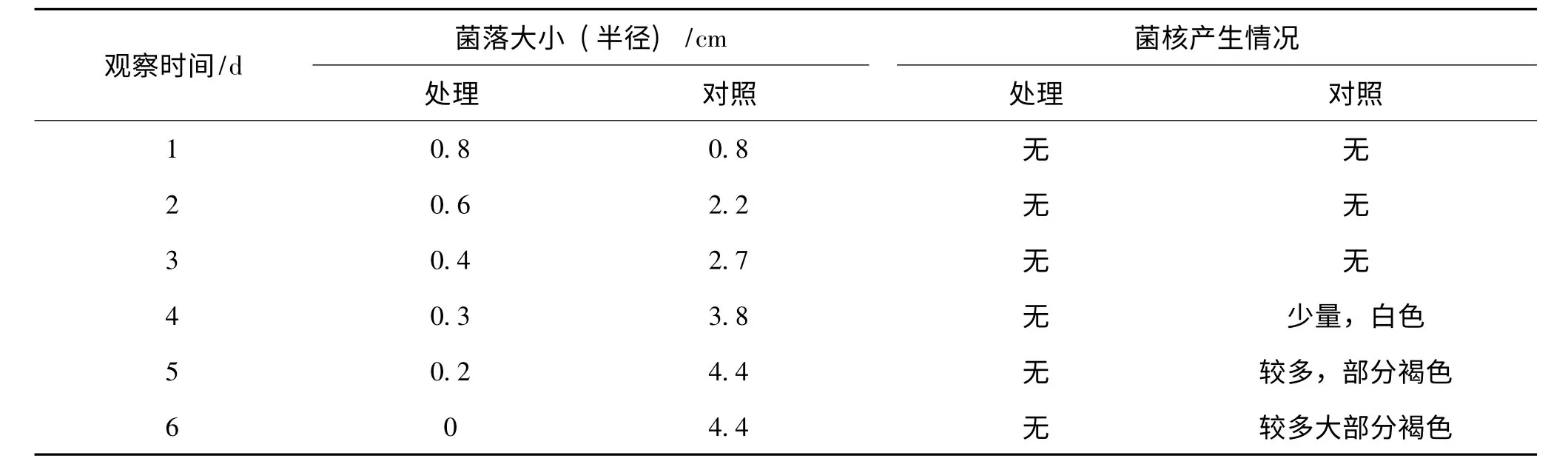
表4 哈茨木霉及三唑酮对鱼腥草白绢病病原菌生长的协同抑制作用
2.4 三唑酮与哈茨木霉对鱼腥草白绢病的协同防治作用
表5显示,未经三唑酮或哈茨木霉防治的对照鱼腥草均发生了白绢病,说明接种十分成功,三唑酮、哈茨木霉对鱼腥草弊绢病均有明显的防治作用,可降低发病率,延迟发病时间.从防治率和延迟发病时间两方面看,三种处理的防治效果依次均为:三唑酮+哈茨木霉>三唑酮>哈茨木霉,说明三唑酮与哈茨木霉在鱼腥草白绢病防治上具有良好的正协同作用.

表5 哈茨木霉与三唑酮对鱼腥草白绢病的协同防治作用
3 讨论
白绢病是鱼腥草主要病害,且整个生育期都能危害,严重时能造成大面积减产.虽然化学药剂对鱼腥草白绢病具有较好的防治效果,但存在着持效期短,环境污染等问题[1,8,9].而且,因为药用和食用的特殊要求,安全性是鱼腥草化学防治需要考虑的首要问题,人工栽培鱼腥草白绢病的防治是一个较大的难题.本试验结果表明,土净净、甲托、三唑酮等化学抗菌剂对鱼腥草白绢病病原菌生长有较强的抑制作用,哈茨木霉对鱼腥草白绢病病原菌生长和鱼腥草白绢病的发生也有较强的抑制作用,这与前人的研究结果一致[1,6,9].已有研究发现,三唑酮对木霉防治辣椒白绢病有较好的协同作用[13].本研究表明,三唑酮对鱼腥草白绢病病原菌的生长有较强的抑制作用,但对哈茨木霉菌生长的抑制作用则较小,而且三唑酮与哈茨木霉在防治鱼腥草白绢病方面具有明显的正协同作用,这一研究结果为鱼腥草生产中提供了一个相对高效、安全的白绢病防治方案.
化学抗菌剂与哈茨木霉协同防治鱼腥草白绢病可同时发挥化学抗菌剂起效快、生物防治持续时间久的两种优势,而且哈茨木霉还有促进鱼腥草生长发育的作用[14].因此,根据本研究和前人研究结果,在鱼腥草人工栽培中多使用哈茨木霉对于提高生产效益是十分有利的.但鉴于白绢病的发病特点,在鱼腥草生产中,还必须贯彻“预防为主、综合防治”的策略,充分发挥物理防治、生物防治、化学防治的各自优势,做到取长补短、优势互补,才能使白绢病控制达到理想状态,且符合中药材和食品的生产要求.
[1]伍贤进.鱼腥草种质资源与规范化栽培技术研究[M].北京:科学出版社,2011.
[2]Kim G S,Kim D H,Lim J J,et al.Biological and antibacterial activities of the natural herb Houttuynia cordata water extract against the intracellular bacterial pathogen salmonella within the RAW 264.7 macrophage[J].Biol Pharm Bull,2008 (11):2012-2017.
[3]Kim D,Park D,Kyung J,et al.Anti-inflammatory effects of Houttuynia cordata supercritical extract in carrageenan-air pouch inflammation model[J].Lab Anim Res,2012 (2):137-140.
[4]Chen X Q,Wang Z X,Yang Z Y,et al.Houttuynia cordata blocks HSV infection through inhibition of NF-κB activation[J].Antiviral Res,2011 (2):341-345.
[5]Toda S.Antioxidative effects of polyphenols in leaves of Houttuynia cordata on protein fragmentation by copper-hydrogen peroxide in vitro[J].J Med Food,2005 (2):266-268.
[6]唐莉,吴锡明,马曲,等.鱼腥草白绢病发生发展规律及防治方法研究[J].中草药,2005,12 (36):1872-1874.
[7]李涛,张圣喜,张立,等.土壤肥力与鱼腥草白绢病发生的关系[J].湖南农业大学学报,2009,35 (3):317-319.
[8]李涛,张圣喜,伍贤进,等.鱼腥草白绢病综合防治配套技术措施[J].中国农村小康科技,2010 (4):40-42.
[9]陈连发,秦利红,蒋雪荣.鱼腥草白绢病防治试验简报[J].南方园艺,2014,25 (5):24-25.
[10]丁万隆,程惠珍,张国珍.木霉在药用植物病害防治上的应用[J].中草药,1997,28 (8):505-507.
[11]丁万隆,程惠珍,张国珍,等.木霉防治西洋参立枯病研究[J].中草药,1994,25 (2):91-92.
[12]李良.哈茨木霉防治花生、辣椒白绢病[J].植物保护,1987,13 (3):19-20.
[13]燕嗣皇,陆德清,杨雨环.三唑酮对木霉防治辣椒白绢病的协同作用[J].西南农业学报,1998,11(4):101-105.
[14]魏林,梁志怀,陈玉荣,等.Trichoderma harzianumTUV-13 对鱼腥草白绢病的防治及其促生长作用[J].中国生物防治学报,2012,28 (3):381-386.
