青蒿素对糖尿病大鼠肾脏保护作用机制研究
2014-11-30张丽坤周凤娇苏彦君张建勇安志霞
张丽坤,周凤娇,苏彦君,张建勇,安志霞
(河北省石家庄市第二医院,河北石家庄050051)
大量研究表明,糖尿病发病率在全球迅速上升,使糖尿病肾病发病率逐年增加,目前在发达国家,糖尿病肾病已成为引起终末期肾衰竭(ESRD)的首要原因。在糖尿病肾病的发病及病情进展中,肾组织内的肾素-血管紧张素系统(RAS)起重要作用,血糖高时可激活肾组织内的RAS,引起肾组织内血管紧张素Ⅱ(AngⅡ)水平上升,AngⅡ通过与其受体AT1R发生结合,导致肾组织表达金属蛋白酶-2组织抑制物(TIMP-2)与基质金属蛋白酶-2(MMP-2)的比例失调,刺激细胞外基质降解减少,细胞外基质堆积[1-3]。本实验通过对糖尿病大鼠肾小球内TIMP-2和MMP-2的表达以及青蒿素对其表达作用的观察,来探讨青蒿素对肾脏的保护机制,从而为临床提供理论依据。
1 实验资料
1.1 糖尿病模型大鼠 36只雄性SD大鼠,体质量180~220 g,实验所用大鼠随机分为正常对照组(A组)、糖尿病非治疗组(B组)及糖尿病青蒿素治疗组(C组),每组12只大鼠。B组和C组利用大鼠腹腔单剂量注射STZ(购自Sigma公司)65 mg/kg制备糖尿病大鼠模型,A组只腹腔注射等量柠檬酸缓冲液,72 h后采尾静脉血,使用达优血糖仪(广州达优医疗设备有限公司生产)测血糖,血糖≥16.7 mmol/L确定为糖尿病大鼠。
1.2 动物给药 自模型成功当天起,C组大鼠腹腔注射青蒿素(购自成都伟辉生物科技有限公司)300 g/(kg·d)溶于二甲基亚砜(DMSO)中,A组与B组分别给予腹腔注射等剂量DMSO。所有实验大鼠不使用胰岛素及其他降糖药物,可以自由进食、饮水。实验第3周和第6周时,各组大鼠分别取6只宰杀。
1.3 标本收集 宰杀大鼠前1 d收集24 h尿液,混合均匀后予以计量,然后取样6 mL,-20℃冰箱保存,备测尿肌酐和24 h尿蛋白排泄率(UAER)。称大鼠体质量,然后取血5 mL,测定尿素氮、血糖及血肌酐。留取大鼠双侧肾脏,予以称质量,取部分右肾组织放于10%甲醛溶液浸泡、固定,以备PAS、HE及免疫组化染色检查。
1.4 生化指标检测 用放免法检测实验大鼠尿白蛋白含量。用日产奥林巴斯AU400自动生化分析仪检测所有生化指标,计算肌酐清除率(Ccr),其结果需用大鼠体质量予以校正。
1.5 免疫组化染色 应用SP方法。石蜡切片厚度4μm。阴性对照组用1%BSA代替一抗,检测Ⅳ型胶原、纤维连接蛋白(FN)、TIMP-2和MMP-2的表达情况。
2 结 果
2.1 各组大鼠血糖、肾质量、体质量及肾质量/体质量比较B组大鼠的体质量均明显低于A组,并且呈进行性下降趋势,肾质量/体质量、肾质量都逐步上升。C组大鼠体质量都高于B组,肾质量/体质量、肾质量都低于B组。见表1。
表1 各组大鼠体质量、肾质量、肾质量/体质量及血糖比较(±s)

表1 各组大鼠体质量、肾质量、肾质量/体质量及血糖比较(±s)
注:①与A组比较,P<0.05;②与 A组比较,P<0.01;③与 B组比较,P <0.05。
组别 n 时间 体质量/g 肾质量/g 肾质量/体质量/103血糖/(mmol/L)A组 6 3周6周259.10±6.49 359.00±5.01 0.76±0.04 0.71±0.08 2.38±0.03 2.71±0.04 7.99±0.82 8.20±0.86 B组 6 3周6周204.98±4.78①179.74±15.02②0.90±0.02①1.30±0.21①6.17±0.04①9.32±0.07②22.79±2.21①23.52±2.32①C组 6 3周6周239.21±5.72①218.58±6.65①③0.81±0.04③0.77±0.02③3.31±0.08③6.01±0.06①③22.53±1.98①24.12±1.80①
2.2 各组大鼠UAER以及肾功能比较 B组大鼠血UAER、Ccr及尿素氮比A组高。C组大鼠上述数值都明显低于同期B组。见表2。
2.3 各组大鼠肾小球表达FN、TIMP-2、Ⅳ型胶原蛋白及MMP-2情况比较 相同时间比较发现,在对照组可见MMP-2蛋白主要在肾小球基底膜及系膜表达,在第3周和第6周时,其表达未见明显变化;B组大鼠MMP-2蛋白在肾小球的表达显著降低;C组大鼠MMP-2蛋白的表达与B组比较呈显著上调趋势。正常情况下,肾小球基底膜和系膜表达Ⅳ型胶原蛋白、TIMP-2和FN量较少,第6周与第3周比较,未见显著改变;B组大鼠上述指标与同期A组相比均逐渐增加;C组大鼠与B组大鼠比较,上述指标都显著下调。见表3。
表2 各组大鼠生化指标及UAER比较(±s)

表2 各组大鼠生化指标及UAER比较(±s)
注:①与A组比较,P<0.01;②与 A组比较,P<0.01;③与 B组比较,P <0.05。
组别 n 时间 尿素氮/(mmol/L)血肌酐/(μmol/L)Ccr/(mL/(min·kg))UAER/(μg/24h)A组 6 3周6周6.79±0.29 6.98±0.32 46.95±0.07 50.04±0.09 4.31±0.42 3.79±0.50 3.32±0.41 3.19±0.39 B组 6 3周6周11.63±0.45①14.43±0.30①49.76±2.12 62.19±1.98②4.83±0.09②6.31±0.07②6.12±0.68②34.01±0.50①C组 6 3周6周7.31±0.43②③8.81±0.82②③48.99±1.25 52.51±1.42③4.01±0.04③4.56±0.08②③4.09±0.81②③20.36±0.63②③
表3 各组大鼠肾小球表达MMP-2、TIMP-2、FN及Ⅳ型胶原蛋白情况(±s)
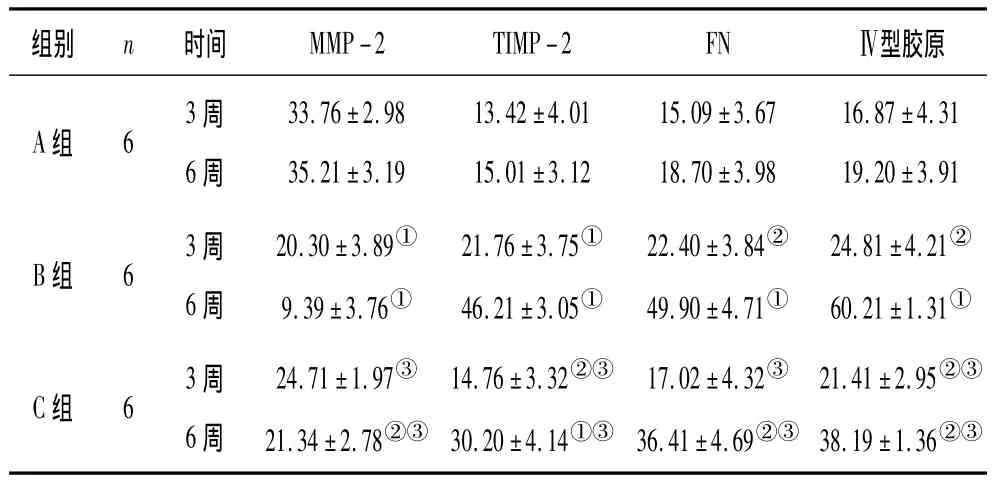
表3 各组大鼠肾小球表达MMP-2、TIMP-2、FN及Ⅳ型胶原蛋白情况(±s)
注:①与A组比较,P<0.01;②与 A组比较,P<0.05;③与 B组比较,P <0.05。
组别 n 时间 MMP-2 TIMP-2 FN Ⅳ型胶原A组 6 3周6周33.76±2.98 35.21±3.19 13.42±4.01 15.01±3.12 15.09±3.67 18.70±3.98 16.87±4.31 19.20±3.91 B组 6 3周6周20.30±3.89①9.39±3.76①21.76±3.75①46.21±3.05①22.40±3.84②49.90±4.71①24.81±4.21②60.21±1.31①C组 6 3周6周24.71±1.97③21.34±2.78②③14.76±3.32②③30.20±4.14①③17.02±4.32③36.41±4.69②③21.41±2.95②③38.19±1.36②③
2.4 实验大鼠肾脏病理变化 光镜学表明:A组大鼠肾小球毛细血管襻薄,小管未见明显病理变化;B组大鼠肾小球基底膜增厚,面积增大,并且系膜区增宽,病变呈进展性,肾小管病变表现不显著,并且没发现肾小球硬化;C组大鼠肾小球病理变化较糖尿病非治疗组显著减轻,但比A组重。
3 讨 论
糖尿病是世界上多数国家慢性肾衰竭的主要原因,其发病机制与多种因素有关,如代谢紊乱、血流动力学异常、氧化应激、遗传等。近年来通过各种干预措施减少细胞外基质堆积,成为糖尿病肾病研究领域的热点之一[4-6]。
MMPs/TIMPs与糖尿病肾病的关系密切,该系统的失衡是导致细胞外基质积聚、糖尿病肾病发生发展的重要机制。糖尿病时高血糖的终末效应是使MMPs表达下调,活性降低,TIMPs表达上调,减少细胞外基质降解,从而导致细胞外基质积聚。细胞基质积聚引起的进行性肾小球硬化与间质纤维化是糖尿病肾病发展至终末期肾衰竭的主要病理表现[2-4]。
MMPs是一种锌依赖的蛋白酶,活化的MMPs可被其所对应的TIMPs按照1∶1的比例所抑制。MMP-2作为MMPs中的重要成分,主要降解Ⅳ型胶原、FN及层黏连蛋白。
本研究发现糖尿病大鼠肾小球MMP-2表达减少,TIMP-2表达上调,细胞外基质大量堆积。而青蒿素治疗组大鼠肾小球表达MMP-2明显增加,其显著抑制TIMP-2表达,显著下调FN及Ⅳ型胶原蛋白表达,明显减轻肾小球细胞外基质堆积,改善肾功能,降低尿白蛋白排泄,改善肾皮质损伤。由于糖尿病组与治疗组大鼠血糖比较无显著性差异,提示青蒿素的肾脏保护作用与代谢因素无关。
[1]杨敬华,周巧玲,王衍慧,等.高糖对人类肾小球系膜细胞PKC及MMPs/TIMPs的影响[J].中南大学学报:医学版,2009,34(5):425-431
[2]Hohenadel D,van der Woude FJ.Gene expression in diabetic nephropathy[J].Curr Diab Rep,2004,4(6):462 -469
[3]Ji L,Yin XX,Wu ZM,et al.Ginkgo biloba extract prevents glucoseinduced accumulation of ECM in rat mesangial cells[J].Phytother Res,2009,23(4):477 -485
[4]Urushihara M,Kagami S,Kuhara T,et al.Glomerular distribution and gelatinolytic activity of matrix metalloproteinases in human glomerulonephritis[J].Nephrol Dial transplant,2002,17(7):1189 -1196
[5]Thrailkill KM,Bunn RC,Fowlkes JL.Matrix metalloproteinases:their potential role in the pathogenesis of diabetic nephropathy[J].Endocrine,2009,35(1):1 -10
[6]Wei S,Xie Z,Filenova E,et al.Drosophila TIMPis a potent inhibitor of MMPs and TACE:similarities in structure and function to TIMP -3[J].Biochemistry,2003,42(42):12200 -12207
