伪狂犬病毒单克隆抗体的制备和鉴定
2014-11-29廖园园秦红刚漆世华谢红玲
李 建,曹 娟,廖园园,刘 洁,朱 微,秦 伟,秦红刚,漆世华,谢红玲
(武汉中博生物股份有限公司,武汉430070)
伪狂犬病(Pseudorabies,PR)是由伪狂犬病毒引起的猪、牛、羊等多种家畜、家禽及野生动物的一种重要的急性传染病,又称“Aujeszky 氏病”[1-2]。随着养猪业的规模化和集约化发展,该病给我国养猪业带来了巨大的经济损失,因此,建立快速有效的诊断检测方法对于控制和消灭PRV具有重要的意义。单克隆抗体技术是20世纪70年代生物学领域的重要成果之一。单克隆抗体具有纯度高、重复性好、且能持续的无限量供应等优点,对疾病的诊断治疗以及疫苗的研究作出了巨大贡献。目前,在兽医临床工作中,PRV的诊断方法多采用病毒分离、PCR技术和ELISA法。但是,这些方法不够完善和深入,高准确度、高灵敏度与快速、简便并存的检测方法目前还不成熟。为了更快速、更准确的诊断疾病,以便对该病采取有效的防治措施,本试验利用PRV全病毒免疫小鼠后建立分泌抗PRV单克隆抗体的杂交瘤细胞株,为建立特异性强、敏感性高、简便、快速的抗原捕获ELISA诊断方法提供了条件。
1 材料与方法
1.1 毒株、细胞、实验动物和其他试剂 骨髓瘤细胞、PRV、猪睾丸细胞(ST)、猪细小病毒(PPV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪圆环病毒2型(PCV2)均为武汉中博生物股份有限公司保存;8周左右的雌性BALB/c购自武汉生物制品研究所。DMEM培养基(Hyclone公司)、次黄嘌呤氨基蝶呤胸腺嘧啶(HAT,Sigma公司)、次黄嘌呤胸腺嘧啶(HT,Sigma公司)、辣根过氧化物酶(HRP)标记羊抗小鼠 IgG(Thermo公司)、异硫氰酸荧光素(FITC)标记抗鼠IgG(Thermo公司)、单抗亚类鉴定试剂盒(洛阳赛尔维公司)、生物素标记羊抗小鼠IgG和HRP标记的链霉素(武汉博士德生物工程有限公司)。
1.2 病毒增殖与纯化 在ST细胞传代后接种PRV,置37℃ 5%CO2培养箱中进行培养,待75%以上细胞出现病变(CPE)后收毒,收获后的病毒经超滤浓缩,差速离心,蔗糖密度梯度离心[3],电镜检测。
1.3 免疫 用纯化的PRV与等量的弗氏完全佐剂充分乳化后,采用皮下多点免疫雌性BALB/c小鼠,分别间隔三周用减半剂量加弗氏不完全佐剂进行二免和三免,融合前3 d腹腔加强注射。
1.4 间接ELISA筛选方法的建立 采用间接ELISA方法,按方阵法[4]确定包被PRV纯化抗原浓度、HRP标记抗体的最适工作浓度。以3,3’,5,5’-四甲基联苯胺(TMB)为底物,测定OD450nm值。以阳性血清OD值在1.0左右,同时与阴性血清OD值差距最大的抗原包被浓度、抗体稀释度为最佳工作浓度。
1.5 杂交瘤细胞株的建立 按常规方法[5]将免疫的小鼠脾脏细胞与骨髓瘤细胞在50%聚乙二醇进行融合,然后置HAT选择性培养基,将其加入到铺有饲养细胞的96孔板中进行培养,间接ELISA和间接免疫荧光方法进行筛选,有限稀释法连续稀释三次,阳性孔单克隆杂交瘤细胞连续传代3个月。
1.6 腹水的生产及其纯化 选12周龄左右的雌性BALB/c,腹腔注射杂交瘤细胞进行腹水的生产,采用辛酸-硫酸铵法纯化腹水。
1.7 单克隆抗体的鉴定
1.7.1 单克隆抗体的效价 采用已经建立的间接ELISA法测定细胞上清和腹水中单克隆抗体的效价。
1.7.2 单克隆抗体的亚类 用间接ELISA测定杂交瘤细胞培养上清中单克隆抗体的亚类。
1.7.3 杂交瘤细胞的染色体分析 按常规方法[6]对杂交瘤细胞的染色体进行分析,于高倍显微镜下观察,每份样本应计数100个中期完整的核细胞,记录染色体数目的分布。
1.7.4 单克隆抗体的特异性鉴定
1.7.4.1 交叉反应 以 PPV、PRRSV、PCV2 为包被抗原,用腹水分别与其进行交叉检测,用间接ELISA检测OD450nm值。
1.7.4.2 间接免疫荧光法(IFA) 用PRV接种于含ST细胞的96孔板中,置37℃ 5%CO2培养箱中培养72 h后用-20℃丙酮固定。按方阵法[7]确定的腹水、FITC标记的抗鼠IgG的工作浓度和反应时间进行IFA检测,于荧光显微镜下观察。
1.7.4.3 免疫组织化学实验(IHC) 组织玻片的制备经取样、固定、包埋、切片、固定。按方阵法[9]确定腹水、生物素标记羊抗小鼠IgG和HRP标记的链霉素最佳工作浓度和反应时间进行IHC检测,经3,3,二甲基联苯胺(DAB)进行底物显色,苏木素复染细胞核之后,于显微镜下进行观察。
1.8 叠加实验 参照文献方法[8-9]进行叠加ELISA实验,并按其公式计算相加指数(AI)。
1.9 相对亲和力的测定 方法参见文献[10]。
1.10 单克隆抗体的稳定性检测 获得的2个细胞株经稳定传代后冻于液氮,1个月后复苏,检测细胞上清抗体。再经腹腔注射BALB/c小鼠,同样检测腹水的抗体效价,并与冻存前效价进行比较。
2 结果
2.1 病毒的增殖与纯化 经密度梯度离心之后总计获得6 mg的PRV病毒,首次免疫剂量为每只100 μg/0.5 mL,电镜结果见图1。

图1 PRV电镜图片(箭头所指为PRV病毒粒子)
2.2 间接ELISA法工作条件的选择 根据方阵法确定间接ELISA方法最佳的PRV包被浓度为0.5 μg/mL。经间接 ELISA 法筛选,3次亚克隆共获得2株分泌抗PRV的单克隆抗体的杂交瘤细胞株,分别命名为1E10和5B5。
2.3 腹水的生产及其纯化 每只小鼠腹腔注射1.0×107个细胞,每只小鼠收取5 mL腹水,辛酸-硫酸铵法纯化腹水,SDS-PAGE结果见图2。

图2 PRV单抗SDS-PAGE图
2.4 单克隆抗体的鉴定
2.4.1 单克隆抗体的效价测定 1E10杂交瘤细胞上清的ELISA效价在1∶1000,腹水的ELISA抗体效价在1∶108,腹水的IFA效价1∶2000;5E5杂交瘤上清的ELISA效价在1∶500,腹水的ELISA抗体效价在1∶108,腹水的IFA效价1∶1500。
2.4.2 单克隆抗体的亚类测定 1E10亚类为IgG1,5B5 亚类为 IgG2b。
2.4.3 杂交瘤细胞的染色体分析 杂交瘤细胞的染色体在95~105范围内变化,平均值在98左右,该数值大于脾细胞染色体数的2倍,小于脾细胞与骨髓瘤细胞染色体数目之和,表明该杂交瘤细胞确实为脾细胞与骨髓瘤细胞融合的产物。
2.4.4 单克隆抗体的特异性鉴定
2.4.4.1 交叉反应 间接ELISA检测结果表明:PPV、PRRSV、PCV2均不与PRV腹水发生交叉反应。
2.4.4.2 IFA 试验 腹水 1∶1000稀释,FITC 标记的抗小鼠IgG 1∶100稀释,2株单克隆抗体均能与ST细胞中的PRV发生反应,可见接种了PRV的ST的细胞膜或胞浆中出现了绿色荧光(图3),阴性对照未见荧光。
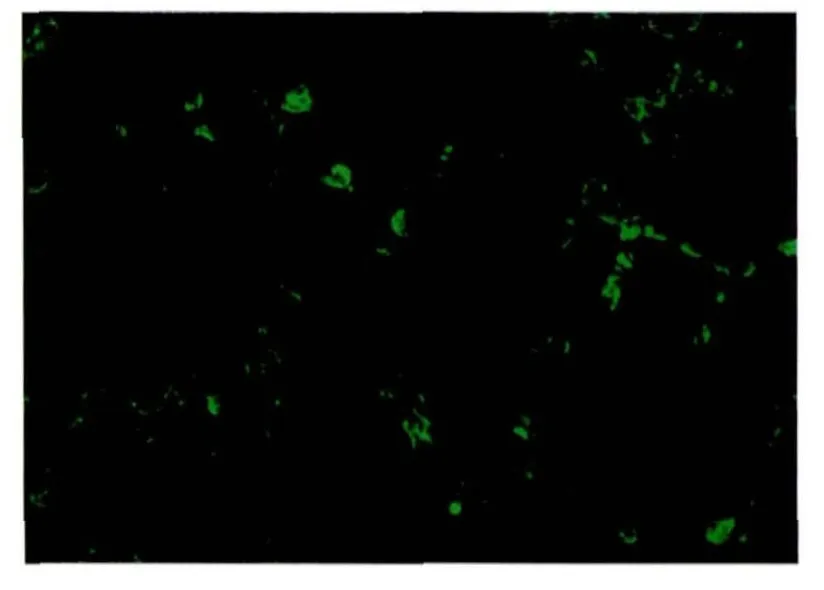
图3 PRV单抗免疫荧光图片(400×)
2.4.4.3 IHC 试验 腹水1∶1000稀释,HRP标记羊抗小鼠IgG 1∶100稀释,DAB显色,2株单克隆抗体均能与神经组织中的PRV发生反应,可见感染了PRV的神经组织的胞膜中出现棕黄色着染(图4,400×),阴性对照组织未见阳性反应。

图4 PRV单抗IHC阳性图片(A)及阴性对照(B)
2.5 叠加实验 2株单抗叠加指数为85.27%,大于50%,说明2株单抗识别不同的抗原位点。
2.6 相对亲和力实验 经非竞争ELISA方法测定1E10的亲和常数为7.4×109L/mol,5B5的亲和常数为6.3 ×109L/mol。
2.7 杂交瘤细胞的稳定性鉴定 2株杂交瘤细胞稳定传代后冻于液氮,1个月后复苏,细胞生长状态良好,抗体分泌水平与冻存前相同。腹腔接种BALB/c小鼠后可致瘤,并稳定地分泌特异性抗体。
3 讨论
本试验采用常规免疫方法制备单抗,虽然耗时较长,但是取得了比较好的免疫效果,制备出来的2株单抗显示出了较好的特异性和稳定性,在这个制备单克隆抗体的试验过程中,抗原质量的好坏决定是否能够顺利筛选出单克隆杂交瘤细胞株,本试验采用了蔗糖密度梯度离心的方法纯化伪狂犬病毒,取得了较好的效果。在筛选的过程中,本试验采用酶联免疫吸附试验、免疫组织化学试验、间接免疫荧光试验三种检测方法共同筛选杂交瘤细胞株,保证了结果的稳定性和可靠性。试验还从杂交瘤细胞的染色体核型、经过连续传代培养和冻存复苏之后的生物学特性、以及单克隆抗体的亚类、纯度、效价、针对的表位等多方面,全方位考察了2株单克隆杂交瘤细胞株分泌抗体的能力强并且稳定。
近年来,国内外有很多 PRV单抗制备的报道[11-13],但是抗原大多数是原核表达蛋白进行免疫,筛选出来的单抗与天然病毒结合能力弱,没有与其他猪病毒进行交叉反应,只识别同一抗原表位,本研究采用蔗糖密度梯度离心的方法纯化PRV抗原,获得了高纯度的PRV,采用ELISA、IHC、IFA筛选与鉴定,同时与PPV、PRRSV、PCV2进行了交叉反应,结果证明所获得的2株单抗不与 PPV、PRRSV、PCV2发生反应,识别不同的抗原表位,本实验获得的2株PRV单克隆抗体为建立特异性强、敏感性高、简便、快速的PRV诊断方法提供了条件。
[1] 殷 震,刘景华.动物病毒学[M].北京:科学出版社,1997:1180-1181.
[2] 袁庆志,吴裕祥.伪狂犬病流行及疫苗免疫状况[J].家畜传染病,1986,27(2):65-67.
[3] 杜念兴.兽医免疫学[M].第二版.北京:中国农业出版社,1997.
[4] 焦新安,刘秀梵.实验手册[M].扬州:江苏农学院传染病教研组,1990:39-50.
[5] 刘秀梵.单克隆抗体在农业上的应用[M].合肥:安徽科学技术出版社,1994:32 -36.
[6] 章谷生,容秉培.单克隆抗体在医学上的应用[M].上海:上海科学技术出版社,1987.
[7] 曹雪涛.精编免疫学实验指南[M].北京:科学出版社,2009.
[8] 崔尚金,王云峰,王翠兰,等.应用单克隆抗体进行兔轮状病毒的抗原分析[J].中国兽医科技,1997,27(5):24-25.
[9] 刘 洁,何文辉,李晶梅,等.分泌抗犬细小病毒单克隆抗体杂交瘤细胞株的建立[J].中国兽药杂志,2013,47(7):9-12.
[10] Macdonald R A,Hosking C S,Jones C L.The measurement of relative antibody affinity by ELISA using thiocyanate elution[J].J Immuno Meth,1988,106:191.
[11]黄红亮,陈焕春,覃雅丽,等.抗伪狂犬病毒gG蛋白单克隆抗体的制备及鉴定[J].中国兽医学报,2004,(3):243-245.
[12] Hampl H,Benporat T,ErlicherL,et al,Characterization of the envelope proteins of pseudorabies virus[J].J Virol,1984,52:583-590.
[13] Jacobs L,Meloen R H,Gielkens A L,et al.Epitope analysis of glycoprptein I of pseudorabies virus[J].J Gen Virol,1990,71:881-887.
