外源性BMMSCs通过改善内源性BMMSCs成骨分化能力缓解去卵巢大鼠骨质疏松
2014-11-27邵秉一常鹤然张立超
帅 逸,于 洋,邵秉一,常鹤然,张立超,廖 立,金 岩*
(第四军医大学 1.口腔医院 口腔组织病理科;2.组织工程研发中心,陕西 西安 710032; 3.重庆医科大学附属口腔医院 牙体牙髓病科, 重庆 400015; 4.佳木斯大学 附属第二口腔医院 口腔颌面外科, 黑龙江 佳木斯 154000)
研究论文
外源性BMMSCs通过改善内源性BMMSCs成骨分化能力缓解去卵巢大鼠骨质疏松
帅 逸1,2,于 洋3,邵秉一3,常鹤然4,张立超4,廖 立1,2,金 岩1,2*
(第四军医大学 1.口腔医院 口腔组织病理科;2.组织工程研发中心,陕西 西安 710032; 3.重庆医科大学附属口腔医院 牙体牙髓病科, 重庆 400015; 4.佳木斯大学 附属第二口腔医院 口腔颌面外科, 黑龙江 佳木斯 154000)
目的观察系统注射骨髓间充质干细胞(BMMSCs)是否通过改善内源性BMMSCs成骨分化能力缓解去卵巢大鼠骨质疏松。方法12只雌性SD大鼠随机分为假手术(sham)组、去卵巢(OVX)组、高剂量(high-dose)组和低剂量(low-dose)组。建立OVX和sham模型。术后24 h,高、低剂量组分别经尾静脉注射1.5×107和0.375×107cells/kg细胞。microCT扫描股骨近端。ALP和茜素红染色检测BMMSCs成骨能力,RT-PCR检测成骨相关基因。结果1)OVX组的骨密度(BMD)和骨小梁数量(Tb.N)低于sham组(Plt;0.05),OVX组内源性BMMSCs的成骨能力弱于sham组(Plt;0.05)。2)高剂量组的BMD和Tb.N高于OVX组(Plt;0.05)。高、低剂量组内源性BMMSCs的成骨能力均强于OVX组(Plt;0.05),高剂量组强于低剂量组(Plt;0.05)。结论系统注射BMMSCs通过改善OVX大鼠内源性BMMSCs的成骨分化能力,缓解OVX大鼠骨质疏松。
系统注射; 骨髓间充质干细胞; 成骨分化; 骨质疏松
《骨质疏松中国白皮书》(2009)[1]显示,2006年中国50岁以上人群中,约有5 600万女性患有骨质疏松,其中近50%有骨折史,严重影响生活质量,因此绝经后骨质疏松的防治至关重要。系统注射间充质干细胞(mesenchymal stem cells, MSCs)对疾病的疗效已经在多种疾病的研究中得到证实[2]。而利用骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMMSCs)治疗骨质疏松的研究较少。本研究旨在明确外源性BMMSCs是否能通过改善内源性BMMSCs成骨能力缓解OVX大鼠骨质疏松,为临床应用提供参考。
1 材料与方法
1.1 材料
SPF级雌性SD大鼠12只,体质量140~150 g[第四军医大学实验动物中心,合格证号SCXK(军)2007-007],α-MEM培养基和胰蛋白酶(Gibco公司),胎牛血清(杭州四季青公司),β-甘油磷酸钠、地塞米松、维生素C、3-异丁基-1-甲基黄嘌呤和吲哚美辛(Sigma公司),胰岛素(万邦制药),cell counting kit-8(CCK-8)试剂盒(Dojindo公司),茜素红(天津科密欧公司),碱性磷酸酶活性试剂和甲苯胺蓝(碧云天公司),Trizol reagent(Invitrogen公司),反转录试剂盒(Toyobo公司),大鼠β-actin、OCN、RUNX2和OPG引物(上海生工)。
1.2 方法
1.2.1 BMMSCs培养: 全骨髓贴壁培养法。以5×107细胞接种于75 cm2塑料培养瓶,含10%体积胎牛血清、1%双抗的α-MEM培养基,37 ℃恒温培养,CO2饱和度为5%。
1.2.2 BMMSCs增殖能力检测: 克隆形成,以1×103细胞接种于75 cm2塑料培养皿,第10天行甲苯胺蓝染色。增殖曲线,以1×103细胞/孔接种于96孔板。每孔加入10 μL CCK-8试剂,低速振荡5 min,37 ℃避光孵育3 h,于450 nm处检测吸光度值,0~7 d,每天同一时间点检测。
1.2.3 BMMSCs成骨、成脂能力检测: 以1×105细胞/孔接种于12孔板。成脂诱导7 d,油红O染色,镜下观察脂滴形成情况。成骨诱导21 d,茜素红染色,镜下观察钙化结节形成情况。
1.2.4 模型建立、系统注射和取材: 建立OVX和sham模型。术后24 h,高、低剂量组分别经尾静脉注射1.5×107和0.375×107细胞/kg[3-6]的细胞悬液,sham和OVX组经尾静脉注射相同体积的PBS。10周后取右侧股骨,4%多聚甲醛固定,左侧股骨BMMSCs原代培养。
1.2.5 microCT扫描: 取右侧股骨近端1 cm,连续扫描2 h,三维重建分析。
1.2.6 内源性BMMSCs成骨能力的比较:成骨诱导方法同1.2.3。成骨诱导7 d,ALP染色,Image Pro Plus 6.0软件分析感兴趣区域的A值。成骨诱导21 d,茜素红染色,10%十六烷基吡啶溶解,560 nm处检测吸光度值。
1.3 统计学分析
2 结果
2.1 注射用BMMSCs生物学特征鉴定
2.1.1 注射用BMMSCs增殖能力:培养皿中形成许多蓝染克隆,克隆之间不相连,单个克隆中细胞生长密集(图1A)。细胞1~4 d增殖较快, 5~7 d增殖较慢;第1天进入对数期,第5天进入平台期(图1B)。
2.1.2 注射用BMMSCs成骨、成脂能力:茜素红染色,镜下见大量红色钙化结节(图1C)。油红O染色,镜下见细胞内多个红色圆形或椭圆形脂滴(图1D)。
2.2 骨质疏松模型建立成功
OVX组的BMD和Tb.N较sham组分别降低42%和50%(图2,表1)。OVX组的ALP染色较sham组浅,A值降低80%(图3A,表2)。OVX组的茜素红染色较sham组浅,A值降低62%(图3B,表2)。OVX组的OCN、RUNX2和OPG基因表达量较sham组分别降低61%、77%和60%(表3)。
2.3高剂量BMMSCs注射可缓解OVX大鼠骨质疏松
高剂量组的BMD和Tb.N较OVX组分别升高44%和52%,低剂量组与OVX组区别不明显(图2,表1)。
2.4外源性BMMSCs可恢复OVX大鼠内源性BMMSCs成骨分化能力
2.4.1 内源性BMMSCs成骨诱导7 d ALP染色,21 d茜素红染色:ALP染色,高、低剂量组染色较OVX组深,A值分别升高293%和96%,高剂量染色组比低剂量组深,A值升高98%(图3A,表2)。茜素红染色,高、低剂量组染色较OVX组深,A值分别升高114%和51%,高剂量组染色比低剂量组深,A值升高42%(图3B,表2)。

表1 股骨近端BMD和Tb.N
*Plt;0.05 compared with sham;#Plt;0.05 compared with OVX;△Plt;0.05 compared with low-dose.
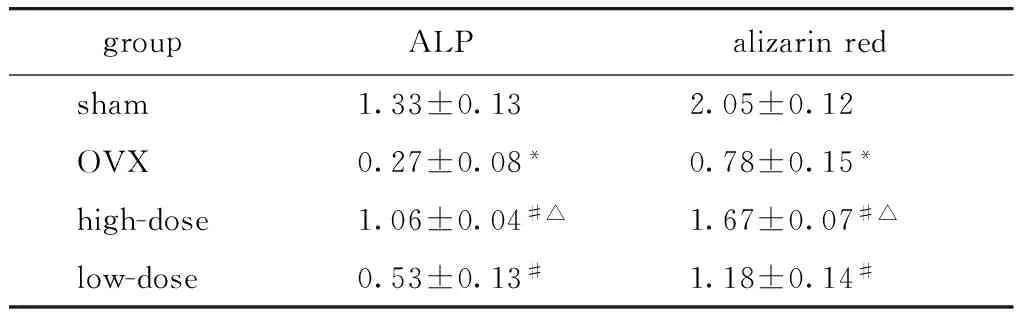
表2 内源性BMMSCs的ALP和茜素红染色定量
*Plt;0.05 compared with sham;#Plt;0.05 compared with OVX;△Plt;0.05 compared with low-dose.

A.clone formation(×40); B.proliferate curve;C.osteogenesis(×20); D.adipogenesis(×20)图1 注射用BMMSCs生物学特征鉴定Fig 1 Biological characterization of injected BMMSCs
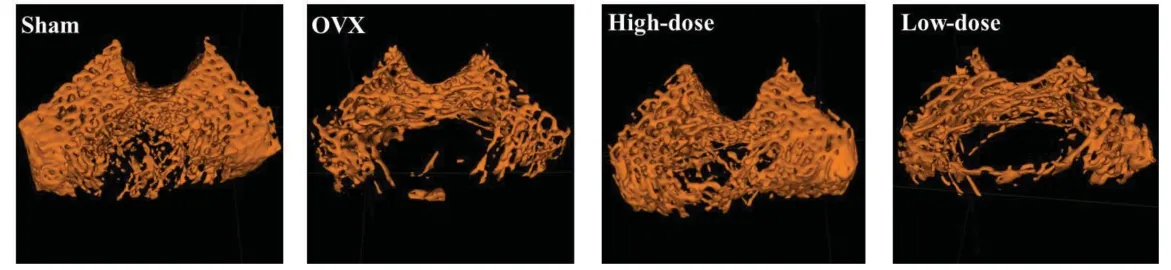
图2 股骨近端显微CT扫描Fig 2 microCT scanning of proximal femur
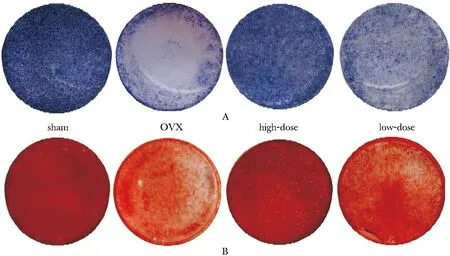
A.ALP staining; B.alizarin red staining图3 内源性BMMSCs的ALP和茜素红染色Fig 3 ALP and alizarin red staining of endogenous BMMSCs
2.4.2 内源性BMMSCs成骨诱导7 d成骨相关基因表达:高剂量组的OCN、RUNX2和OPG表达量较OVX组分别升高99%、231%和82%。低剂量组仅有RUNX2表达量较OVX组升高了75%(表3)。
3 讨论
尽管临床治疗绝经后骨质疏松的药物很多,但疗效不佳且不良反应多[7-8]。BMMSCs具有生物学和伦理学优势[9-10],因此被广泛应用于多种疾病治疗当中[2]。
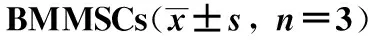
表3 内源性BMMSCs成骨相关基因的表达
*Plt;0.05 compared with sham;#Plt;0.05 compared with OVX;△Plt;0.05 compared with low-dose.
本实验明确了分离的细胞具有干细胞的特征。发现系统注射BMMSCs能够有效减少OVX大鼠的骨量丢失,高剂量疗效优于低剂量。内源性BMMSCs体外成骨分化能力的变化趋势与显微CT结果基本一致,说明OVX组内源性BMMSCs的成骨分化能力受损,外源性BMMSCs可能是通过改善内源性BMMSCs的成骨分化能力缓解骨质疏松的。虽然低剂量组内源性BMMSCs的成骨分化能力强于OVX组,但仅有RUNX2的表达量高于OVX组,且两组的BMD和Tb.N无明显差异,这提示低剂量外源性BMMSCs对OVX大鼠内源性BMMSCs成骨分化能力的改善程度有限,还不能达到提高骨量的作用雌激素缺乏时,机体稳态遭到破坏,以致内源性BMMSCs成骨分化能力异常,从而影响成骨-破骨平衡[11-12]。目前临床常用药物大多是抑制破骨过程,而促进成骨的药物较少。本实验的创新点在于发现系统注射BMMSCs可以通过恢复OVX大鼠内源性BMMSCs的成骨分化能力,缓解雌激素缺乏性骨质疏松。相对于低剂量BMMSCs,高剂量BMMSCs进入体内后,可能在分泌因子的量和与内源性细胞接触范围上占有优势,从而形成更为有利的微环境,间接影响到成骨-破骨平衡,更好地发挥疗效。
[1] 中国促进基金会骨质疏松防治中国白皮书委员会. 骨质疏松症中国白皮书[J]. 中华健康管理学杂志, 2009, 3: 148-153.
[2] Wei X, Yang X, Han ZP,etal. Mesenchymal stem cells: a new trend for cell therapy[J].Acta Pharmacol Sin, 2013, 34:747-754.
[3] Khalili MA, Anvari M, Hekmati-Moghadam SH,etal. Therapeutic benefit of intravenous transplantation of mesenchymal stem cells after experimental subarachnoid hemorrhage in rats[J].J Stroke Cerebrovasc Dis, 2012, 21: 445-451.
[4] Lin QM, Zhao S, Zhou LL,etal. Mesenchymal stem cells transplantation suppresses inflammatory responses in global cerebral ischemia: contribution of TNF-alpha-induced protein 6[J]. Acta Pharmacol Sin, 2013, 34: 784-792.
[5] Osaka M, Honmou O, Murakami T,etal. Intravenous administration of mesenchymal stem cells derived from bone marrow after contusive spinal cord injury improves functional outcome[J].Brain Res, 2010, 1343: 226-235.
[6] Honma T, Honmou O, Iihoshi S,etal. Intravenous infusion of immortalized human mesenchymal stem cells protects against injury in a cerebral ischemia model in adult rat[J]. Exp Neurol, 2006, 199: 56-66.
[7] Teitelbaum SL. Stem cells and osteoporosis therapy[J]. Cell Stem Cell, 2010, 7: 553-554.
[8] Kerschan-Schindl K, Haschka J, Obermayer-Pietsch B,etal. How long women with postmenopausal osteoporosis should be treated with a bisphosphonate?[J]. Horm Metab Res, 2013, 45:621-628.
[9] Schu S, Nosov M, O’Flynn L,etal. Immunogenicity of allogeneic mesenchymal stem cells[J]. J Cell Mol Med, 2012, 16:2094-2103.
[10] De Miguel MP, Fuentes-Julian S, Blazquez-Martinez A,etal. Immunosuppressive properties of mesenchymal stem cells: advances and applications[J]. Curr Mol Med, 2012, 12:574-591.
[11] Breuil V, Ticchioni M, Testa J,etal. Immune changes in post-menopausal osteoporosis: the Immunos study[J]. Osteoporos Int, 2010, 21: 805-814.
[12] Geusens P, Lems WF. Osteoimmunology and osteoporosis[J]. Arthritis Res Ther, 2011, 13: 242-258.
Exogenous BMMSCs ameliorate osteoporosis ofovariectomized rat via improving osteogenesis of endogenous BMMSCs
SHUAI Yi1,2, YU Yang3, SHAO Bing-yi3, CHANG He-ran4, ZHANG Li-chao4, LIAO Li1,2, JIN Yan1,2*
(1.Dept. of Oral Histology and Pathology, School of Stomatology; 2.Tissue Engineering Ramp;D Center, the Fourth Military Medical University,Xi’an 710032; 3.Affiliated Hospital of Stomatology, Chongqing Medical University, Chongqing 400015; 4.Dept. of Oral andMaxillofacial Surgery, the Second Affiliated Hospital of Stomatology, Jiamusi University, Jiamusi 154000, China)
ObjectiveTo find whether systemic administration of bone marrow mesenchymal stem cells (BMMSCs) can prevent osteoporosis of ovariectomized rat via ameliorating osteogenesis of endogenous BMMSCs.MethodsTwelve female Sprague-Dawley rats were randomly divided into group sham, OVX, high-dose and low-dose. Established OVX and sham model. 24 hours after operation, rats in group high-dose and low-dose were systemically injected BMMSCs via tail vein at the dose of 1.5×107and 0.375×107cells/kg, respectively. Proximal femurs were analysed by MicroCT. Osteogenesis of BMMSCs was examined by ALP, alizarin red staining and real-time PCR.ResultsBone mineral density (BMD) and trabecular bone number (Tb.N) of group OVX were lower than those from group sham. BMD and Tb.N of group high-dose were higer than group OVX. Compared to group OVX,osteogenesis of endogenous BMMSCs derived from high-dose group and low-dose group were much better, and that from high-dose group turned out to be better than low-dose group.ConclusionsIt is effective to relieve symptoms of osteoporosis in ovariectomized rats through treating them with exogenous BMMSCs by the way of rescuing osteogenesis of endogenous BMMSCs.
systemic injection; bone marrow mesenchymal stem cells; osteogenesis; osteoporosis
2013-10-31
2014-01-13
国家重点基础研究发展计划(973)(2011CB964700)
*通信作者(correspondingauthor): yanjinfmmu@139.com
1001-6325(2014)05-0610-05
R322.7+1
A
