核酸适配体修饰的铁纳米粒对HER2阳性乳腺癌的靶向热疗效应
2014-11-27李凤武段金虹许海燕杨先达
李凤武,胡 燕*,段金虹,许海燕,杨先达*
(中国医学科学院 北京协和医学院 基础医学研究所 1.病理与病理生理系;2.生物医学工程系, 北京 100005)
研究论文
核酸适配体修饰的铁纳米粒对HER2阳性乳腺癌的靶向热疗效应
李凤武1,胡 燕1*,段金虹1,许海燕2,杨先达1*
(中国医学科学院 北京协和医学院 基础医学研究所 1.病理与病理生理系;2.生物医学工程系, 北京 100005)
目的研发能提高HER2阳性乳腺癌热疗效应的核酸适配体-铁纳米粒子复合体(AptNPs),探索肿瘤靶向治疗的全新途径。方法利用生物素和链霉亲和素的结合反应构建AptNPs,用动态光散射粒径仪表征其尺寸分布,用流式细胞仪和相差显微镜检测AptNPs的靶向结合能力,MTS法测其对磁场下抗肿瘤热疗效果的影响。结果通过生物素-亲和素反应构建了AptNPs,其平均直径为333.7 nm,对HER2阳性细胞有较强的结合,对HER2阴性细胞没有结合。此外,AptNPs可显著提升对HER2阳性细胞的热疗杀伤率(Plt;0.05),但对 HER2阴性细胞的热疗后杀伤率影响较小。结论AptNPs能靶向性地提升针对HER2阳性肿瘤细胞的热疗效率,在研发新型肿瘤靶向热疗方面具有潜在应用价值。
核酸适配体;热疗;HER2阳性;乳腺癌
乳腺癌是女性最常见的恶性肿瘤[1],其中20%~30%高表达HER2蛋白[2]。HER2阳性乳腺癌预后差且侵袭性高[3]。目前针对HER2阳性乳腺癌的靶向治疗药物是西妥昔单抗[4],但大多数患者会产生耐药性[5],因此急需靶向HER2的新型疗法。铁纳米粒可以在交变磁场吸收热量,对肿瘤细胞产生热杀伤效应[6]。但该热疗效应不具备HER2靶向性。HER2适配体是经筛选得到的单链寡核苷酸,能以较高的特异性和较强的亲和力(KDlt;20 nmol/L)识别HER2结构[4],是一类新型的HER2靶向分子[7-8]。本研究通过生物素与链霉亲和素间的高效相互作用(KD为10-6nmol/L),将HER2适配体和铁纳米粒连接,构建了能够靶向HER2的适配体-铁纳米粒复合物(AptNPs), 并在体外初步评估了其对HER2阳性肿瘤细胞的靶向热疗效果。
1 材料与方法
1.1 材料
SK-BR-3和MDA-MB-231细胞系(北京协和医学院细胞中心),铁磁纳米粒(Promaga公司),亲和素修饰引物、FITC修饰引物和FAM修饰引物(Invitrogen公司),Taq酶和dNTP(Genstar公司)。
1.2 方法
1.2.1 细胞培养: SK-BR-3培养于含20%胎牛血清的改良型1640;MDA-MB-231培养于含10% 胎牛血清的DMEM(高糖型)。两种细胞系培养在37 ℃、5% 的CO2培养箱中。所有细胞实验均使用对数增值期的细胞。
1.2.2 AptNPs的构建:PCR获得P1-biotin修饰的双链HER2 核酸适配体(95 ℃,40 s; 55 ℃,30 s;72 ℃,40 s;25个循环)。混合10 pmol PCR产物和10 μL链霉亲和素修饰的铁纳米粒,室温下振荡15 min。PBS洗涤3次,加40 mmol的NaOH振荡5 min,弃上清,10 μL PBS重悬。
1.2.3 流式检测:PCR获得P1-FITC修饰的双链HER2核酸适配体。混合20 pmol PCR产物和20 μL链霉亲和素修饰的铁纳米粒,室温下振荡15 min。PBS洗涤3次,加100 mmol的NaOH室温振荡5 min,取上清,加入等体积的100 mmol盐酸,混匀。分别加入SK-BR-3和MDA-MB-231细胞中,37 ℃摇床孵育30 min,PBS洗涤4次,重悬,流式检测。
混合25 pmol的FAM标记的HER2 杂交探针与10 μL AptNPs,室温下振荡30 min,PBS洗涤3次,200 μL PBS重悬,流式检测。
1.2.4 相差显微镜成像:SK-BR-3培养于6孔板,加入50 μL AptNPs,37℃摇床孵育1 h,PBS洗涤3次,室温下加入4%多聚甲醛固定20 min,PBS洗涤2次,室温下普鲁士蓝染液孵育20 min,PBS洗涤2次,重悬,在相差显微镜下观察。
1.2.5 表征检测: 吸取10 μL AptNPs,用双蒸水稀释到1 mL,在动态光散射粒仪下检测AptNPs的尺度分布。
1.2.6 MTS检测: SK-BR-3和MD-MBA-231接种于96孔板,分别加入10 μL AptNPs、游离核酸适配体、游离铁纳米粒,37 ℃摇床孵育1 h,PBS洗涤3次,无血清培养基重悬,在交变电磁场中孵育数小时,以标准MTS法检测细胞存活率。
1.3 统计学分析
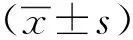
2 结果
2.1 HER2核酸适配体的结合性质
在HER2阳性的SK-BR-3细胞中,HER2核酸适配体(HER2-Apt)荧光强度较随机DNA(Random)明显增强,曲线右移(黑色),HER2核酸适配体能够结合HER2阳性肿瘤细胞(图1A);在HER2阴性的MDA-MB-231细胞中,HER2核酸适配体与随机DNA的荧光强度基本相同,没有明显位移,HER2核酸适配体基本不能结合HER2阴性的肿瘤细胞(图1B)。
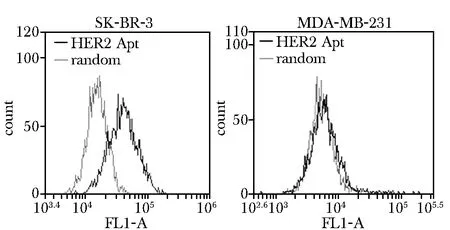
图1 HER2 核酸适配体的结合性质的流式分析Fig 1 The bindings of the HER2 aptamer to the HER2- positive SK-BR-3 and the HER2-negative MDA-MB-231 breast cancer cells
2.2 AptNPs的构建
相比于control, HER2探针处理后荧光强度明显增强,曲线右移(黑色),HER2适配体连接到了AptNps上(图2A);而游离铁纳米粒荧光强度没有变化,未见曲线位移(黑色),HER2适配体没有连接到游离铁纳米上(图2B)。
A.binding of the FAM-labeled probes to beads coated with HER2 aptamer; B.binding of the FAM-labeled probes toblank beads图2 流式细胞仪检测AptNP HER2适配体Fig 2 Binding of the FAM-labeled probes to beads coated with Hev2 aptamer or blank beads
2.3 AptNPs的尺度表征
AptNPs的平均直径为333.7 nm,空铁纳米粒的平均直径为303.1 nm,两者尺度相似(图3)。
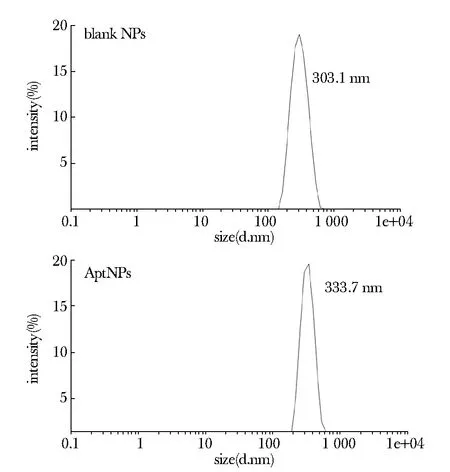
图3 动态光散射粒径仪对纳米粒子尺度的评估Fig 3 Size distributions of blank NPs (above) and the AptNPs (below) detected by DSL
2.4 AptNPs对HER2阳性细胞的特异性结合
AptNPs在HER2阳性细胞中有较强的普鲁士蓝染色,对HER2阳性细胞有较强的结合(图4A),对HER2阴性细胞染色较浅、结合较弱(图4C);而空白NPs对HER2阳性及阴性细胞都染色较浅、结合较弱(图4B, D)。
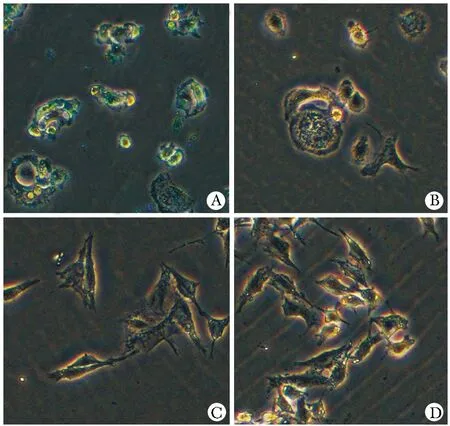
A.bindings of AptNPs to HER2-positive SK-BR-3; B.bindings of blank NPs to HER2-positive SK-BR-3; C.bindings of AptNPs to HER2-negative MDA-MB-231; D.bindings of blank NPs to HER2-negative MDA-MB-231; the particles were incubated with the cells, washed, and stained with Prussian blue to outline the iron-containing NPs图4 AptNPs对HER2阳性细胞的结合特异性分析Fig 4 Binding of AptNPs to Her-positive SK-BR-3 tumor cells
2.5 AptNPs对热疗效果的增强作用
AptNPs能显著提升对HER2阳性肿瘤的热杀伤效率(Plt;0.05),而NPs和HER2 Apt没有明显作用(图5A);相反,在HER2阴性细胞中,AptNPs、NPs、HER2 Apt皆没有显著的热疗提升作用(图5B),提示AptNPs可靶向性地提升针对HER2阳性肿瘤的热疗效应。
3 讨论
本实验的目的是利用核酸适配体介导的铁纳米粒提高对HER2阳性乳腺癌的热疗效率。由于HER2阳性乳腺癌预后较差,且目前西妥昔单抗的应用受到耐药性的限制,因此迫切需要研究新型的靶向HER2的疗法。

A.AptNps enhanced the thermal therapies efficacy against the HER2-postive SK-BR-3 cells; B.AptNps had little effect on the thermal therapies efficacy against the HER2-negative MDA-MB-231 cells; *Plt;0.05 compared with NPs图5 AptNPs对乳腺癌细胞热疗效应的影响Fig 5 AptNPs enhanced the thermal the rapies efficacy against Her2-positive SK-BR-3 cells but not the Her2-negative MD-MB-231 cells
本实验构建了一个核酸适配体-铁磁纳米粒复合体,与单纯铁磁纳米粒大小几乎无差异,可见核酸适配体的修饰并没有改变铁磁纳米粒的大小。对SK-BR-3细胞有较强的结合而对MDA-MB-231细胞基本没有结合。此外,AptNPs能够结合HER2阳性乳腺癌细胞,而对HER2阴性细胞结合较弱,提示AptNPs能靶向结合HER2阳性肿瘤细胞,具有提升靶向热疗效应的潜能。尤为重要的是,AptNPs还特异性地提升针对HER2阳性细胞的热疗效果,而对HER2阴性细胞没有影响。
本实验首次尝试将HER2核酸适配体与铁纳米粒结合,并应用于HER2阳性乳腺癌的靶向热疗当中。传统热疗中的热敏剂不具靶向作用,分散在机体各处,稀释了有效浓度,有可能降低热疗效果,甚至产生其他系统的病变。而AptNPs有可能选择性地结合肿瘤细胞,从而改善现有热疗的效果。未来研究应致力于评估靶向热敏剂的体内效应,并深入研究核酸适配体的降解、铁磁纳米粒的代谢等一系列问题。
综上所述,AptNPs能选择性地提升针对 HER2阳性乳腺癌细胞的热疗效应。该结果提示,核酸适配体所介导的铁热敏剂,在针对HER2乳腺癌的靶向热疗中具有潜在的应用价值,并且为其他肿瘤的热疗提供了新的思路和方法。
[1] Varmira k, Seyed A, Hosseinimehr J,etal. A HER2-targeted RNA aptamer molecule labeled with 99mTc for single-photon[J]. Nucl Med Biol, 2013, 40: 980-986.
[2] Arteaga CL, Sliwkowski MX, Osborne CK,etal. Treatment of HER2-positive breast cancer: current status and future perspectives[J]. Nat Rev Clin Oncol, 2011, 9: 16-32.
[3] Kambiz V, Seyed J, Hosseinimehr ZN,etal. An improved radiolabelled RNA aptamer molecule for HER2 imaging[J]. J Drug Target, 2014, 2: 11-20.
[4] Liu Z, Duan JH, Song YM,etal. Novel HER2 aptamer selectively delivers cytotoxic drug to HER2-positive breast cancer cellsinvitro[J]. J Transl Med, 2012, 10: 147-148.
[5] Montemurro F, Valabrega G, Aglietta M. Trastuzumab treatment in breast cancer [J]. N Engl J Med, 2006, 354: 2185-2186.
[6] Song KM, Lee S, Ban C,etal. Aptamers and their biological applications [J]. Sensors, 2012, 12: 612-631.
[7] Jisu K, GwanHo L, Woong J,etal. Selective and quantitative cell detection based both on aptamers and the conventional cell-staining methods[J]. Biosensors Bioelectr, 2013, 43: 362-365.
[8] Samanta B, Yan HY, Fischer NO,etal. Protein-passivated Fe3O4nanoparticles: low toxicity and rapid heating for thermal therapy[J]. J Mater Chem, 2008, 18: 1204-1208.
Enhancement of thermal damage to HER2-positivebreast cancer cells by aptamer-guided magnetic nanoparticles
LI Feng-wu1, HU Yan1*, DUAN Jin-hong1, XU Hai-yan2, YANG Xian-da1*
(1.Dept. of Physiology and Pathophysiology; 2.Dept. of Biomedical Engineering, Institute of Basic Medical Science,CAMS amp; PUMC, Beijing 100005, China)
ObjectiveTo develop aptamer-modified nanoparticles (AptNPs) for targeted enhancement of thermal damage to HER2-positive breast cancer cells.MethodsHER2 aptamer was connected to NPs via biotin-streptavidin reaction. AptNPs were characterized by Dynamic Light Scattering (DLS). The binding feature of the aptamer was evaluated by flow cytometry, and the affinity of AptNPs to target cells by phase-contrast microscopy. Thermal damage under alternative magnetic field was measured by MTS assay.ResultsThe average size of AptNPs was 333.7 nm. AptNPs exhibited strong binding to the HER2-positive but not the HER2-negative cells. Importantly, AptNPs enhanced the thermal damage to the HER2-positive tumor cells, but not that to the HER2-negative cells.ConclusionsAptamer-guided iron particles may have potential utility in development of novel HER2-targeted thermal therapies.
aptamers; thermal therapy; HER2-targeted; breast cancer
2013-12-31
2014-03-12
科技部重大科学计划 (2011CB933504, 2011CB911004,2011CB911003)
*通信作者(correspondingauthor):hyjy2008@hotmail.com;ayangmd@gmail.com
1001-6325(2014)05-0644-04
R 730.54
A
