乳浆大戟提取物对人肺癌细胞生长的影响
2014-11-21王爱红庞秋霞陈美霓米志宽符兆英杨文杰向云涛
王爱红,庞秋霞,陈美霓,米志宽,符兆英*,杨文杰,向云涛
(1延安大学医学院生物化学教研室,延安716000;2延安大学医学院;*通讯作者,E-mail:fu_zhaoying@163.com)
肺癌是严重威胁人类健康的常见恶性肿瘤之一,其发病率及病死率均居首位[1,2],从天然资源如植物或中药中寻找提取毒副作用小的治疗肺癌的药物,有着特别重要的意义[3-6]。本研究发现,乳浆大戟提取物具有诱导人肺癌A549细胞凋亡的作用,并对其作用机制做了初步研究,结果报道如下。
1 材料与方法
1.1 细胞株和主要试剂
人肺癌细胞A549由延安大学医学实验中心实验室保存。噻唑蓝(MTT)、碘化丙锭(PI)、二甲亚砜(DMSO)(sigma-Aldrich公司,美国);RPMI 1640培养基(invitrogen公司,美国),四季青新生小牛血清(浙江天杭生物科技有限公司),胰酶(Gibco BRL公司,美国),Trizol(invitrogen 公司,美国),JC-1线粒体膜电位检测试剂盒(南京凯基生物技术有限公司),RevertAidTM First Strand cDNA Synthesis Kit(Fermentas公司,加拿大);Bcl-2、Bax、β-actin 引物由上海生工设计合成,荧光倒置显微镜及CCD采用Nikon显微镜,流式细胞仪 FACS Calibur(Becton Dickinson公司,美国),凝胶成像系统(SYNGENE公司,美国),酶标仪采用美国Bio-Rad 680型全自动酶标仪。
1.2 方法
1.2.1 细胞培养 人肺癌细胞用RPMI1640培养基培养,常规加入10%小牛血清,100 U/ml青霉素,0.1 mg/mL链霉素。放置37℃、5%CO2培养箱中培养。
1.2.2 乳浆大戟提取物制备 乳浆大戟地上全草阴干,用植物捣碎机粉碎,加适量纯水制成混悬液,粗滤纸过滤收集滤液,低温风干称重,加纯水配制成100 g/L,0.22μm滤器过滤保存于-20℃备用。
1.2.3 MTT法检测乳浆大戟提取物对人肺癌细胞增殖的影响 取对数生长期的A549细胞,以5×104/ml的密度接种于96孔板中,每孔200μl。次日细胞贴壁后,更换培养基,添加乳浆大戟提取物,其终浓度为0,0.2,0.4,0.8 g/L,每个浓度设 6 个复孔,于培养 24,48,72 h 加入 MTT 20 μl/孔(5 mg/ml),继续孵育4 h,吸弃培养液,加入二甲基亚砜(DMSO)150μl/孔,充分混匀,在酶标仪490 nm处测其吸光度(A)值,计算平均A值和抑制率(IR)。试验重复三次。IR=(1-实验组A值/对照组A值)×100%。
1.2.4 Hoechst33528和PI染色法观察细胞形态学改变 取对数生长期的A549细胞,以2×105/ml的密度接种于6孔板中,每孔2 ml。次日细胞贴壁后,更换培养基,添加乳浆大戟提取物,其终浓度为0,0.2,0.4,0.8 g/L,培养 48,72 h 后弃去培养基,2 ml PBS洗二次,加入50 g/L的PI染料,避光染色30 min,Hoechst33528染色按照说明书进行,荧光显微镜观察细胞核的形态改变。
1.2.5 流式细胞仪检测细胞凋亡率 流式细胞术样品准备:①细胞处理方法同1.2.3,培养48 h后,消化收集细胞(1-5)×106个,500-1 000 r/min离心5 min,弃去培养液。②3 ml PBS洗一次。③离心去除PBS,加入冰预冷的70%的乙醇固定,4℃,1 h。④离心弃去固定液,3 ml PBS重悬5 min。⑤400目的筛网过滤1次,500-1 000 r/min离心5 min,弃去PBS。⑥用1 ml PI染液,4℃避光30 min。⑦流式细胞仪检测细胞凋亡率。
1.2.6 细胞线粒体膜电位检测 细胞处理同1.2.3,培养48 h后吸弃全部培养基,用PBS洗涤细胞一次,加1 ml培养液和1 ml JC染色工作液,充分混匀,在培养箱37℃孵育20 min;37℃孵育结束后,吸弃含染色液的培养液,用JC染色缓冲液洗涤2次;加入2 ml细胞培养液,在荧光显微镜下观察并照相。
本实验采用JC-1荧光探针法检测细胞的线粒体膜电位,在线粒体膜电位较高时,JC-1聚集在线粒体的基质中,形成聚合物产生红色荧光,线粒体膜电位较低时,JC-1不能聚集在线粒体的基质中,此时JC-1为单体,产生绿色荧光。正常的细胞膜电位较高,镜下观察为红色;当出现凋亡时,膜电位下降,镜下观察为绿色。
1.2.7 RT-PCR 将 A549细胞接种于25 ml培养瓶中,接种浓度为 3×105/ml,细胞处理方法同1.2.3。按Trizol试剂盒说明书操作提取总RNA,DEPC水溶解,取少量样品进行紫外分光光度计定量和琼脂糖凝胶电泳分析,-80℃保存。取1μg总RNA在20μl体系中逆转录合成cDNA,逆转录体系包括总 RNA 1μg、引物 oligo(dT)181μl、5×Reaction buffer 4 μl、RNase inhibition 1 μl、10 mmol/L dNTP Mix 2 μl、Reverse Transcriptase1 μl、加水至20 μl,逆转录条件42 ℃1 h,70 ℃5 min,取2 μl cDNA产物在25μl反应体系中进行PCR仪中扩增,β-actin作为内对照,引物序列、大小及退火温度见表1。PCR反应体系包括cDNA产物2μl、上游引物和下游引物各加1 μl、2×PCR mix 12.5 μl、水8.5 μl,混匀离心,放进梯度PCR仪,按以下条件扩增,94℃预热3 min,94 ℃ 3 s,59.1 ℃(bax)、64.2 ℃(bcl-2)、61.8 ℃(β-actin)3 s、72 ℃1 min,共 30 个循环。PCR产物在1.5%琼脂糖凝胶进行电泳分离,并用Gene凝胶成像系统进行照相及半定量分析。

表1 被检测基因所使用的引物序列Table 1 Sequence of primers of target genes
1.3 统计学分析
2 结果
2.1 乳浆大戟提取物对A549细胞增殖的影响
MTT法检测结果显示,用不同浓度乳浆大戟提取物处理细胞,细胞增殖被抑制,各时点各剂量组与对照组均差异有统计学意义,最大抑制率达46.3%(见表2)。
表2 MTT法测乳浆大戟提取物对A549细胞生长的抑制作用(n=18,±s)Table 2 Inhibition effect of extracts of Euphorbia esula on proliferation of A549 cell by MTT assay(n=18,±s)
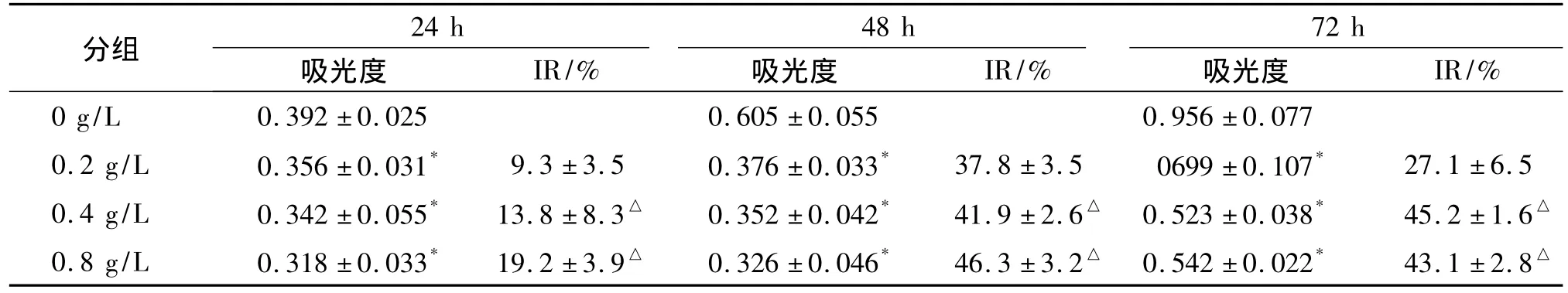
表2 MTT法测乳浆大戟提取物对A549细胞生长的抑制作用(n=18,±s)Table 2 Inhibition effect of extracts of Euphorbia esula on proliferation of A549 cell by MTT assay(n=18,±s)
与对照组(0 g/L)相比,*P<0.05;与0.2 g/L 组相比,△P<0.05
0.4 g/L 0.342±0.055* 13.8±8.3△ 0.352±0.042* 41.9±2.6△ 0.523±0.038* 45.2±1.6△0.8 g/L 0.318±0.033* 19.2±3.9△ 0.326±0.046* 46.3±3.2△ 0.542±0.022* 43.1±2.8△
2.2 乳浆大戟提取物对A549细胞形态的影响
倒置相差显微镜下观察对照组细胞饱满呈梭形,胞质丰富,大小均一,单层贴壁生长,处理组的细胞减少,细胞间隙增大,贴壁状态差,细胞变圆,细胞膜皱缩,折光性小,细胞脱落明显(见图1)。
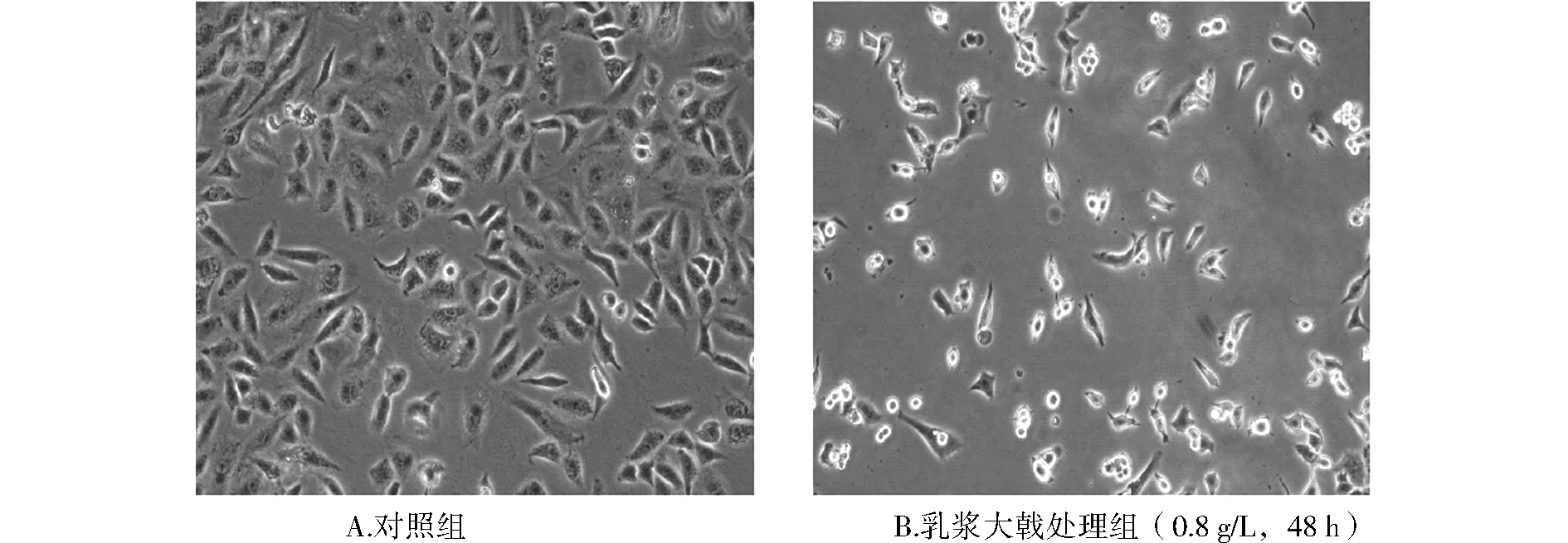
图1 乳浆大戟提取物作用A549细胞48 h的细胞形态变化 (×100)Figure 1 Morphology of A549 cells after treated with 0.8 g/L extracts of Euphorbia esula for 48 h (×100)

图2 乳浆大戟提取物作用A549细胞48 h的细胞核染色质形态变化 (×100)Figure 2 Effects of on morphology of cell nuclear of A549 cells after treated with different concentrations of extracts of Euphorbia esula for 48 h (×100)

图3 乳浆大戟提取物作用A549细胞48 h的线粒体膜电位变化 (JC-1染色,×200)Figure 3 Changes of mitochondrial membrane potential of A549 cells after treated with extracts of Euphorbia esula for 48 h(JC-1 staining,×200)
Hoechst33528和PI染色结果显示,正常对照组细胞的细胞核呈完整椭圆形,细胞数目多,几乎无凋亡细胞;与对照组相比,处理组细胞核皱缩变形,细胞数目明显减少,细胞体积变小、变圆,细胞核出现固缩,呈致密强荧光(图2,见第548页)。
2.3 乳浆大戟提取物对A549细胞凋亡的影响
流式细胞仪结果显示,不同浓度的乳浆大戟提取物作用A549细胞48 h后,可以诱导细胞凋亡,随着药物浓度的增加,凋亡率增大,各个处理组的细胞凋亡率与正常对照组细胞相比有差异(P<0.05,见表3)。
表3 乳浆大戟提取物作用A549细胞48 h的凋亡率(n=3,±s)Table 3 Effect of extracts of Euphorbia esula on apoptosis of A549 at 48 h by flow cytometry (n=3,±s)
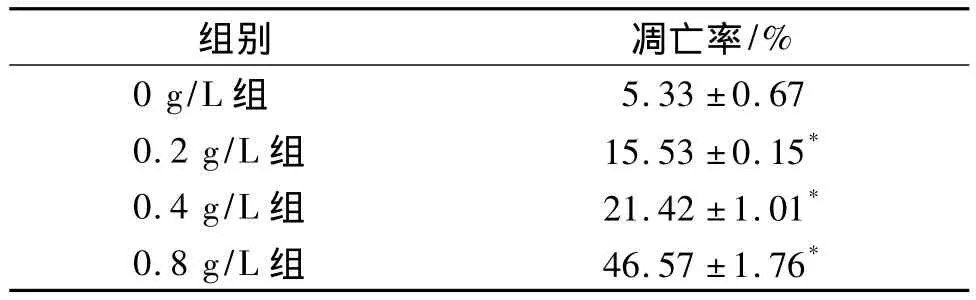
表3 乳浆大戟提取物作用A549细胞48 h的凋亡率(n=3,±s)Table 3 Effect of extracts of Euphorbia esula on apoptosis of A549 at 48 h by flow cytometry (n=3,±s)
与对照组(0 g/L)相比,*P<0.05
0.4 g/L 组 21.42±1.01*0.8 g/L 组 46.57±1.76*
2.4 乳浆大戟提取物对A549细胞线粒体膜电位的影响
荧光显微镜下观察可见对照组细胞呈红色,表明线粒体膜电位正常,而处理组细胞多数呈绿色,表明线粒体膜电位下降,细胞凋亡,说明线粒体途径参与乳浆大戟提取物诱导的细胞凋亡(图3,见第548页)。
2.5 bax和 bcl-2的 mRNA 表达
RT-PCR结果显示,乳浆大戟提取物处理A549细胞,bax的 mRNA表达的逐渐增加,bcl-2的mRNA表达逐渐减弱(图4A)。以内参照β-actin校正,以校正值为基因的表达丰度,bcl-2和bax的mRNA表达呈剂量-反应关系(图4B)。
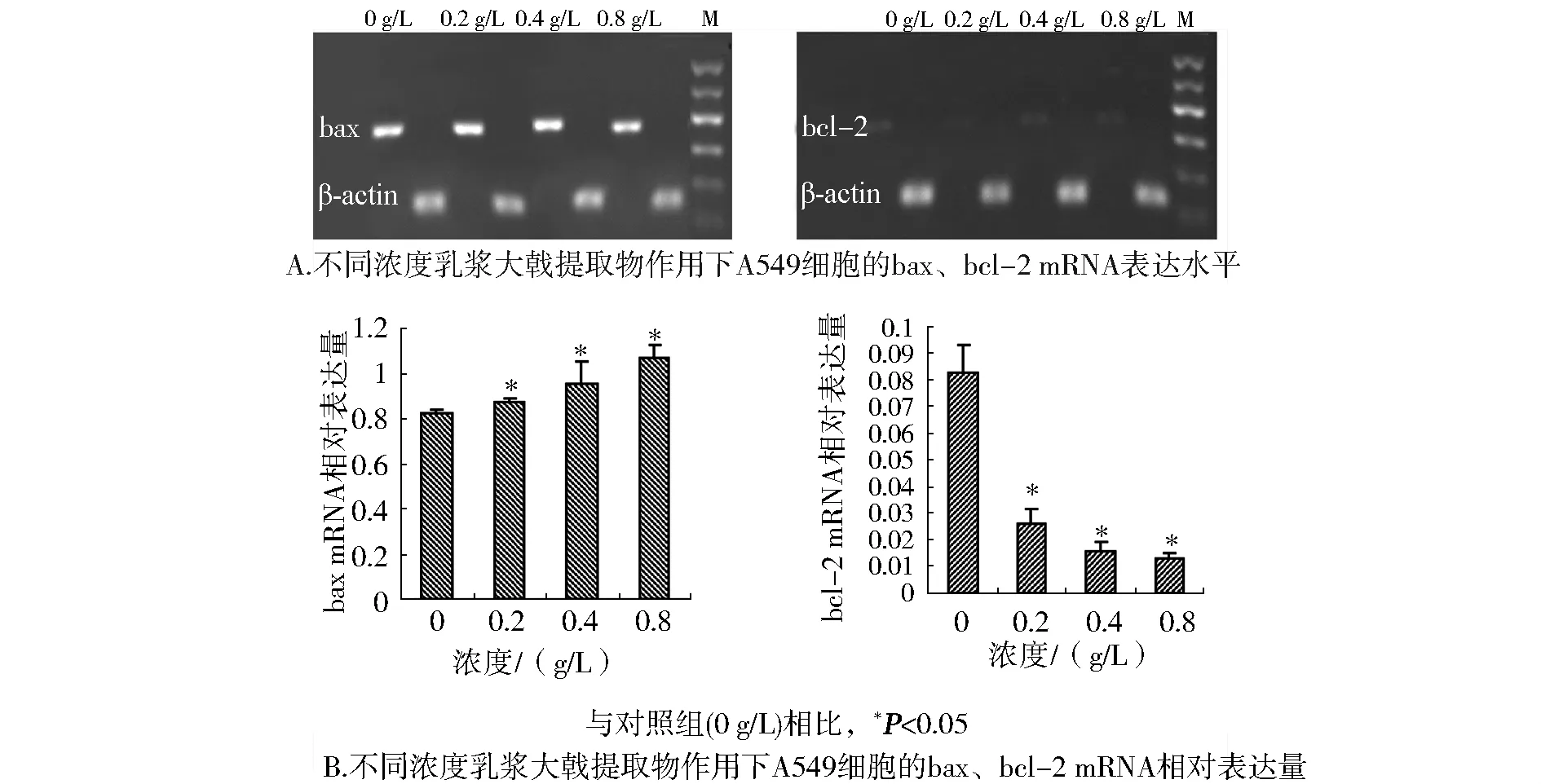
图4 乳浆大戟提取物对A549细胞的bax、bcl-2 mRNA表达水平的影响Figure 4 Effect of extracts of Euphorbia esula on mRNA expression of bax and bcl-2 in A549 cells by RT-PCR
3 讨论
我国的中草药资源丰富,而且中草药具有有效成分多、结构多样、抗癌谱广、副作用小、开发成本低等特点,日益受到国内外医药界的关注[7-9]。进入新世纪以来,在回归大自然的观念和医疗模式转换的影响下,对天然药物的探索与研究更加受到青睐,从天然产物中寻找保健预防和治疗疾病的有效成分已经成了国际上的大潮流。有不少学者认为,天然药物今后将会逐渐成为医药市场的主流[10-12]。
乳浆大戟(Euphorbia esula L.)是一种并不多见的植物,根据中国植物志[13],乳浆大戟又称猫眼草(中国高等植物图鉴),乳浆草(北京植物志),华北大戟(秦岭植物志),新疆大戟(中国沙漠植物志),太鲁阁大戟(台湾植物志),岷县大戟(云南植物研究),宽叶乳浆大戟(东北草本植物志),东北大戟,松叶乳汁大戟等。乳浆大戟为多年生草本,是国产大戟属植物中分布最广、变异幅度最大的种之一,分布于全国大部分地区,除海南、贵州、云南和西藏外。乳浆大戟全草入药,具拔毒止痒之效。
我们采集乳浆大戟的地上全草,提取水溶性组分,经除菌过滤后,用人肺癌细胞A549作抑制细胞增殖和活力的MTT实验、PI和Hoechst33528染色观察细胞形态学改变、JC-1染色检测细胞线粒体膜电位改变、并用流式细胞仪检测细胞凋亡率。结果显示,乳浆大戟提取物能抑制A549细胞的增殖,具有剂量效应关系,随着时间延长,抑制作用增强,最大抑制率为46.3%;显微镜下观察,乳浆大戟提取物处理后的A549细胞出现凋亡细胞的形态特征;JC-1染色显示细胞线粒体膜电位下降,流式细胞检测结果显示乳浆大戟提取物可以诱导A549细胞凋亡,凋亡率可达48.4%。
我们进一步做了乳浆大戟提取物诱导细胞凋亡作用机制的初步研究,RT-PCR结果显示,人肺癌A549细胞中bax表达上调、bcl-2表达下调,bax和bcl-2是细胞凋亡的重要调节因子,参与线粒体凋亡通路的调节。有研究表明,线粒体膜电位降低是细胞凋亡级联反应过程中最早发生的事件之一[14]。线粒体膜电位下降与线粒体膜通透性(MPT)改变有关,MPT允许水和溶质进入基质,引起线粒体的膨胀,内膜的膨胀导致外膜的破裂,从而使Cyt C、smac/Diabod、AIF等与细胞凋亡有关的重要因子释放到胞质中[l5],使细胞整体结构破坏、功能紊乱,发生凋亡。bcl-2能稳定细胞及线粒体膜,阻止细胞色素C释放进入胞质而抑制细胞凋亡,bax以二聚体或多聚体形式结合到线粒体膜上,改变膜的通透性,引起细胞色素C释放进入胞质,激活Caspase级联反应,导致细胞凋亡[16]。综上所述,乳浆大戟提取物可能是通过线粒体途径,上调bax的表达、下调bcl-2表达从而诱导A549细胞发生凋亡。
[1]Jemal A,Center MM,De Santis C,etal.Global patterns of cancer incidence and mortality rates and trends[J].Cancer Epidemiol Biomarkers Prev,2010,19:1893-1907.
[2]Parkin DM,Bray F,Ferlay J,etal.Global cancer statistics[J].CA Cancer JClin,2005,55(2):74-108.
[3]Siu D.Natural products and their role in cancer therapy[J].Med Oncol,2011,28(3):888-900.
[4]Harvey AL,Cree IA.High-throughput screening of natural products for cancer therapy[J].Planta Med,2010,76(11):1080-1086.
[5]王爱红,陈美霓,符兆英.诱导肿瘤细胞凋亡的天然药物及其作用机制[J].中医药学报,2011,39(1):125-128.
[6]高枫,符兆英.天然产物诱导肿瘤细胞凋亡作用机制研究进展[J].中华肿瘤防治杂志,2011,18(7):557-560.
[7]Cragg GM,Grothaus PG,Newman DJ.Impact of natural products on developing new anti-cancer agents[J].Chem Rev,2009,109(7):3012-3043.
[8]Fulda S.Modulation of apoptosis by natural products for cancer therapy[J].Planta Med,2010,76(11):1075-1079.
[9]Banerjee S,Wang Z,Mohammad M,etal.Efficacy of selected natural products as therapeutic agents against cancer[J].J Nat Prod,2008,71(3):492-496.
[10]Hauser AT,Jung M.Targeting epigenetic mechanisms:potential of natural products in cancer chemoprevention[J].Planta Med,2008,74(13):1593-1601.
[11]Mehta RG,Murillo G,Naithani R,etal.Cancer chemoprevention by natural products:how far have we come[J]?Pharm Res,2010,27(6):950-961.
[12]严永清.中药现代化研究的思路与方法[M].北京:化学工业出版社,2006:1-20,864.
[13]中国科学院中国植物志编辑委员会.中国植物志(第44卷,第3分册)[M].北京:科学出版社,2006:125-126.
[14]Argaud L,Gateau-Roesch O,Chalabreysse L,etal.Preconditioning delays Ca2+-induced mitochondrial permeability transition[J].Cardiovasc Res,2004,61(1):115-122.
[15]Halestrap AP.Calcium,mitochondria and reperfusion injury:a pore way to die[J].Biochem Soc Trans,2006,34(Pt2):232-237.
[16]Carrido C,Galluzzi L,Brunet M,etal.Mechanisms of cytochrome Crelease from mitochondria[J].Cell Death Differ,2006,13(9):1423-1433.
