生物基尼龙聚丁内酰胺单体γ-氨基丁酸的纯化工艺研究
2014-11-05赵鹤飞夏泉鸣邱勇隽王耀松蒋丽华赵黎明
赵鹤飞, 夏泉鸣, 邱勇隽, 王耀松, 蒋丽华, 赵黎明
华东理工大学,生物反应器工程国家重点实验室;发酵工业分离提取技术研发中心,上海 200237
γ-氨基丁酸 (aminobutyric acid,GABA)是在自然界广泛分布的非蛋白质氨基酸,分子质量103.1 Da,熔点 203℃[1]。作为一种活性氨基酸,主要存在于动物的脑、脊髓和肝脏等器官中,具有降血压、改善脑部血液循环、安神、健肾和健肝等生理活性,作为一种新资源食品,其研究开发日益受到人们的重视[2~5]。
GABA的生产主要有化学合成法、植物富集法和微生物合成法[6]。化学合成的GABA有原料残留,因此安全性差,不能添加到食品中;植物中GABA含量低,富集提取成本较高;微生物合成GABA安全性高、生产成本低且对环境友好,因而更具开发价值。
在GABA的生产工艺研究方面,已有膜分离及离子交换分离技术用于提取纯化GABA的报道。王文等[2]运用超滤和稀释过滤相结合的方法,在去除大分子的同时,尽可能提高GABA的回收率。用截留分子量为50 000 Da的PES膜组件进行试验,研究了各操作参数的影响,得到温度低于 40℃、压差 0.2 MPa、循环流速 0.5 m/s和pH 5的优化参数。因为超滤后GABA的回收率较低,所以采用了稀释过滤以提高回收率。在两次间歇式稀释过滤后,GABA的回收率由原来的50%提高到将近95%,达到较好的分离效果。黄怀生等[7]研究了采用732阳离子交换树脂分离纯化Gabaron茶中GABA的工艺,最佳条件为:上样液pH 3左右,吸附流速控制在3 mL/min左右,洗脱液pH在8~9。
GABA能够以谷氨酸为底物,经微生物谷氨酸脱羧酶催化脱羧生成[8],目前,从以谷氨酸为底物的发酵液中提取γ-氨基丁酸的膜分离及离子交换分离工艺,国内外文献未见报道。本文研究了膜过滤联合离子交换吸附和洗脱的工艺,并且使用活性炭进行脱色,为从谷氨酸发酵液提取GABA技术的大规模工业化应用提供基础。
1 材料与方法
1.1 试验材料
实验室自制GABA发酵液:GABA含量16.8 g/L、谷氨酸含量 6.8 g/L、pH 4.83、折光固含量5%、电导率17 320 us/cm;分析纯试剂购自中国国药集团。
1.2 主要仪器和耗材
活性炭A和活性炭B由江苏竹溪活性炭有限公司提供;离子交换柱,装填500 mL强酸型阳离子交换树脂,BT-100D数显蠕动泵,均购自上海沪西分析仪器厂有限公司;Delta320 pH计、PL2002电子天枰,购自Mettler-Toledo公司;UNICO2000分光光度计和配套比色皿,购自尤尼柯(上海)制造有限公司;WZS-I阿贝折光仪,购自上海光学仪器厂;分析滤纸购自中国国药集团;QY-021-a专有强酸型阳离子交换树脂,由上海齐豫生物科技有限公司提供。
1.3 工艺流程
从以谷氨酸为底物的发酵液中分离提取γ-氨基丁酸的工艺流程如图1所示。
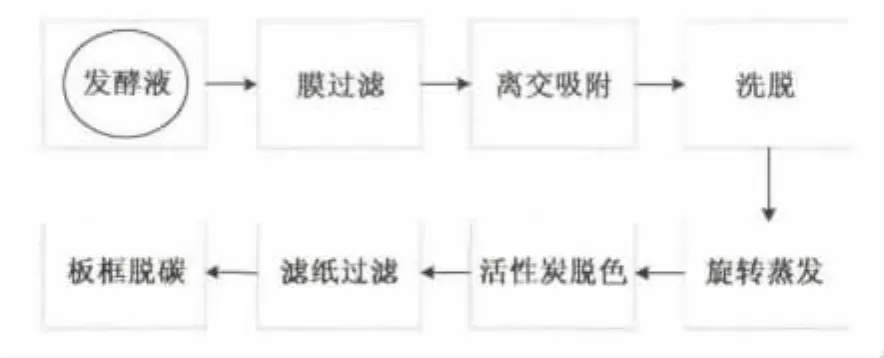
图1 从以谷氨酸为底物的发酵液中提取GABA工艺流程图 Fig.1 Flow chart of extracting GABA from fermentation broth with glutamic acid as substrate.
1.3.1 膜过滤 采用有机管式微滤膜,有效膜孔径200 nm,膜面积 0.5 m2,初始料液体积为366 L,浓缩10倍后分两次加30 L渗滤[9]纯水,浓缩至液体体积为11 L时停止,此时,浓缩倍数为33.3倍(渗滤纯水体积不计算在内)。初始跨膜压差设定在0.85 bar,当膜通量衰减时,提高到0.9 bar。温度通过常温冷却水控制在38℃。膜通量及收率采用如下公式计算[10,11]:
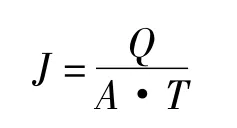
式中,J为膜通量(L/m2·h);Q为T时间内收集膜过滤液总量(L);A为膜有效面积(m2);T为膜过滤时间(h)。

1.3.2 离子交换吸附 在离子交换柱中填充500 mL的Na+型QY-021-a强酸型阳离子交换树脂,经1 mol/L盐酸转型为H+型后去离子水冲洗待用。然后将料液以2 BV/h的流速流经层析柱,用恒流泵调解控制流速,每半小时收集一次样品,滴定法检测H+浓度。每隔一段时间取即时样品检测GABA含量。吸附的终点为料液经树脂流出液中H+含量降低并达到稳定时,此时树脂吸附GABA达到饱和,停止进料。绘制床层体积倍数-流出液H+浓度图,即吸附曲线。由于测定pH比测定GABA含量更加快速,因此在离子交换吸附过程中同时检测样品的pH,考察pH是否可以用于生产实际的指导参数。
1.3.3 洗脱过程 先用25℃去离子水洗涤达到吸附饱和的树脂,去除色谱柱内的料液,以2 BV/h流速洗涤0.5 h左右即可。用0.42 mol/L氨水以0.5 BV/h的流速洗脱,用恒流泵控制流速,每小时收集一次样品。每隔一段时间取即时样品检测 GABA含量,滴定法检测氨水浓度(OH-浓度)。洗脱的终点为料液经树脂流出液中所含OH-浓度升高并达到稳定时。绘制床层体积倍数-流出液OH-离子浓度图,即洗脱曲线。由于测定pH比测定GABA含量更加快速,因此在洗脱过程中同时检测样品的pH,考察pH是否可以作为指导参数用于实际生产。
1.4 测定方法
1.4.1 高效液相色谱法测定GABA ①样品预处理。0.1 mol/L的盐酸:取4.2 mL浓盐酸用去离子水定容到500 mL;异硫氰酸苯酯溶液:取120 μL异硫氰酸苯酯用乙腈定容到10 mL;三乙胺溶液:取1.39 mL的三乙胺用乙腈定容到10 mL。流动相为乙酸钠溶液:取8.2 g无水乙酸钠用超纯水定容到1 000 mL,再加入60 μL的乙酸。②样品衍生化。取 100 μL样品液,用0.1 mol/L的盐酸定容到10 mL,在5 mL或者是7 mL的塑料离心管中分别加入500 μL稀释后的样品液,250 μL 的异硫氰酸苯酯溶液,250 μL 三乙胺溶液,震荡混匀,放入柱温箱中恒温1 h。1 h后再加入1 mL正己烷,震荡混匀,放入柱温箱中10 min。10 min后,取下清液,过滤膜,进样。进样体积为5 μL。③标样衍生化。取约20 mg GABA标样,用0.1 mol/L的盐酸定容到10 mL。之后的步骤与样品衍生化相同。④HPLC色谱条件:色谱柱采用岛津 C18色谱柱(4.6 mm×250 mm,3 um);柱温 40℃;流速 1 mL/min;检测波长254 nm。采用表1所示的梯度洗脱程序,其中A相为乙腈,B相为乙酸钠溶液。该洗脱程序执行完毕之后再用纯乙腈冲洗0.5 h。谷氨酸出峰在5~8 min,GABA出峰在15~18 min。
1.4.2 色值测定和脱色率的计算[12]将待测GABA液调节至pH 7.0±0.1,分别测滤液的固形物含量和在420 nm处的吸光值色值,色值计算公式如下:
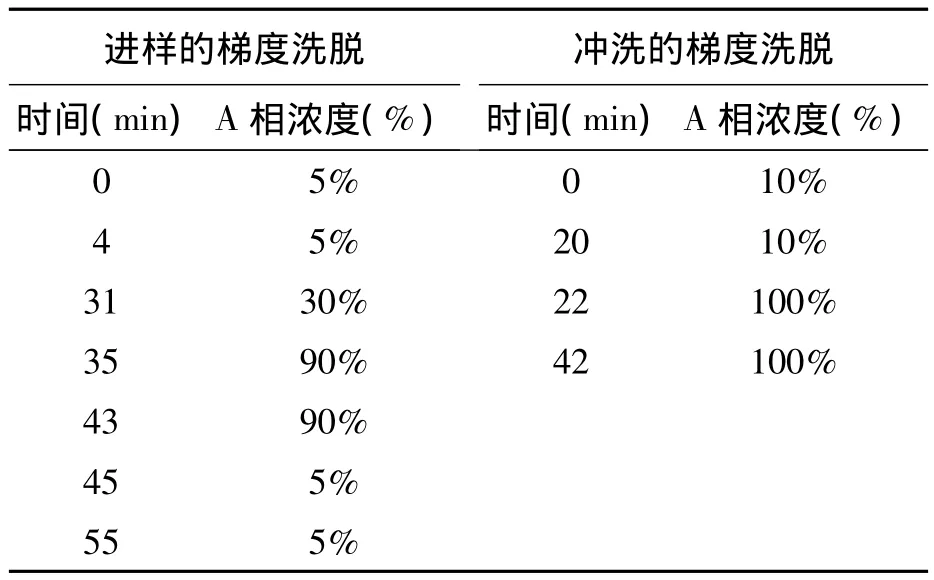
表1 色谱洗脱程序 Table 1 Chromatographic elution program.
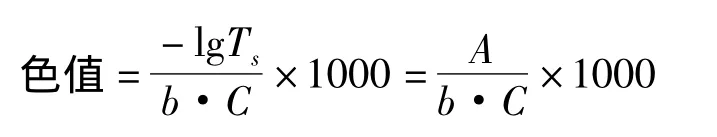
式中,Ts为糖液的透光率;A为样品的吸光度;b为色皿的厚度(cm);C为样品浓度(g/mL)。

1.4.3 固形物含量测定[12]采用阿贝折光仪测定。
2 结果与分析
2.1 有机管式膜过滤
发酵液中含有的菌体和蛋白会降低离子交换过程的树脂的吸附容量、增加漂洗水用量和减少树脂反复交换次数,甚至直接损害树脂,因此工业上一般采用超滤、微滤或者离心机澄清过滤。本研究采用膜过滤方法澄清过滤,起到离子交换预处理的作用。
膜分离技术是在常温下以膜两侧的压力差为动力实现分离纯化的一项分离技术。由于其分离时不发生相变化,适用于热敏性物质的分离,杂质去除范围非常广泛。其利用压力作为膜分离的推动力,因此分离装置非常简单,容易操作。管式超滤膜过滤酶解液,可以去除菌体和大分子杂质,使滤过液澄清透明。如图2所示,初始大跨膜压差为0.85 bar,膜通量为234 L/m2·h,随着过滤的进行,膜通量在约1.6 h衰减为155 L/m2·h,此时提高跨膜压差到0.9 bar,膜通量在2~4 h小时内稳定在约 L/m2·h,而后衰减。平均膜通量为128 L/m2·h,浓缩倍数为33.3倍,满足工业化运行的要求。经取样检测膜透过液样品,浓缩液样品计算得出GABA收率为97.68%,微滤膜以及膜表面污染物上无GABA截留和吸附截留,透过液澄清透明,呈淡黄色,说明该膜可用于工业化生产应用。
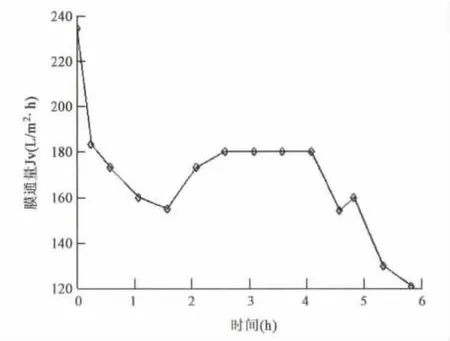
图2 膜通量随时间的变化 Fig.2 Flux changes with time.
2.2 离子交换
2.2.1 吸附过程 如图3所示,随着流出液pH的升高,流出液H+浓度也提高,GABA的吸附也由4 BV以内时的完全吸附变为逐渐穿出到饱和,可用pH作为树脂吸附过程的终点判断参数,有利于实际工业化时的过程控制。开始时柱内充满水,流出液起始pH为5左右是由于水本身的pH为5~6。冲水910 mL,电导降为711 us/cm;冲水1 500 mL,电导降为259 us/cm。经过计算得:树脂的吸附量为112.9 g(GABA)/L(树脂),该数据对于工业放大计算树脂用量有重要作用。以实际生产计划处理酶解液4 m3/d,假设发酵液中GABA 浓度为14.1 g/L,总处理 GABA 量56.4 kg,单柱需要QY-021-a树脂500 L(湿视体积)。实际生产中可进一步扩大设计余量,并且串联使用2~3个柱子。
2.2.2 洗脱过程 如图4所示洗脱过程产生一个洗脱峰,既GABA浓度先增大后减小,6 BV后GABA浓度显著降低,因此可以收集5 BV之内的料液,脱出氨水后获得GABA浓缩液。OH-浓度与GABA浓度呈此消彼长的关系,说明在柱内两者发生了交换。
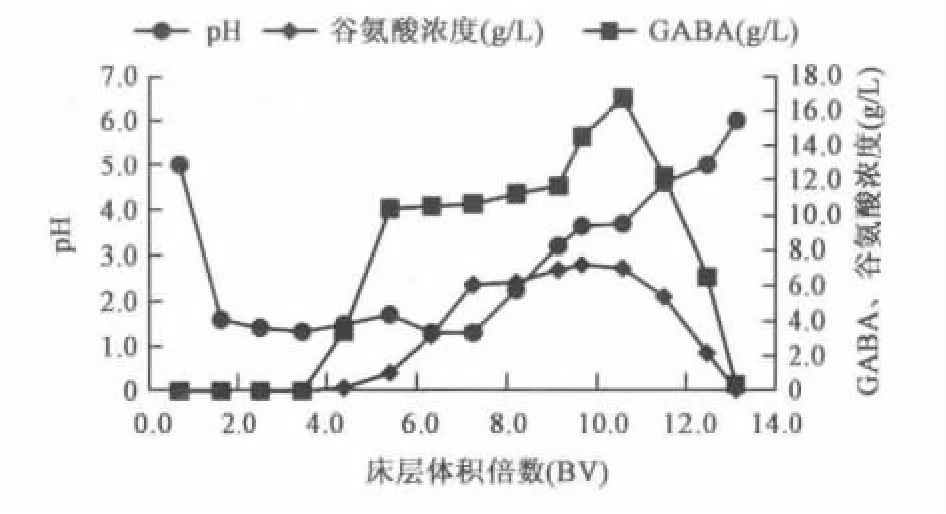
图3 膜过滤液吸附过程 Fig.3 Adsorption process of permeate.
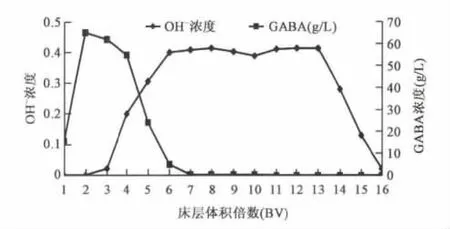
图4 洗脱过程 Fig.4 Desorption process.
由图3数据积分可得上样量,折算为GABA纯品81.9 g,吸附量为60.6 g,两者之差为不完全吸附过程中流过交换柱的GABA量,可以经过下一柱的串联得到完全的吸附,单柱收率仅计算吸附量即可。因此,以GABA吸附量60.6 g,5 BV洗脱GABA量为55.68 g计算,吸附-洗脱过程的收率为92.8%。洗脱液经过旋蒸去除氨水后,浓度为8%。如果收集更多的BV数,可以进一步增加收率。通过优选树脂和对树脂柱结构进行优化也可以进一步增大离子交换步骤的收率。
2.3 离子交换树脂再生
如图5所示,采用浓度为6%的工业盐酸,流过5 BV后,流出液盐酸浓度与流入盐酸浓度之比为1(既归一化浓度为1),说明树脂完全再生,2.5 BV后的盐酸可以作为套用酸收集再次使用,以节省盐酸用量。
2.4 活性炭脱色
活性炭添加量为15%(碳对固形物含量之比),脱色温度为65℃,脱色时间40 min,搅拌。小试中加5%料液体积的冲洗水洗出滤饼内残存料液,确保收率。
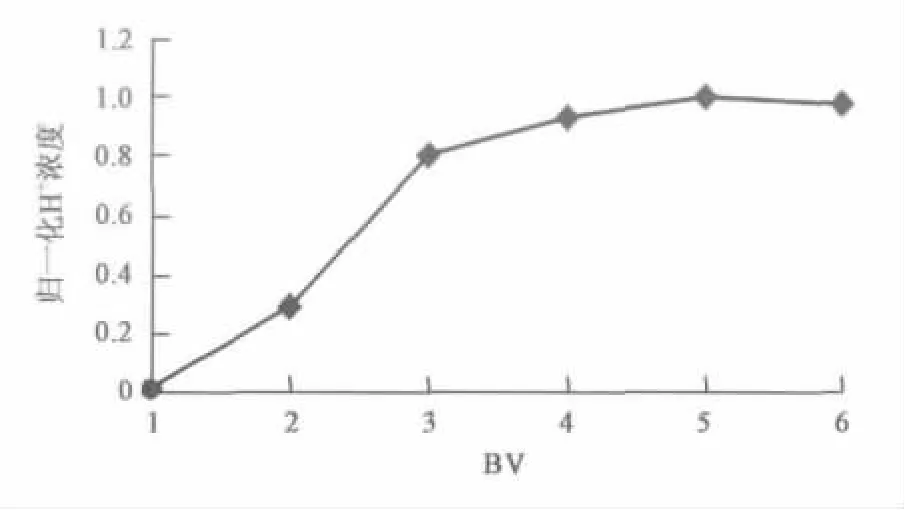
图5 树脂再生曲线 Fig.5 Regeneration carve of ion-exchange resin.
如表2所示,碳B的脱色率为94.2%,GABA收率为99.2%,脱色率和收率均较碳 A高,且GABA损失很小,仅为0.8%,因此选择碳B作为实际使用的脱色活性炭。
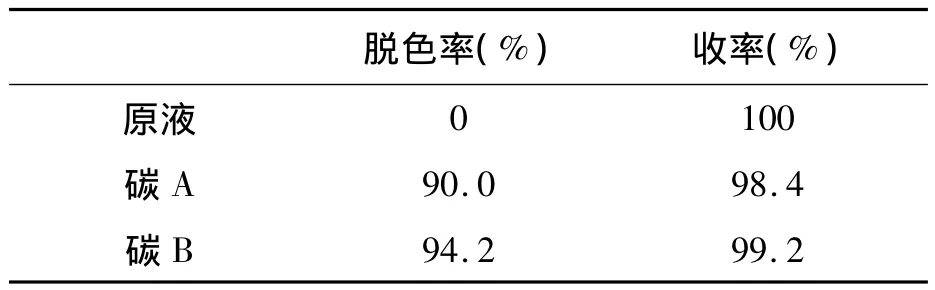
表2 不同活性炭的脱色率和收率 Table 2 Decolorization rate and yield of different activated carbon.

图6 活性炭脱色前(B)后(A)对比 Fig.6 Comparison between before(B)and after(A)active carbon decolorization.
3 讨论
采用有机管式膜过滤,平均膜通量为128 L/m2·h,浓缩倍数为33.3倍,满足工业化运行要求。经取样检测膜透过液样品,浓缩液样品计算GABA收率为97.7%,微滤膜以及膜表面污染物上无GABA截留和吸附截留,透过液澄清透明,呈淡黄色,说明该膜可用于工业化生产应用。
采用QY-021-a强酸型阳离子交换树脂进行吸附-洗脱操作,经5 BV洗脱后计算收率,吸附-洗脱过程的收率为92.8%。洗脱液经过旋蒸去除氨水后,浓度为8%。如果收集更多的BV数,可以进一步增加收率。今后研究中,有待进一步通过优选树脂和对树脂柱结构进行优化,进一步增大离子交换步骤的收率。
碳B的脱色率为 94.2%,GABA收率为99.2%,因此选择碳B作为实际使用的脱色活性炭。
本研究所采用膜过滤和离子交换联合的工艺总收率达到85%,该工艺具有很好的工业化应用价值和前景。
[1]梁恒字,邓立康,林海龙,等.新资源食品 γ-氨基丁酸(GABA)的研究进展[J].食品研究与开发,2013,34(15):119-123.
[2]王文,冯骉.超滤技术在GABA发酵液分离纯化过程中的应用[J].江苏大学学报(自然科学版),2005,26(1):5 -8.
[3]Gasbarri A,Pompili A.3-The Role of GABA in Memory Processes[A].In:Meneses A(ed.).Identification of Neural Markers Accompanying Memory[M].San Diego:Elsevier Inc.,2014,47 -62.
[4]Takeshima K,Yamatsu A,Yamashita Y,et al..Subchronic toxicity evaluation of γ-aminobutyric acid(GABA)in rats[J].Food Chem.Toxico.,2014,(68):128 -134.
[5]Wu C,Huang Y,Lai X,et al..Study on quality components and sleep-promoting effect of GABA Maoyecha tea[J].J.Func.Foods,2014,(7):180 -190.
[6]杨帆.微生物转化法产γ-氨基丁酸[D].江苏无锡:江南大学,硕士学位论文,2008.
[7]黄怀生,黄亚辉,郑红发.732阳离子交换树脂分离纯化Gabaron茶中γ-氨基丁酸的研究[J].茶叶通讯,2007,34(3):4-6.
[8]高远,沙坤,张泽俊.富含γ-氨基丁酸发芽粟米生产工艺优化[J].粮食与油脂,2013,26(12):19-21.
[9]赵鹤飞,杨瑞金,赵伟,等.秸秆低聚木糖溶液纳滤分离特性和渗滤工艺[J].农业工程学报,2009,25(4):253-259.
[10] Zhao L,Zhao H,Nguyen P,et al..Separation performance of multi-components solution by membrane technology in continual diafiltration mode[J].Desalin.,2013,322:113 -120.
[11]赵黎明,刘少伟,申雅维.膜分离技术在食品发酵工业中的应用[M].北京:中国纺织出版社,2011.
[12]蒋琦霞,杨瑞金,孙中国,等.低聚木糖液脱色工艺研究[J].食品工业科技,2008,29(3):228-231.
