嗜热β-甘露聚糖酶的研究进展
2014-11-05王彩虹牛灿芳罗会颖杨培龙
王彩虹, 牛灿芳, 罗会颖, 杨培龙, 姚 斌
农业部饲料生物技术重点实验室,中国农业科学院饲料研究所,北京 100081
半纤维素是目前世界上存在的第二大丰富的杂聚合物,通常与纤维素和木质素一起存在于植物细胞壁中[1,2]。甘露聚糖和木聚糖一起构成了半纤维素的主要成分[3,4]。完全消化甘露聚糖需要几种酶的协同作用,包括β-1,4-甘露聚糖酶、β-甘露糖苷酶、β-葡萄糖苷酶和 α-半乳糖苷酶等。
β-甘露聚糖酶是一类能水解含甘露糖的多糖水解酶的总称,根据酶作用底物特异性和作用特点可以分为外切β-甘露聚糖酶和内切β-甘露聚糖酶两种类型[5]。β-甘露聚糖酶属于半纤维素酶类,现已被广泛应用于饲料、造纸、洗涤剂、食品和石油开采等行业,以及尚未完全开发的生物质能源等领域,例如在乙醇生产过程中,一系列的酶类包括纤维素酶类、木聚糖酶和甘露聚糖酶等一起作用可以有效地将木质纤维素类物质水解为糖类[6]。大多数工业应用领域需要在高温环境中进行[7],为了满足工业应用的需求,寻找与改造能在高温环境中起催化作用的嗜热酶是一个急需解决的问题,因此,对嗜热β-甘露聚糖酶进行结构和功能的研究具有很高的理论价值和实际意义[8]。
1 β-甘露聚糖酶
1.1 β-甘露聚糖酶的来源
β-甘露聚糖酶的来源非常广泛,包括动植物和微生物。其中动物来源主要是低等动物(如蜗牛和海洋软体动物等)的肠道分泌液,哺乳动物体内一般不含此酶。Yamaura等[9]从海螺和一种海洋软体动物中纯化出了内切β-甘露聚糖酶;Xu等[10]从软体动物贻贝中也分离纯化得到了β-甘露聚糖酶。许多植物(如芦笋、咖啡、胡萝卜、魔芋、四棱豆、长角豆、咖啡豆和瓜儿豆等)萌发的种子以及番茄果实和种子中都含有甘露聚糖酶[11]。而微生物是甘露聚糖酶的最主要来源,包括细菌、真菌和放线菌等。截至目前,研究较多的是细菌类的芽胞杆菌、枯草杆菌和假单胞菌,真菌类的曲霉、里氏木霉,以及放线菌类的链霉菌等[12]。微生物来源的β-甘露聚糖酶优点很多,包括酶活性高、提取方便、生产成本低、pH和温度作用范围广以及底物专一性较高等。因此,微生物来源的β-甘露聚糖酶已成为工业用酶的主要来源和近年来的研究热点。尤其极端微生物生长的特殊条件与工业环境很相近,随着对嗜热酶反应机理和分子生物学研究的逐步深入,开发嗜热酶产品具有广阔的前景[13]。
1.2 β-甘露聚糖酶的分类
β-甘露聚糖酶根据最适pH的不同可分为酸性β-甘露聚糖酶、中性β-甘露聚糖酶和碱性β-甘露聚糖酶;根据最适温度的不同,可分为嗜热β-甘露聚糖酶、中温β-甘露聚糖酶和低温β-甘露聚糖酶。嗜热甘露聚糖酶常用的获取途径包括:从嗜热微生物中直接分离获得,从常规生物来源中获得,或通过蛋白质工程、基因改造的方法获得。
糖苷水解酶由催化模块、非催化的碳水化合物结合模块以及linker区和其他一些辅助模块组成[14]。根据催化域氨基酸序列及结构特征,糖苷水解酶被划分为133个家族。β-甘露聚糖酶属于糖苷水解酶(GH)5、26或113家族。截至目前(2014年8月),公共数据库中(Genbank和 http://www.cazy.org/)已经报道的β-甘露聚糖酶序列共有232个,包括GH5家族126个(其中细菌来源的56个,真菌来源的70个),GH26家族104个(其中细菌来源的88个,真菌来源的9个,另有7个未进行分类),GH113家族目前报道的只有2个(均来源于细菌)。其中有22个β-甘露聚糖酶开展了蛋白质晶体结构解析研究,包括GH5家族14个(其中细菌来源的8个,真菌来源的有6个),GH26家族7个(其中细菌来源的5个,真菌来源的2个)及GH113家族1个(来源于细菌)。根据序列的相似性,GH5甘露聚糖酶又被分为三个亚家族,包括GH5-7、GH5-8和GH5-10[15]。序列相似性在25%以上的甘露聚糖酶归为同一个亚家族,其中细菌来源的GH5甘露聚糖酶多属于GH5-8亚家族,真菌来源的GH5甘露聚糖酶多属于GH5-7亚家族。尽管已知GH5和GH26在亲核基团、供体质子和折叠方式上均相似,但是它们序列相似性不高。甘露聚糖酶氨基酸序列的保守性在不同类生物个体及不同家族酶蛋白之间有较大差别。
1.3 β-甘露聚糖酶的作用方式和水解产物
β-甘露聚糖酶属于典型的(β/α)8桶状结构,催化残基分别位于第4和第7 β折叠片上,且至少有4个残基与底物结合位点有关[16]。不同酶中碳水化合物结合模块共发现38 674个,其分类共分布在69个家族和215个未分类的碳水化合物结合模块(carbohydrate-binding module,CBM)家族。
根据构成,可以将催化底物甘露聚糖分为四类:均一甘露聚糖(β-1,4-D-甘露糖构成的主链)、葡甘露聚糖(β-1,4-D-甘露糖和 β-1,4-D-葡萄糖构成的主链)、半乳甘露聚糖(带有半乳糖侧链的β-1,4-D-甘露糖)和半乳葡甘露聚糖(带有半乳糖侧链的 β-1,4-D-甘露糖和 β-1,4-D-葡萄糖构成的主链)[17]。这些多糖均呈线状的或分枝的多糖苷链。甘露聚糖存在于自然界中的许多植物中,半乳糖甘露聚糖大多存在于长角豆和瓜儿豆的胚乳中,而葡萄糖甘露聚糖大多存在于魔芋球茎中。不同来源的甘露聚糖有着不同的构成,它们的分子量以及主侧链的组成均不相同(见表1)。
β-1,4-甘露聚糖酶的活性受到侧链以及主链上D-葡萄糖的含量的影响。α-半乳糖残基和葡萄糖残基在主链中的位置、含量及酯酞化的程度,底物本身的物理状态(例如溶液的黏度和底物状态)也会影响不同来源的β-甘露聚糖酶的链切割方式和水解程度。例如结晶态的甘露聚糖就不易被酶降解[19,20],朱劼等[20]在酸性 β-甘露聚糖酶的固态发酵工艺研究中发现水与固料的比例为1.2∶1时要比0.8∶1时酶活高出1.6倍。有学者研究甘露聚糖酶降解魔芋胶或槐豆胶时,作用于多糖链非还原端的第3个或第4个糖分子,降解产物为 MG、GM、MM、GG、MMM、GGM、GMM、MGM、MMMM、GMMG、GMMM、GGMM 和 MMMMM[21]。虽然不同来源甘露聚糖酶的切割方式和水解程度不同,但主要产物都是低聚糖,很少产生或不产生单糖,如 Han等[22]发现 Man5A-TM1和 Man5ATM2分解多聚糖为聚合度大于3的低聚糖;Bacillus sp.MSJ-5来源的甘露聚糖酶水解多聚糖为二糖至六糖,以及非常少量的单糖[23]。
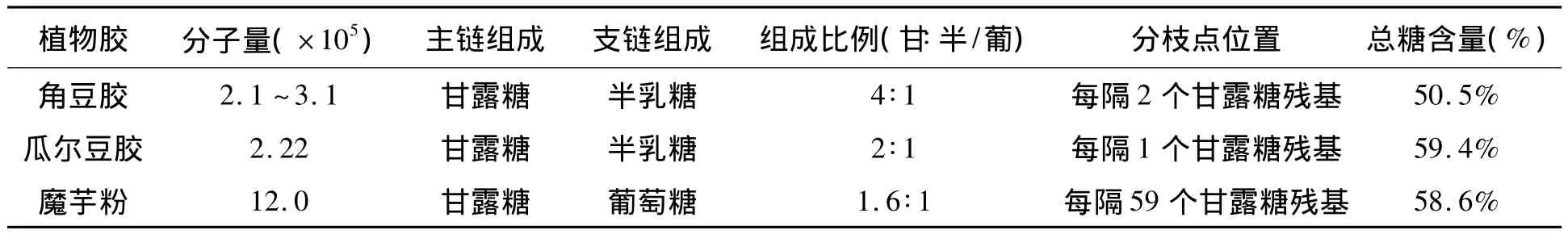
表1 不同来源的甘露聚糖的组成[18] Table 1 The composition of different sources of mannans.
2 嗜热β-甘露聚糖酶的研究进展
2.1 嗜热微生物与嗜热酶
能够在极端环境下生长的微生物称为极端微生物[24]。根据极端微生物的不同生活环境,极端微生物又被分为嗜盐菌、嗜热菌、嗜压菌和嗜酸菌等。极端微生物能够生产一些具有商业价值的工业产品,例如,酶、抗生素和激素等[25,26]。大多数微生物的生长温度范围为20~45℃之间,而将能够在45℃以上正常生长的微生物称为嗜热微生物[27]。其中嗜热细菌和嗜热古菌近来一直是人们研究的主要对象,而对嗜热真菌的关注则要少一些。
嗜热酶是一类酶催化最适反应温度为60℃以上的酶,主要是从嗜热微生物中获得[28]。从20世纪90年代开始,生物科技的发展和应用促进了人们对嗜热酶的探索研究[29]。研究发现,大多数嗜热微生物产生的嗜热酶在高温条件下具有良好的热稳定性,克服了中温酶(20~55℃)和低温酶(2~20℃)在工业应用中活性不稳定的现象。在工业应用中,嗜热酶较中温酶有非常明显的优势:第一,可降低酶制剂的成本。由于嗜热酶的稳定性好,使得该类酶即使在室温下进行分离提纯、包装运输也不失活,这就大大降低了生产成本。第二,可提高反应的催化效率。由于反应温度的提高,使得分子运动速度加快,继而酶催化能力大大加强。第三,能够降低反应能耗。由于嗜热酶具有较高的热稳定性,使得在生产中不需要复杂的冷却装置来进行温度的调节,这样在降低生产成本、减少能耗的同时,也减少了冷却过程对环境所造成的污染。第四,降低杂菌的污染。嗜热酶往往具有较高的反应温度(大于60℃),在此温度下,少有杂菌能够生存,继而减少了细菌代谢物对产物的污染。第五,对化学变性剂及相关金属离子具有较高的耐受力,因此扩大了酶反应的适用范围[30,31]。
嗜热酶较高的反应活性以及较好的稳定性,使得它在生物质能源、化学制品、食品、饲料、医药和石油开采等方面都有广泛的应用前景。但是目前从天然环境中获得的嗜热甘露聚糖酶较少[32~34],而且天然存在的嗜热甘露聚糖酶的热稳定性并不理想,影响了其在生产应用中的效果,如卢海强等[33]的Man5XZ7最适温度为80℃,但仅在50℃下保持稳定。再者,动物体内消化道为酸性环境,饲料用甘露聚糖酶应在强酸性条件下能发挥作用,但目前已获得的嗜热甘露聚糖酶的最适 pH 大多都在 4.0 ~ 5.0[33,34]。因此,为了更好地适应工业生产的需要,已开始尝试通过基因改造的方法提高甘露聚糖酶的热稳定性并改变其酸碱适应性。
2.2 嗜热β-甘露聚糖酶及资源筛选
嗜热β-1,4-甘露聚糖酶具有高比活,以及高温下高活性的特点[7,34],在很多工业领域都倍受关注。例如酶法水解半乳甘露聚糖被应用于石油和天然气行业来提高石油和天然气的开采率,由于石油开采需要80℃以上的极端温度,应用嗜热甘露聚糖酶非常适合[7]。到目前为止,已报道的嗜热甘露聚糖酶约有30个,其中,最适温度大于80℃的极端嗜热甘露聚糖酶有6个(见表2)。
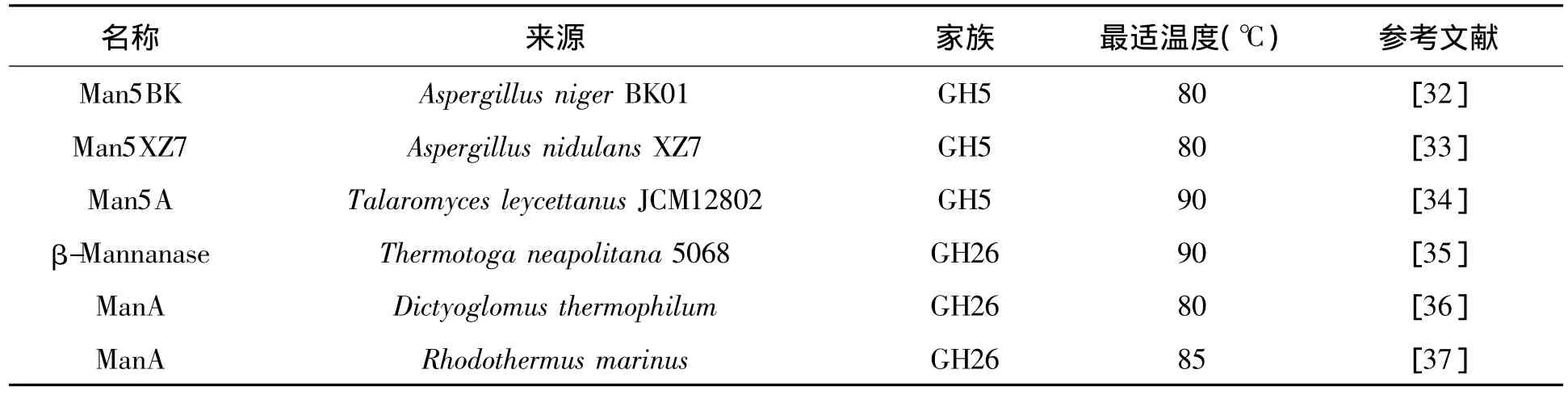
表2 最适温度大于80℃的极端嗜热甘露聚糖酶 Table 2 Extremely thermophilic mannanases with optimum temperature higher than 80℃.
之前大多数已经报道的嗜热甘露聚糖酶都属于26家族[35],但近几年从真菌中分离得到了属于5家族成员的极端嗜热甘露聚糖酶,包括来自Aspergillus niger BK01 的 ManBK[32],来自 Aspergillus nidulans XZ7 的 Man5XZ7[33]和来自 Talaromyces leycettanus JCM12802 的 Man5A[34]。
2.3 嗜热β-甘露聚糖酶的特性
在微生物来源的甘露聚糖酶中,已有90个GH5 β-甘露聚糖酶进行了酶学性质的测定,其中42个来源于细菌,48个来源于真菌。GH26中有41个进行了酶学性质的测定,其中34个来源于细菌,只有7个来源于真菌。而113家族中目前只有一个进行了酶学性质的测定,其来源于细菌。
目前已经报道的甘露聚糖酶的最适温度大多在50~60℃之间。而关于嗜热甘露聚糖酶的报道还较少。真菌来源的甘露聚糖酶最适温度最高的为 90℃,来源 于 Talaromyces leycettanus JCM12802[34],其次是来源于 A.nidulans XZ3 的Man5XZ3[38]和来源于 Aspergillus niger BK01 的ManBK[39],最适温度均为80℃。细菌甘露聚糖酶最适温度最高的为90℃,来源于Thermotoga neapolitana[35]。
2.4 甘露聚糖酶的嗜热性分子改良
影响甘露聚糖酶蛋白嗜热的结构因素有很多,包括氢键、盐桥和二硫键等。在 β-甘露聚糖酶嗜热改良方面,已经有多个报道,在β-甘露聚糖酶热稳定性的结构研究方面也已经取得了一定的进展[40]。目前,主要是通过对从自然界中获得的甘露聚糖酶进行理性设计,通过同源建模、分子对接、二级结构分析以及动力学模拟等手段对其进行分子改良从而获得嗜热的β-甘露聚糖酶。此外,也有文献报道糖基化修饰以及碳水化合物结合模块对甘露聚糖酶的热稳定性有影响[40]。
2.4.1 N-糖基化修饰 糖基化是在酶的控制下,蛋白质或脂质附加上糖类的过程。糖基化发生于内质网中。蛋白质经过糖基化作用之后,可形成糖蛋白。蛋白质糖基化可以根据糖苷链类型的不同分为四类,包括-O-糖苷键型(以丝氨酸、苏氨酸、羟赖氨酸和羟脯氨酸的羟基为连接点形成);-N-糖苷键型(以天冬酞胺的酚胺基、N末端氨基酸的α-氨基以及赖氨酸或精氨酸的ω-氨基为连接点形成);醋糖苷键型(以天冬氨酸或谷氨酸的游离羧基为连接点形成)以及以半胱氨酸为连接点的糖苷键。
目前已经有多篇文献报道N-糖基化对酶的热稳定性的促进作用。如谢春芳等[41]以来源于Armillariella tabescens的β-甘露聚糖酶 Man47为研究对象,利用计算化学对Man47进行理性设计,经过分子对接、二级结构分析和糖基化的可行性分析后,构建具有 EAS(enhanced aromatic sequence)序列的突变体G-123作为N-糖基化的突变位点以提高其热稳定性。王彩虹等[34]从Talaromyces leycettanus JCM12802中获得的Man5A,其糖基化程度高的蛋白Man5A1在70℃下处理1 h,酶活没有损失,而糖基化程度低的蛋白Man5A2只剩余了40%的酶活。Fonseca-Maldonado等[42]和 Wei等[43]也报道了类似的研究结果。研究显示,N-糖基化提高酶的热稳定性可能是由于N-糖基化减少了蛋白的不正确折叠从而提高了蛋白折叠的可逆性[44]。
2.4.2 碳水化合物结合模块对热稳定性的影响 糖苷水解酶中的碳水化合物结合模块(CBM)结构域可能会促进酶与底物的联系,从而促进酶的热稳定性。目前已经有很多文献报道CBM对甘露聚糖酶的热稳定性有促进作用。王彩虹等[34]从 Talaromyces leycettanus JCM12802 中获得的Man5A,在70℃处理1 h,Man5A可以维持几乎100%的活性,然而其去掉 CBM(ManACBM)后稳定性明显降低,ManA-CBM仅维持70%的活性。卢海强等[38]从Aspergillus nidulans XZ3中获得的Man5XZ3的热稳定性要明显优于去掉CBM 后的 Man5ΔCBM,Man5XZ3在60℃处理1 h能维持50%的酶活,Man5ΔCBM仅能维持30%左右。
3 展望
到目前为止,嗜热β-甘露聚糖酶的研究已经取得了很大的进展。首先,在嗜热β-甘露聚糖酶的基因资源挖掘方面,已经从嗜热微生物中发现了6个最适温度大于80℃的极端嗜热甘露聚糖酶,其中 Aspergillus niger BK01 来源的 ManBK[39]和TalaromycesleycettanusJCM12802来源的Man5A[34]的热稳定温度都能达到70℃。今后利用生物信息学分析、环境基因组或转录组功能基因的直接克隆等技术将大大加快嗜热β-甘露聚糖酶基因资源的获得。
很多β-甘露聚糖酶虽然极端嗜热,但是存在热稳定性差、不能在酸性环境发挥作用,以及表达量低等特点。因此在今后研究的重点将集中于以下几个方面。第一,通过生物信息学分析对嗜热甘露聚糖酶进行改造,以适应生产需求;第二,对影响外源嗜热甘露聚糖酶的转译、转运和分泌等相关的分子机制进行研究,构建基于受体菌株优化、基因优化、表达元件优化、目标基因定点整合与拷贝数控制技术等的高效生物反应器,以提高表达量。目前,嗜热甘露聚糖酶基因序列及其酶蛋白结构数据不断累积,新的具有嗜热特性天然酶也时有发现,计算机辅助酶分子模拟技术的发展使人们对嗜热β-甘露聚糖酶的嗜热机制及快速分子改良研究成为可能。
[1]Gilbert H J,Stålbrand H,Brumer H.How the walls come crumblingdown:Recentstructuralbiochemistry ofplant polysaccharide degradation[J].Curr.Opin.Plant.Biol.,2003,11(3):338-348.
[2]Shallom D,Shoham Y.Microbial hemicellulases[J].Curr.Opin.Microbiol.,2003,(6):219-228.
[3]Scheller H V,Ulvskov P.Hemicelluloses[J].Plant Biology,2010,61:263.
[4]Stålbrand H,Siika-ahoM,Tenkanen M.Purification and characterization of two β-mannanases from Trichoderma reesei[J].J.Biotechnol.,1993,29:229-242.
[5]张婕,赵敏.β-甘露聚糖酶的研究进展[J].黑龙江医药,2011,24:248-250.
[6]Várnai A,Huikko L,Pere J,et al..Synergistic action of xylanase and mannanase improves the total hydrolysis of softwood[J].Bioresour.Technol.,2011,102(19):9096-9104.
[7]Comfort D A,Chhabra S R,Conners S B,et al..Strategic biocatalysiswith hyperthermophilic enzymes[J]. Green Chem.,2004,6:459-465.
[8]Demirjian D C,Morís-Varas F,Cassidy C S.Enzymes from extremophiles[J].Curr.Opin.Chem.Biol.,2001,5:144-151.
[9]Yamaura I,Matsumoto T.Puri fi cation and some properties of endo-1,4-D-mannanase from a mud snail,Pomaceainsularus(de Ordigny)[J].Biosci.Biotech.Biochem.,1993,57:1316-1319.
[10] Xu B,Hägglund P,Stålbrand H.Endo-β-1,4-mannanases from blue mussel,Mytilus edulis:purification,characterization,and mode of action[J].J.Biotechnol.,2002,92:267-277.
[11] Marraccini P,Rogers J W,Allard C,et al..Molecular and biochemical characterization of endo-β-mannanases from germinating coffee(Coffea arabica)grains[J].Planta,2001,213:296-308.
[12]徐 扬,刘起丽,聂国兴,等.甘露聚糖酶的研究进展[J].河南农业科学,2011,40:3437.
[13]张云华.嗜碱芽孢杆菌N16-5碱性β-甘露聚糖酶的嗜碱机制研究[D].哈尔滨:东北农业大学,硕士学位论文,2004.
[14] Mizutani R,Wakamatsu A,Tanaka N,et al..Identification and characterization of novel genotoxic stress-inducible nuclear long noncoding RNAs in mammalian cells[J].PloS ONE,2012,7(4):e34949.
[15] Aspeborg H,Coutinho P M,Wang Y,et al..Evolution,substrate specificity and subfamily classification of glycoside hydrolase family 5(GH5)[J].BMC Evol.Biol.,2012,12:186.
[16] Chauhan P S,Puri N,Sharma P,et al..Mannanases:microbial sources,production,properties and potential biotechnological applications[J].Appl.Microbiol.Biotechnol.,2012,93:1817-1830.
[17] Mikkonen K S,Yadav M P,Cooke P,et al..Films from spruce galactoglucomannan blended with poly(vinyl alcohol),corn arabinoxylan,and konjac glucomannan[J].BioResources,2008,3(1):178-191.
[18]李剑芳,邬敏辰,夏文水.微生物β-甘露聚糖酶的研究进展[J]. 江苏食品与发酵,2005,(3):4-9.
[19]熊郃,干信.β-甘露聚糖酶产生菌 R10的产酶特性研究[J]. 工业微生物,2005,35:29-33.
[20]朱 劼,李剑芳,邬敏辰.酸性β-甘露聚糖酶的固态发酵工艺研究[J].西北农林科技大学学报:自然科学版,2005,33:139-143.
[21]许牡丹,杨伟东,许宝红,等.微生物β-甘露聚糖酶的制备与应用研究进展[J].动物医学进展,2006,27(9):31-34.
[22] Han Y,Dodd D,Hespen C W,et al..Comparative analyses of two thermophilic enzymes exhibiting both β-1,4 mannosidic and β-1,4 glucosidiccleavageactivitiesfrom Caldanaerobius polysaccharolyticus[J].J.Bacteriol.,2010,192:4111-4121.
[23] Zhang M,Chen X,Zhang Z,et al..Purification and functional characterization of endo-β-mannanase MAN5 and its application in oligosaccharide production from konjac flour[J].Appl.Microbiol.Biotechnol.,2009,83(5):865-873.
[24] Horikoshi K,Grant W D.Extremophiles:Microbial Life in Extreme Environments[M].New York:Wiley-Liss,1998.
[25] Kristjansson J K. Thermophilic organisms as sources of thermostable enzymes[J].Trends Biotechnol.,1989,12:349-353.
[26] Maheshwari R,Bharadwaj G,Bhat M K.Thermophilic fungi:Their physiology and enzymes[J].Microbiol.Mol.Biol.Rev.,2000,64(3):461-488.
[27] Cooney D G,Emerson R.Thermophilic Fungi:An Account of TheirBiology, Adivities and Classification[M]. San Francisco:W H Freeman& Co.,1964.
[28] van den Burg B.Extremophiles as a source for novel enzymes[J].Curr.Opin.Microbiol.,2003,6:213-218.
[29] Demirjian D C,Morís-Varas F,Cassidy C S.Enzymes from extremophiles[J].Curr.Opin.Chem.Biol.,2001,5(2):144-151.
[30] Adams M W,Kelly R M.Thermostability and thermoactivity of enzymes from hyperthermophilic archaea[J].Bioorg.Med.Chem.,1994,2(7):659-667.
[31] Danson M J,Hough D W,Russell R J, et al..Enzyme thermostability and thermoactivity[J].Protein Eng.,1996,9(8):629-630.
[32] Zhao W,Zheng J,Zhou H B.A thermotolerant and cold-active mannan endo-1,4-β-mannosidase from Aspergillus niger CBS513.88:Constitutive overexpression and high-density fermentation in Pichia pastoris[J].Bioresour.Technol.,2011,102:7538-7547.
[33] Lu H,Zhang H,Shi P,et al..A family 5 β-mannanase from the thermophilic fungus Thielavia arenaria XZ7 with typical thermophilic enzyme features[J]. Appl. Microbiol.Biotechnol.,2013,97:8121-8128.
[34] Wang C,Luo H,Niu C,et al..Biochemical characterization of a thermophilic β-mannanase from Talaromycesleycettanus JCM12802 with high specific activity[J].Appl.Microbiol.Biotechnol.,2014:1-12.
[35] Duffaud G D,McCutchen C M,Leduc P,et al..Purification and characterization of extremely thermostable beta-mannanase,beta-mannosidase, and alpha-galactosidase from the hyperthermophilic eubacterium Thermotoga neapolitana 5068[J].Appl.Environ.Microbiol.,1997,63:169-177.
[36] Gibbs M D,Reeves R A,Sunna A,et al..Sequencing and expression of a β-mannanase gene from the extreme thermophile Dictyoglomus thermophilum Rt46B.1,and characteristics of the recombinant enzyme[J].Curr.Microbiol.,1999,39:351-357.
[37] Politz O,Krah M,Thomsen K,et al..A highly thermostable endo-1,4-β-mannanase from the marine bacterium Rhodothermusmarinus[J].Appl.Microbiol.Biotechnol.,2000,53:715-721.
[38] Lu H,Luo H,Shi P,et al..A novel thermophilic endo-β-1,4-mannanase from XZ3:functional roles of carbohydrate-binding module and Thr/Ser-rich linker region[J].Appl.Microbiol.Biotechnol.,2014,98:2155-2163.
[39] Bien-Cuong D,Thi-Thu D,Berrin J G, et al..Cloning,expression in Pichia pastoris,and characterization ofa thermostableGH5 mannan endo-1,4-β-mannosidasefrom Aspergillus niger BK01[J].Microb.Cell Fact.,2009,8:59.
[40] Tanaka M,Umemoto Y,Okamura H,et al..Cloning and characterization of a β-1,4-mannanase 5C possessing a family 27 carbohydrate-binding module from a marine bacterium,Vibrio sp.strain MA-138[J].Biosci.Biotechnol.Biochem.,2009,73:109-116.
[41]谢春芳,黎玉凤,刘大岭,等.利用 N-糖基化修饰对β-甘露聚糖酶Man47的稳定性改造[J].中国生物工程杂志,2013,33:79-85.
[42] Fonseca-Maldonado R,VieiraD S,AlpontiJS, et al..Engineering the pattern of protein glycosylation modulates the thermostability of a GH11 xylanase[J].J.Biol.Chem.,2013,288:25522-25534.
[43] Wei W,Chen L,Zou G,et al..N-glycosylation affects the proper folding,enzymatic characteristics and production of a fungal β-glucosidase[J].Biotechnol.Bioeng.,2013,110:3075-3084.
[44] Qi F,Zhang W,Zhang F,et al..Deciphering the effect of the different N-glycosylation sites on the secretion,activity,and stability of cellobiohydrolase I from Trichodermareesei[J].Appl.Environ.Microbiol.,2014,80:3962-3971.
