转基因技术在能源植物育种中的应用
2014-11-05谭芙蓉代立春祝其丽王文国汤晓玉苏海锋胡启春何明雄
谭芙蓉, 代立春, 吴 波, 秦 晗, 祝其丽, 王文国, 汤晓玉, 潘 科,苏海锋, 胡启春,2, 何明雄,2*
1.农业部沼气科学研究所,生物质能技术研究中心,成都 610041;
2.农业部农村可再生能源开发与利用重点实验室,成都 610041
随着能源危机和石化燃料引起的环境污染的加剧,世界各国都在积极探求可以替代化石燃料的能源,生物质能源具有可再生性、低污染性、广泛分布性及资源丰富性,逐渐成为能源替代研究的热点,发展前景良好,未来有可能成为可再生能源的主导[1]。生物质能是蕴藏在生物质内的能量,直接或间接来源于绿色植物经光合作用转化的化学能,对生物质能的转化利用形式包括生物乙醇、生物制氢、生物柴油、生物质气化及液化燃料等。
能源植物是可直接开发的最有前景的生物质资源之一。我国幅员辽阔,水热资源分布多差异,能源植物资源种类丰富多样,但是我国对能源植物的开发和应用起步较晚,与西方发达国家相比还有相当大的差距。如果我国能加强生物能源的研究与开发,筛选出更多优质、高效的能源植物,并将其转化为气体或液体燃料,一方面可以弥补石化燃料的不足,缓解过分依赖大量进口石油的被动局面,实现我国能源安全战略;另一方面还能发挥其保持水土和改良土壤的作用,达到保护和建设生态环境的目的。进一步建立中国能源植物种质资源开发基地和生物燃油生产技术体系,对于培育和利用中国能源植物资源以及储备后备能源都具有十分重要的意义。本文从能源植物的概念及分类入手,概述了转基因技术在能源植物遗传改良中取得的进展及应用现状,为进一步利用该技术改良能源植物提供参考。
1 能源植物的概念及分类
能源植物是可再生能源开发的唯一资源对象,它通过光合作用固定二氧化碳和水,将太阳能以化学能形式储藏在植物中。广义的能源植物包括所有的陆地和海洋植物;狭义的能源植物指植物本身(不包括籽粒)含有油脂或石油类似物质的植物。能源植物可以直接燃烧产生热能,还可以转化成固态、液态和气态燃料。根据植物的光合途径分类,能源植物主要是C3和C4植物[2],目前还没有属于景天酸循环(crassulacean acid metabolism,CAM)类型的能源植物的报道。根据植物的生活周期,能源植物分为一年生(如甘薯、高粱、大豆和续随子等)、两年生(如甜菜,这类植物种类较少)和多年生植物三大类[2],其中多年生能源植物又分为草本(如柳枝稷、芒草和虉草等)和木本(杨树、柳树和麻疯树等)植物两类。根据化学成分组成及其利用分类,能源植物可以分为[2]:①糖料植物:该类植物富含可溶性糖,主要用于生产燃料乙醇,有甘蔗、甜高粱和甜菜等;②淀粉植物:该类植物富含淀粉,也主要用于生产燃料乙醇,主要包括小麦、玉米等禾谷类作物及甘薯、木薯和马铃薯等薯类作物;③油料植物:指富含油脂的高等植物,提取油脂后通过脂化过程形成脂肪酸甲酯或脂肪酸乙酯类物质,即生物柴油,如油菜、蓖麻和大豆等产油作物以及麻疯树、油棕榈、黄连木和文冠果等木本植物;④含油微藻植物:富含烃类或脂类物质的微藻也可用以生产生物柴油,由于含油微藻高效的生产能力,可在废弃地及其他没有农业利用价值的土地上,利用废水甚至高含盐量的水大规模培养,因而有很好的应用前景[3];⑤木质纤维素植物:该类植物富含木质纤维素,转化应用范围很广泛,用于生产固体颗粒燃料,或获得热能、电能、沼气及燃料乙醇等,如杨树、桉树、象草、柳枝稷和喜百草等。
2 转基因技术在能源植物育种中的应用
自然状态下的能源植物并不是最理想的生产物种,通过引进良种与当地植物杂交后筛选培育高效、高产的能源植物已经取得一定的进展,然而传统的育种手段已不能满足现今社会对能源植物的需求。近年来,随着基因克隆和转基因技术的不断完善,转基因技术在玉米、大豆和棉花等主要农作物上都得到了较好的应用。但由于转基因食品相关的商业应用仍受到严格限制,转基因技术在以食用为目的的作物上的研究和应用也面临阻碍,由此为能源植物的遗传改良提供了新的机遇。转基因技术虽然较常规育种技术复杂,但具有常规育种不可比拟的优点,它可以根据育种目标,打破生殖隔离,将供体生物中的目的基因整合到受体植物中,在基因水平上定向改造植物的遗传性状,从而形成转基因新品种或新种质,大大提高了育种的目的性和可操作性。因此,转基因技术可以作为培育高产、优质、高效新型能源植物新品种的有效途径。
2.1 提高能源植物的生物量
人类期望的能源植物是拥有较高的太阳能转化利用率、较快的光合速度和较高的干物质积累能力以及较快的生长速率。然而目前普通植物对太阳光的利用效率都比较低,不到4%。况且我国耕地有限,发展能源植物必须要保证粮食安全,要立足于“不与人争粮、不与粮争地”,尽可能选择边际土地来发展能源植物资源产业。与正常的耕地相比,在边际土地上种植相同的作物,产量具有很大的变动范围。因此,在边际土地上发展能源植物,更需要选择高光效、高生物量的能源植物。有研究表明,倘若能通过改良将植物的光能利用效率提高1%,世界上1/10的农田面积就足以提供目前人类使用的所有化石能源[4]。通过增加植物对光能的利用效率或捕获效率可以提高植物的总生物量。植物通过光合作用吸收二氧化碳受多种因素影响,包括光合作用机制、碳流量、光呼吸和光抑制作用及同化物分配和利用等。利用转基因技术来提高植物的生物量已有大量报道(见表 1),主要包括调控植物光合作用[5,6]、调控卡尔文循环中的碳流量[7,8]、操纵植物营养代谢过程中的基因[9~11]以及延迟或阻碍植物开花[12]等。
大部分植物在光合作用中同化二氧化碳的最初产物是三碳化合物3-磷酸甘油酸,被称为C3植物;而另一部分植物二氧化碳同化的最初产物是四碳化合物苹果酸或天门冬氨酸,被称作C4植物。目前多种C4植物光合作用途径中的一些关键酶,如丙酮酸磷酸双激酶(PPDK)、磷酸烯醇式丙酮酸羧化酶(PEPC)、及磷酸烯醇式丙酮酸羧激酶(PEPCK)以及无机碳转运蛋白和脱氧羧腐胺赖氨酸合酶(DHS)等的基因已被成功转入马铃薯、水稻、杨树和拟南芥等C3植物中,使相应转基因植物的光合能力及产量均不同程度地得到提高(见表1)。以上这些研究表明,利用转基因技术来操纵植物中许多基因的表达对植物产量有比较明显的影响,虽然这些研究成果未见有实际应用的例子,但是同样的策略可以应用到能源植物中,为培育新型高产能源植物提供了参考依据。

表1 利用转基因技术提高植物生物量的报道 Table 1 The reports of using transgenic technology to improve plant biomass.
2.2 应用于纤维素类能源植物的研究
利用木质纤维素类能源植物生产燃料乙醇在国内外已有大量研究,但所开发的技术始终未能在规模生产中推广应用,最根本的原因是目前的技术中仍然存在着一些尚未解决的关键问题,严重制约着植物纤维素燃料乙醇的生产[19~21]。首先是前期将木质纤维素物质降解为中间物质以及去除木质素的预处理过程成本过高;其次是纤维素水解复合酶的价格昂贵导致整个生产过程成本偏高[22]。与玉米淀粉生产乙醇相比,以上两个过程的花费使得纤维素乙醇的生产成本高2~3倍。随着转基因技术的发展,通过转基因技术来解决植物纤维燃料乙醇生产过程中遇到的瓶颈问题已有大量报道。
2.2.1 降低植物的木质素含量 降低木质纤维中的木质素含量、提高纤维素含量将有利于降低木质纤维的前处理成本。通过转基因技术改变木质素合成途径中不同基因的表达来降低木质素的含量、提高纤维素含量已有大量报道(见表2)。通过转基因技术对木质素生物合成调控的研究主要表现在两个方面[31]:①木质素合成总量的调节。主要涉及的酶类依次有苯丙氨酸解氨酶(PAL)、肉桂酸4-羟基化酶(C4H)、4-香豆酸辅酶A连接酶(4CL)、肉桂醇脱氢酶(CAD)和香豆酰辅酶A还原酶(CCR),这些酶活性的高低与木质素的总量具有密切的相关性;②木质素单体特异合成成分的调控。相关的酶类主要有咖啡酸-O-甲基转移酶(COMT)、咖啡酰辅酶A-O-甲基转移酶(CCoAOMT)和阿魏酸5羟基化酶(F5H),这些酶的表达对木质素单体的特异合成有较大的影响,决定了各种单体在木质素总量中的比例。
虽然通过调控木质素合成途径中关键酶的表达可以降低或是改变木质素的含量与成分,但是还要保证调控这些基因的表达不影响转基因植物的生长发育。此外,一些特定植物为了适应内外环境的需要,其细胞壁的木质素形成受到精细的时空调节[32~34]。因此,利用转基因技术减少木质素含量、改变其结构与成分的同时还需要对木质素合成途径的遗传调控开展更多基础性的研究,以避免对植物造成长期的伤害。
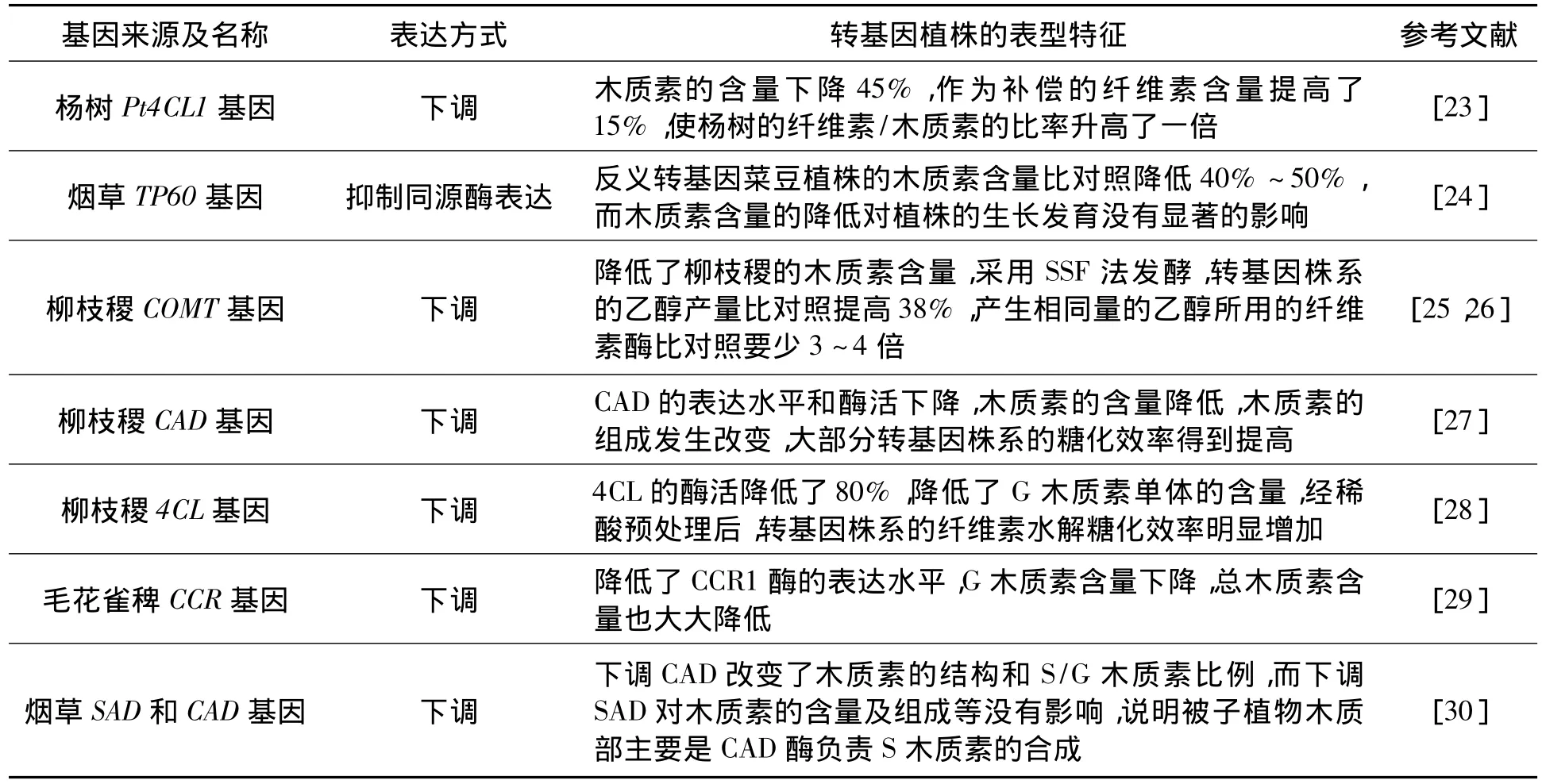
表2 利用转基因技术调控木质素合成途径中的相关酶的表达 Table 2 The expression of enzymes in lignin synthesis regulation pathway using transgenic technology.
2.2.2 在植物中过表达纤维素降解酶类 将纤维素降解为葡萄糖的过程需要内切葡聚糖酶、外切葡聚糖酶和β-葡萄糖苷酶三种酶共同作用。生产纤维素酶的方法一般采用微生物发酵法,但是由于这种方法工艺复杂,提纯过程费时费力,导致生产成本昂贵。如果能够利用转基因技术将纤维素酶直接在植物中表达,利用植物作为生物反应器产生降解纤维素的酶类,在木质纤维素降解过程中就不需要或可减少加入来源于微生物的酶,这样就可以大大降低燃料乙醇的生产成本[21,35,36]。目前,嗜酸纤维素分解菌(Acidothermus cellulolyticus)的 1,4-β-内切葡聚糖酶的催化区域E1已分别在烟草、玉米、拟南芥、马铃薯、水稻和玉米中成功表达(见表3)[37~44]。另外,来自嗜热单孢菌(Thermpbifida fusca)的耐热纤维素酶Cel6A和Cel6B基因以及来自海栖热袍菌(Thermotoga maritima)的β-葡聚糖酶基因等也在烟草等植物中成功表达(见表3)[45~55]。这些研究表明在植物中生产纤维素酶是可行的,尤其在拟南芥中表达的酶含量可达植物可溶性蛋白含量的26%[39]。值得一提的是,目前在植物中表达纤维素酶大多集中在非生物质原料作物中,而在生长快速的木质纤维素原料作物(如芒草、柳枝稷、桉树和杨树等)中的研究相对较少。

表3 在植物中表达耐热或极端嗜热酶的研究 Table 3 Studies of heat-resistant enzymes or extreme thermophilic enzymes expressed in plants.
2.3 应用于富含油脂能源植物的研究
生物柴油是清洁的可再生能源,是优质石化柴油代用品。目前生物柴油面临的主要问题是原料的油脂含量低、原料少而成本高,因此生物柴油能否实用化的关键是要采用廉价的原料来提高转化从而降低成本。运用基因工程技术来调控脂类合成途径中相关酶基因的表达,从而提高植物脂肪酸的含量或改变脂肪酸组分,是解决上述问题的有效手段。
2.3.1 提高油料植物的含油量 脂肪酸生物合成途径的重要步骤是乙酰-CoA羧化酶(acetyl-CoA carboxylase,ACCase)催化乙酰辅酶A生成丙酰-CoA,植物脂肪酸的含量与ACCase的活性呈正相关。因此,可以利用转基因技术超量表达ACCase来提高含油植物的脂肪酸含量。来源于不同植物的ACCase基因已在油菜、玉米和麻疯树等植物中获得了过表达,并且相应地提高了种子的含油量[56~58]。Dong 等[57]将粟的 ACCase 基因转入玉米,增加了玉米对稀禾啶的抗性,转基因玉米的种子含油量比非转基因玉米增加24%~65%。Roesler等[58]将拟南芥的一个ACCase同源基因转入甘蓝型油菜中,在种子特异性启动子的作用下获得了表达,结果发现,获得的转基因植株T1代种子中ACCase的活性增加了1.7~1.9倍,质体中丙酰-CoA的含量也得到提高,相应地种子产油量提高了3% ~5%。Dunahay等[59]将 ACCase基因在硅藻中过量表达,硅藻的ACCase活性增加了约2~3倍。此外,也有许多研究ACCase不同亚基在脂肪酸合成中作用的报道[60,61],如 Alisa等[60]克隆和表达了油棕生物素羧化酶基因(accC)和β-羧基转移酶基因(accD),结果表明accD的表达对于维持异质型ACCase的水平和植物种子的含油量起最主要的作用。虽然ACCase的含量对脂肪酸的合成起着重要的作用,但是有人推测ACCase的含量对油脂积累的影响因物种而异,ACCase含量对油脂含量低的物种影响大于油脂含量高的物种[62]。由于脂肪酸的合成涉及多个酶的作用,要想通过上调其中一种酶而使油料植物的含油量大幅度提高是不可能的,研究者们开始关注脂肪酸合成途径的转录因子、蛋白激酶和其他调控因子[63,64]。
2.3.2 改良植物中的脂肪酸成分 植物在脂肪酸代谢上存在着多样性和可塑性,不同的植物在油脂脂肪酸的构成上有很大区别。有些植物油的工业价值被脂肪酸的成分所限制,应用转基因技术对油料植物种子中的脂肪酸成分进行改良是一种有效的手段,主要包括通过RNA干扰调控脂肪酸脱氢酶基因活性,调整脂肪酸分子在三酰甘油脂上的分布,修饰脂肪酸链的长度和不饱和度以及调整特定脂肪酸成分等。将拟南芥的二酰甘油酰基转移酶(DGAT)基因在烟草中表达,转基因烟草的叶片中三酰甘油的积累增加了20倍,总脂肪酸和磷脂的含量都有所提高;在烟草中表达拟南芥中调控种子成熟和种子油存储的主调节因子也能提高总脂肪酸含量[65]。Liu 等[66]将脂酰-ACP-Δ9去饱和酶基因ghSAD-1和 ω6去饱和酶基因ghFAD2-1分别转进棉花,提高了棉花的硬脂酸和油酸的含量。Kinney等[67]抑制大豆中的脂酰去饱和酶,导致大豆油中脂肪酸的组成比例发生改变。Kaczmarzyk等[68]将微藻中编码脂酰辅酶 A合成酶(long-chain acyl-CoA synthetase,LACS)基因敲除后,提高了微藻中脂肪酸浓度;同样,敲除拟南芥中编码LACS的两种同工酶基因,切断了种子中脂肪酸进入β-氧化的途径,从而增加了种子的油脂含量[69]。
3 展望
我国作为一个资源大国,植物资源非常丰富,为能源植物资源的开发提供了优越的条件。然而要对这些能源植物资源进行有效的开发与利用,所面临的最主要的问题是利用能源植物生产再生能源的成本过高。利用转基因技术,已在提高植物总的生物量、改变植物木质纤维素的成分、在植物中生产纤维素酶以及改变油料植物的油脂成分等方面进行了许多有益的尝试,这些研究成果对于降低能源植物向生物燃料(生物乙醇、生物柴油)的转化成本、提高能源转化效率有着非常重要的意义。随着生物化学与分子生物学的进一步发展,人们对植物的结构基因组和功能基因组的研究将更加深入,对能源植物的能量转化、富集和分配相关的基因功能及其调控机理也将不断明确,利用植物转基因技术在分子基础上设计和优化能源植物将成为今后改良能源植物、培育优良能源植物新品种的重要研究方向。
[1]Lang A,Kopetz H,Parker A.Australia:Biomass energy holds big promise[J].Nature,2012,488:590-591.
[2]谢光辉,庄会永,危文亮,等.非粮能源植物—生产原理和边际地栽培[M].北京:中国农业大学出版社,2011.
[3]郑洪立,张齐,马小琛等.产生物柴油微藻培养研究进展[J].中国生物工程杂志,2009,29(3):110-116.
[4]曹蕾,衣兰智,孙娟.生物质能源在燃料生产与发电方面的应用现状与前景[J].草业科学,2009,26(9):49-53.
[5]Ku M,Cho D,Li X,et al..Introduction of genes encoding C4 photosynthesisenzymesinto rice plants:Physiological consequences[J].Novartis Found Symp.,2001,236:100-116.
[6]Hu L,Li Y,Xu W,et al..Improvement of the photosynthetic characteristics of transgenic wheat plants by transformation with the maize C4 phosphoenolpyruvate carboxylase gene[J].Plant Breeding,2012,131(3):385-391.
[7] 张桂芳.稗草 C4关键酶(PEPC、PEDK)基因的克隆及PEPC基因对水稻和烟草的遗传转化[D].北京:中国农业大学,博士学位论文,2005.
[8]王晓薇.转甘蔗pepc基因籼稻及其与光合作用相关的生理特性分析[D].福州:福建农业大学,硕士学位论文,2011.
[9]Shrawat A K,Carroll R T,Depauw M, et al..Genetic engineering of improved nitrogen use efficiency in rice by the tissue-specific expression of alanine aminotransferase [J].Plant Biotechnol.,2008,6(7):722-732.
[10] Jing Z P,Gallardo F,Pascual M B,et al..Improved growth in a field trial of transgenic hybrid poplar overexpressing glutamine synthetase[J].New Phytol.,2004,164(1):137-145.
[11] Kant S,Bi Y M,Rothstein S J.Understanding plant response to nitrogen limitation for the improvement of crop nitrogen use efficiency[J].J.Exp.Bot.,2011,62(4):1499-1509.
[12] Wang T,Lu L,Zhang C G,et al..Pleiotropic effects of suppressing deoxyhypusine synthase expression in Arabidopsis thaliana[J].Plant Mol.Biol.,2003,52:1223-1235.
[13] Kebeish R,Niessen M,Thiruveedhi K,et al..Chloroplastic photorespiratory bypass increases photosynthesis and biomass production in Arabidopsis thaliana [J].Nat.Biotechnol.,2007,25:593-599.
[14] Foyer C H,Souriau N,Perret S,et al..Overexpression of glutathione reductase but not glutathione synthetase leads to increases in antioxidant capacity and resistance to photoinhibition in poplar trees [J].Plant Physiol.,1995,109:1047-1057.
[15] Lieman-Hurwitz J, Rachmilevitch S, Mittler R, et al..Enhanced photosynthesis and growth of transgenic plants that express ictB,ageneinvolved in HCO3-accumulation in Cyanobacteria[J].Plant Biotechnol.J.,2003,(1):43-50.
[16] Hay W T.Engineering cyanobaterial genes into Glycine max(soybean)leads to increased photosynthesis and productivity[D].Illinois,USA:The University of Illinois at Urbana-Champaign,Dissertation for Doctor of Philosophy,2012.
[17] Miyagawa Y,Tamoi M,Shigeoka S.Overexpression of a cyanobacterialfructose-1, 6-/sedoheptulose-1, 7-bisphosphatase in tobacco enhances photosynthesis and growth [J].Nat.Biotechnol.,2001,19:965-969.
[18] Fu C,Sunkar R,Zhou C,et al..Overexpression of miR156 in switchgrass(Panicum Virgutum L.)resultsin various morphologicalalterationsand leadsto improved biomass production [J].Plant Biotechnol.J.,2012,10(4):443-452.
[19] Himmel M E,Adney W S,Baker J O,et al..Advanced bioethanol production technologies:A perspective[J].Fuel Chemi.Biomass,1997,666:2-45.
[20] Himmel M E,Ding S Y,Johnson D K,et al..Biomass recalcitrance:Engineering plants and enzymes for biofuels production[J].Science,2007,315:804-807.
[21] Sticklen M B.Plant genetic engineering for biofuel production:Towards affordable cellulosic ethanol[J].Nat.Rev.Genet.,2008,9(6):433-443.
[22] Prins M J,Ptasinski K J,Janssen F J.Exergetic optimization of a production process of Fischer-Tropsch fuels from biomass[J].Fuel Process Technol.,2004,86:375-389.
[23] Li L,Zhou Y,Cheng X,et al..Combinatorial modification of multiple lignin traits in trees through multigene cotransformation[J].Proc.Natl.Acad.Sci.USA,2003,100(8):4939-4946.
[24] Blee K A,Choi J W,O'Connell A P,et al..A lignin-sepcific peroxidase in tobacco whose antisense suppression leads to vascular tissue modification[J].Phytochemistry,2003,64(1):163-176.
[25] Fu C,Mielenz J R,Xiao X,et al..Genetic manipulation of lignin reduces recalcitrance and improves ethanol production from switchgrass[J].Proc.Natl.Acad.Sci.USA,2011,108(9):3803-3808.
[26] Baxter H L,Mazarei M,labbe N,et al..Two-year field analysis of reduced recalcitrance transgenic switchgrass[J].Plant Biotechnol.J.,2014,doi:10.1111/pbi.12195.
[27] Fu C,Xiao X,Xi Y,et al..Downregulation of cinnamyl alcohol dehydrogenase(CAD)leads to improved saccharification efficiency in switchgrass[J].Bioenergy Res.,2011,4(3):153-164.
[28] Xu B,Escamilla-Trevino L L,Sathitsuksanoh N,et al..Silencing of 4-coumarate:Coenzyme A ligase in switchgrass leads to reduced lignin content and improved fermentable sugar yields for biofuel production[J].New Phytol.,2011,192(3):611-625.
[29]Giordano A,Liu Z,Panter S N,et al..Reduced lignin content and altered lignin composition in the warm season forage grass Paspalum dilatatum by down-regulation of a cinnamoyl CoA reductase gene[J].Transgenic Res.,2014,23(3):503-517.
[30] Barakate A,Stephens J,Goldie A,et al..Syringyl lignin is unaltered by severe sinapyl alcohol dehydrogenase suppression in tobacco[J].Plant Cell,2011,23(12):4492-4506.
[31]孙晓波,马鸿翔,王澎.基因工程在能源植物改良中的应用[J].生物技术通报,2007,(3):1-5.
[32] Rogers L A,Campbell M M.The genetic control of lignin deposition during plant growth and development[J].New Physiol.,2004,164:17-21.
[33] Voelker S L,Lachenbruch B,Meinzer F C,et al..Antisense down-regulation of 4CL expression alters lignification,tree growth and saccharification potential of field-grown poplar[J].Plant Physiol.,2010,154(2):874-886.
[34] Voelker S L,Lachenbruch B,Meinzer F C,et al..Transgenic poplars with reduced lignin show impaired xylem conductivity,growth efficiency and survival[J].Plant Cell Environ.,2011,34(4):655-668.
[35] Taylor L E, DaiZ, DeckerS R, et al.. Heterologous expression of glycosyl hydrolases in planta:A new departure for biofuels[J].Trends Biotechnol.,2008,26:413-424.
[36] Mir B A,MewalalR, MizrachiE, et al.. Recombinant hyperthermophilicenzyme expression in plants:A novel approach for lignocellulose digestion[J].Trends Biotechnol.,2014,32(5):281-289.
[37] Ziegelhoffer T.Expression of Acidothermus cellulolyticus E1 endo-β-1,4-glucanase catalytic domain in transplastomic tobacco[J].Plant Biotechnol.J.,2009,(7):527-536.
[38] Ransom C, Balan V, Biswas G et al.. Heterologous Acidothermus cellulolyticus 1,4-β-endoglucanase E1 produced within the corn biomass converts corn stover into glucose[J].Appl.Biochem.Biotechnol.,2007,137-140(1-12):207-219.
[39] Ziegler M T,Thomas S R,Danna K J.Accumulation of a thermostable endo-1, 4-β-D-glucanasein theapoplastof Arabidopsis thaliana leaves[J].Mol.Breed.,2000,(6):37-46.
[40] Dai Z,Hooker B S,Anderson D B,et al..Expression of Acidothermus cellulolyticus endoglucanase E1 in transgenic tobacco:Biochemical characteristics and physiological effects[J].Transgenic.Res.,2000,(9):43-54.
[41] Hood E E,Love R,Lane J,et al..Sub-cellular targeting is a key condition for high-level accumulation of cellulase protein in transgenic maize seed[J].Plant Biotechnol.J.,2007,(5):709-719.
[42] Oraby H,Venkatesh B,Dale B,et al..Enhanced conversion of plant biomass into glucose using trangenic rice producted endoglucanase for cellulosic ethanol[J].Transgenic Res.,2007,16:739-749.
[43] Chou H L,Dai Z,Hsieh C W,et al..High level expression of Acidothermus cellulolyticus β-1,4-endoglucanase in transgenic rice enhances the hydrolysis of its straw by cultured cow gastric fluid[J].Biotechnol.Biofuels,2011,(4):1-13.
[44] Sun Y,Cheng J J,Himmel M E,et al..Expression and characterization of Acidothermus cellulolyticus E1 endoglucanase in transgenic duckweed Lemna minor 8627[J].Bioresour.Technol.,2007,98:2866-2872.
[45] Yu L X,Gray B N,Rutzke C J,et al..Expression of thermostable microbial cellulases in the chloroplasts of nicotinefree tobacco[J].J.Biotechnol.,2007,131:362-369.
[46] Gray B N,Ahner B A,Hanson M R.High-level bacterial cellulase accumulation in chloroplast-transformed tobacco mediated by downstream box fusions[J].Biotechnol.Bioeng.,2009,102:1045-1054.
[47] Gray B N,YangH, AhnerB A, et al.. An efficient downstream box fusion allows highlevel accumulation of active bacterial β-glucosidase in tobacco chloroplasts[J].Plant Mol.Biol.,2011,76:345-355.
[48] Sun J L,Kawazu T,Kimura T,et al..High expression of the xylanase B gene from Clostridium stercorarium in tobacco cells[J].J.Ferment.Bioeng.,1997,84:219-223.
[49] Herbers K,Wilke I,Sonnewald U.A thermostable xylanase from Clostridium thermocellum expressed at high levels in the apoplast of transgenic tobacco has no detrimental effects and is easily purified[J].Nat.Biotechnol.,1995,13:63-66.
[50] Nigorikawa M,Watanabe A,Furukawa K,et al..Enhanced saccharification of rice straw by overexpression of rice exoglucanase[J].Rice,2012,5(1):1-7.
[51] Jung S,Kim S,Bae H,et al..Expression of thermostable bacterial β-glucosidase(BglB)in transgenic tobacco plants[J].Bioresour.Technol.,2010,101:7144-7150.
[52]Kim S,Lee D S,Choi I S,et al..Arabidopsis thaliana Rubisco small subunit transit peptide increases the accumulation of Thermotoga maritima endoglucanase Cel5A in chloroplasts of transgenic tobacco plants[J].Transgenic Res.,2010,19(3):489-497.
[53] Kim J Y,Kavas M,Fouad W M,et al..Production of hyperthermostable GH10 xylanase Xyl10B from Thermotoga maritime in transplastomic plants enables complete hydrolysis of methylglucuronoxylan to fermentable sugars for biofuel production[J].Plant Mol.Biol.,2011,76:357-369.
[54] Klose H,Röder J, Girfog M, et al.. Hyperthermophilic endoglucanase for in planta lignocellulose conversion[J].Biotechnol.Biofuels,2012,(5):1-9.
[55]Montalvo-Rodriguez R,Haseltine C,Huess-LaRossa K,et al..Autohydrolysis of plant polysaccharides using transgenic hyperthermophilic enzymes[J].Biotechnol.Bioeng.,2000,70:151-159.
[56] Dong Z,Zhao H,Huai J,et al..Overexpression of a foxtail milletacetyl-CoA carboxylase gene in maize increases sethoxydim resistance and oilcontent[J]. Afri. J.Biotechnol.,2011,10(20):3986-3995.
[57] Gu K,Chiam H,Tian D,et al..Molecular cloning and expression of heteromeric ACCase subunit genes from Jatropha curcas[J].Plant Sci.,2011,180(4):642-649.
[58] Roesler K,Shintani D,Savage L,et al..Targeting of the Arabidopsis homomeric acetyl-coenzyme a carboxylase to plastids of rapeseeds[J].Plant Physiol.,1997,113:75-81.
[59] Dunahay T G,Jarvis E E,Dais S S,et al..Manipulation of microalgal lipid production using genetic engineering[J].Appl.Biochem.Biotechnol.,1996,57-58(1):223-231.
[60]Alisa N,Wilaiwan C,Theera E,et al..Cloning and expression of a plastid-encoded subunit, betacarboxyltransferasegene(accD)and a nuclear-encoded subunit,biotin carboxylase of acetyl-CoA carboxylase from oil palm(Elaeis guineensis Jacq.)[J].Plant Sci.,2008,175(4):497-504.
[61] Kode V,Mudd E A,Iamtham S,et al..The tobacco plastid accD gene is essential and is required for leaf development[J].Plant J.,2005,44(2):237-244.
[62]潘克厚,韩吉昌,朱葆华,等.基因工程在提高微藻生产生物柴油能力中的应用前景[J].海洋湖沼通报,2012,(2):33-43.
[63] Girke T,Todd J,Ruuska S,et al..Microarray analysis of developing Arabidopsis seeds[J].Plant Physiol.,2000,124:1570-1581.
[64]Erp H V,Kelly A A,Menard G,et al..Multigene Engineering of triacylglycerol metabolism boots seed oil content in Arabidopsis[J].Plant Physiol.,2014,165(1):30-36.
[65] Andrianov V,Borisjuk N,Pogrebnyak N,et al..Tobacco as a production platform for biofuel:Overexpression of Arabidopsis DGAT and LEC2 genes increases accumulation and shifts the composition of lipids in green biomass[J].Plant Biotechnol.J.,2010,8(3):277-287.
[66] Liu Q,Singh S,Green A.Genetic modification of cotton seed oil using inverted-repeatgene-silencing techniques[J].Biochem.Soc.Trans.,2000,28:927-929.
[67] Kinney A J.Development of genetically engineered soybean oils for food applications[J].J.Food Lipids,1996,(3):273-292.
[68] Kaczmarzyk D,Fulda M.Fatty acid activation in cyanobacteria mediated by acylacyl carrier protein synthetase enables fatty acid recycling[J].Plant Physiol.,2010,152:1598-1610.
[69] Fulda M,Schnurr J,Abbadi A,et al..Peroxisomal acyl-CoA synthetase activity is essential for seedling development in Arabidopsis thaliana[J].Plant Cell,2004,16:394-405.
