N端测序作为单克隆抗体常规放行分析方法的探讨
2014-10-31郭玮于传飞李萌王兰张峰刘春雨王文波高凯
郭玮,于传飞,李萌,王兰,张峰,刘春雨,王文波,高凯
中国食品药品检定研究院,北京 100050
单克隆抗体的发展经历了鼠源、嵌合、人源化和全人源 4个阶段,由于鼠源和嵌合单抗会产生人抗鼠抗体反应,所以人源化和全人源单抗已成为生物技术企业研发的主流[1-4]。单抗的分子量高达 150 kDa左右,结构复杂,其质控相比较于小分子药物要求较高。《中华人民共和国药典》[5]尚未纳入单抗药物的总论和各论,国内的生物技术企业仍参照其他重组药物的规定对单抗进行质控,但是人源化和全人源单抗作为一大类分子具有其独特的序列结构特征,本文将针对鉴别实验中的N端测序是否应纳入常规放行质控方法进行探讨,为生物技术企业的对单抗的质控提供参考。
人用药物注册技术要求国际协调会议 (The International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use,ICH)中 Q6B章节建议鉴别实验应具有高度特异性,其设计应基于分子结构或其他性质的独特性[6]。单克隆抗体结构功能复杂,但具有结构共性,其特异性识别相应靶抗原的基础在于其抗原结合片断(Antigen-binding fragment,Fab)上互补决定区(Complementarity-determining region,CDR)氨基酸序列的不同,而对于人源化和全人源单抗而言,其他序列则有很大可能性具有相同或高度相似性[7],这就对其鉴别实验提出了巨大挑战。
本研究通过多种理化分析技术,包括N端测序 (Edman降解法、液质联用法)、质量肽图法、离子交换色谱、毛细管区带电泳[8]、成像毛细管等点聚焦电泳[9],对两种单抗即抗 HER2(人表皮生长因子受体 2,human epidermal growth factor receptor-2)单抗和抗VEGF (血管内皮生长因子,vascular endothelial growth factor)单抗进行了综合分析,对这些方法作为常规放行分析方法及鉴别方法的适用性进行了探讨。
1 材料与方法
1.1 样品
抗体1为抗HER2单抗,抗体2为抗VEGF单抗,二者均为人源化的IgG1/kappa型单抗,由中国仓鼠卵巢 (Chinese hamster ovary,CHO)细胞表达,二者均为本室留样。
1.2 主要仪器及试剂
电泳仪和电转仪均为Bio-Rad公司产品;N末端氨基酸序列分析仪为美国ABI公司产品,型号为PROCISE 491,附带The Model 610 A工作站;超高效液相为 Waters公司的 ACQUITY UPLC H-Class Bio System,色谱柱为BEH130 C18分析柱,1.7 μm,2.1 mm×100 mm;质谱为Waters公司的Xevo G2 QTOF,分析软件为Waters公司的Biopharmalynx;高效液相为Waters公司的Waters Alliance,色谱柱为Dionex ProPac WCX-10, 4.0 mm×250 mm;毛细管电泳系统为Beckman公司的PA800 plus系统;成像毛细管等点聚焦电泳系统为ProteinSimple公司的iCE280。
2×Tris-Glycine SDS 上样缓冲液 (货号LC2676)、4%−20%梯度分离胶 (货号 EC6025)和电泳缓冲液 (货号NP0001)均购自Novex;PVDF膜购自Pall公司,货号66543;8 mol/L盐酸胍 (货号 G9284)、二硫苏糖醇 (DTT,货号 D0632)和碘乙酸钠 (货号I2512)均购自Sigma公司;胰蛋白酶购自Promega公司,货号为V5111。CpB (羧肽酶 B)购自 Roche公司,货号为 103233;Beckman eCAP N-CHO涂层毛细管购自Beckman Coulter公司;1%甲基纤维素溶液、pI marker 7.55和 10.10以及毛细管购自 ProteinSimple公司;Pharmalyte pH 3−10和pH 8−10.5购自GE公司。
1.3 方法
1.3.1 Edman降解法分析 N末端氨基酸实验步骤
将样品用去离子水稀释至 2 mg/mL,进行电泳转膜以及测序,具体实验步骤按照文献所示方法进行[10]。
1.3.2 肽图及液质联用分析N末端实验步骤
将1 mg抗体蛋白加入到750 mL 8 mol/L盐酸胍中,同时加入 1 mol/L DTT至终浓度为60 mol/L,混匀,37 ℃孵育60 min。取2.9 mol/L的碘乙酸钠45 mL,加入到上述缓冲液中,混匀,室温避光孵育45 min后,再加入70 mL 1 mol/L DTT终止烷基化反应。将烷基化后溶液脱盐至50 mmol/L的碳酸氢铵 (pH 8.0)缓冲液中,以1∶50 (W/W)胰蛋白酶酶解,37 ℃孵育4 h后加入甲酸至终浓度0.1%,终止酶解反应,同时酸化肽段。
液相条件:A相为0.1%甲酸,B相为含0.1%甲酸的乙腈,具体液相条件如下表1所示。
质谱条件:采集范围为50−2 000 Da,碰撞能量为20−45 V。
1.3.3 离子交换色谱分析步骤
将样品稀释至1 mg/mL,按1% (W/W)比例加入相应体积1 mg/mL CpB,室温孵育20 min。液相条件:A相为 20 mmol/L N-(2-乙酰胺)-2-氨基乙磺酸 (ACES),pH 6.50 ± 0.05,B相为A相中加入100 mmol/L的NaCl,梯度为0−25 min内30%−43%的B相,25−53 min内43%−100%的B相。进样体积为50 μL,流速为0.5 mL/min,柱温为 40 ℃,于 280 nm波长下进行检测。
1.3.4 成像毛细管等点聚焦电泳
将 3 μL Pharmalyte 3−10、13 μL Pharmalyte8−10.5、1 μL pI marker 5.85、1 μL pI marker 10.10,70 μL 1%甲基纤维溶液和 102 μL 去离子水溶液混合 (总体积为 190 μL)配制成两性电解质溶液,用水将样品稀释至5 mg/mL,加入10 μL至两性电解质溶液中,混匀后加入分析瓶中上机分析。分析参数为1 500 V 1 min后3 000 V 10 min。
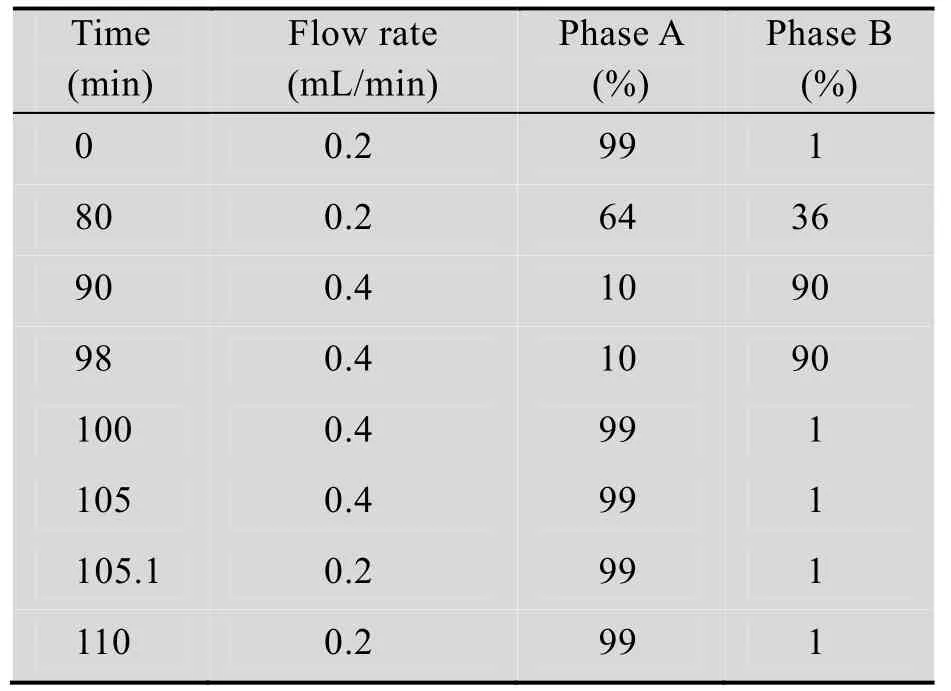
表1 肽图分析所用的液相条件Table 1 Conditions of UPLC for peptide mapping analysis
1.3.5 毛细管区带电泳 (CZE)分析
将样品用去离子水稀释至 0.5 mg/mL,加入75 μL至分析瓶中,运行/冲洗缓冲液为40 mmol/L ε-氨基-n-己酸 (EACA),pH 4.50,0.2%羟丙基甲基纤维素 (HPMC)电泳缓冲液,1.0 psi进样10 s,20 kV电压分离15 min,214 nm进行检测。
2 结果
2.1 Edman法及液质联用法测定N-端氨基酸序列
Edman法表明抗HER2单抗和抗VEGF单抗重链的 N 端 15个氨基酸残基序列均为EVQLVESGGGLVQPG,而轻链的N-端15个氨基酸残基序列均为DIQMTQSPSSLSASV (图未显示)。

图1 抗VEGF单抗重链 (A)和轻链 (C)以及抗Her2单抗重链 (B)和轻链 (D)T1肽段的二级质谱图Fig. 1 MS/MS spectrometry of T1 peptide fragments of heavy (Panel A)and light (Panel B)chains of anti-VEGF and anti-Her2 antibody.
胰酶的酶切位点位于赖氨酸或精氨酸后的肽键,参照抗Her2单抗和抗VEGF单抗的一级序列,二者酶切后重链的T1肽段的氨基酸序列完全相同,均为19个氨基酸,其二级质谱图也可看出其谱图基本上完全相同 (图1A和1B);二者酶切后轻链的 T1肽段也完全相同,均为18个氨基酸,且其二级质谱可以看出谱图基本上完全相同 (图1C和1D);常规质控方法采用N端测序方法,由于仪器精密度限制,一般要求测定15个氨基酸。IMGT网站 (http://www. imgt.org/)共收录功能性 IgG胚系基因 59个,若按 N-端15个氨基酸残基序列则为23类;功能性Igκ胚系基因34个,若按N-端15个氨基酸残基序列相同分类则为 21类 (表 2)[11]。而所测得的抗HER2单抗和抗VEGF单抗重链的重链和轻链前15个氨基酸分别完全相同,并且均是表1中最高频的序列。
2.2 肽图分析
分别比较抗HER2单抗和抗VEGF单抗的重链和轻链序列,可以发现其序列相似性均为90%以上,其差异则均来源于CDR1、CDR2和CDR3区域。肽图可通过来源于CDR1、CDR2和CDR3特征性肽段峰可对抗体做出有效鉴别,如图 2所示 (其中的 L代表轻链,H代表重链),美国药典 (USP)[12]各论中已对抗CD20和Her2单抗鉴别肽段已作出明确要求。

表2 IgG和Igκ胚系基因前15个氨基酸残基序列统计Table 2 Statistics of N terminal 15 aminoacid sequences deduced from germline IgG and Igκ genes

图2 抗VEGF单抗和抗Her2单抗镜像对比的质量肽图Fig. 2 Mirroring comparison of peptide mass mapping between anti-VEGF and anti-Her2 antibody.
2.3 异质性分析
抗体的异质性可影响单抗的抗原结合能力、效应子功能的发挥和免疫原性,是单抗批间一致性的重要指标、生物类似物可比较研究的重要环节[13-14],并且作为单抗的内在属性,可作为单抗鉴别的重要分析因素。其中电荷异质性的分析一般包括离子交换色谱、毛细管区带电泳分析和等电点分析[15],我们对抗 HER2单抗和抗 VEGF单抗分别用上述3种方法进行了对比分析,结果如图3、4、5所示,可以看出两种单抗均显现出明显的差异,结果证明3种方法均可作为其异质性分析和鉴别的重要手段。

图3 抗VEGF单抗和抗Her2单抗的离子色谱图Fig. 3 Ion exchange chromatography of anti-VEGF and anti-Her2 antibody.

图4 抗VEGF单抗和抗Her2单抗的毛细管区带电泳图Fig. 4 Capillary zone electrophoresis of anti-VEGF and anti-Her2 antibody.

图5 抗VEGF单抗和抗Her2单抗的成像毛细管等点聚焦电泳图Fig. 5 Imaged Capillary Isoelectric Focusing of anti-VEGF and anti-Her2 antibody.
3 讨论
单抗的人源化技术分为两大类:第一类为推理法 (Rational approach)[16],包括CDR移植(CDR grafting)、表面重塑 (Resurfacing)、超人源化 (Superhumanization)以及 HSC (Human String Content)等技术;第二类为经验法(Empirical method)[17],包括骨架库 (FR libraries)、骨架重排 (F R s h u ff l i n g)以及人性化(Humaneering)等技术。上述技术的起始步骤必须先从免疫后的鼠兔等动物得到异源单抗,然后再和人源抗体序列作比对,选择同源性较高的人源序列的骨架区替代异源单抗相应的骨架区。而作为比对的人源序列大多选择自胚系基因 (Germline genes)[18],由于胚系基因的数量有限,所以不同单抗 CDR1前的第一骨架区很可能会发生序列完全相同的情况。人源抗体骨架的选择有时会来自一致序列 (Consensus sequences)和成熟序列 (Mature sequences)[19],但是前者为非自然来源序列,后者经过不可预知的经过突变的序列,二者都可能会产生免疫反应,在实际研发过程中应用较少。而对于全人源单抗,其相应的研发技术包括导向选择(Guided selection)[20]、人源化小鼠[21]等,所以应用这些技术多得到的不同单抗第一骨架区序列也可能完全相同。
人用药物注册技术要求国际协调会议(ICH)中Q6B章节建议,可以选择N端测序方法对生物技术类产品进行鉴别实验,而《中华人民共和国药典》(2010版)[5]虽然没有收录单抗品种,但其中对生物治疗性产品基本都要求 N端测序对其进行鉴别。但是如上所述,不同抗体其第一骨架区可能相同,而由于Edman技术所限,一般要求测得N端15个氨基酸,而15个氨基酸完全相同具有非常大的概率 (表 1),所以N端测序法很多情况下并不能对两个不同的单抗进行鉴别。同时我们的研究也表明,应用标示有特征肽段的肽图方法以及不同异质性分析方法 (包括离子色谱、毛细管区带电泳和成像毛细管等点聚焦电泳)则都可以对上述两种单抗进行有效鉴别。
本研究说明Edman测序法不能对抗VEGF单抗和抗Her2单抗进行有效鉴别,提示在单抗类产品的常规放行和鉴别实验中是否应囊括N端测序值得进一步商榷,应利用肽图法及多种异质性分析方法等对其进行综合分析鉴别。
[1]Leavy O. Therapeutic antibodies: past, present and future. Nat Rev Immunol, 2010, 10(5): 297.
[2]Buss NA, Henderson SJ, McFarlane M, et al.Monoclonal antibody therapeutics: history and future.Curr Opin Pharmacol, 2012, 12(5): 615–622.
[3]Scolnik PA. mAbs: a business perspective. MAbs,2009, 1(2): 179–184.
[4]Sliwkowski MX, Mellman I. Antibody therapeutics in cancer. Science, 2013, 341(6151): 1192–1198.
[5]Chinese Pharmacopoeia Commission. Chinese Pharmacopoeia. Beijing: China Medical Science Press, 2010 (in Chinese).国家药典委员会. 中华人民共和国药典. 北京:中国医药科技出版社, 2010
[6]ICH Q6B Specifications: Test Procedures and Acceptance Criteria for Biotechnological/Biological Products [EB/OL]. [2014-02-09].http://www.ich.org/fileadmin/Public_Web_Site/IC H_Products/Guidelines/Quality/Q6B/Step4/Q6B_Guideline.pdf.
[7]Nelson AL, Dhimolea E, Reichert JM. Development trends for human monoclonal antibody therapeutics.Nat Rev Drug Discov, 2010, 9(10): 767–774.
[8]Espinosa-de la Garza CE, Perdomo-Abúndez FC,Padilla-Calderón J, et al. Analysis of recombinant monoclonal antibodies by capillary zone electrophoresis. Electrophoresis, 2013, 34(8):1133–1140.
[9]Anderson CL, Wang Y, Rustandi RR. Applications of imaged capillary isoelectric focussing technique in development of biopharmaceutical glycoprotein-based products. Electrophoresis,2012, 33(11): 1538–1544.
[10]Guo W, Zhang J, Zhang F, et al. Sequencing of amino acids at N-terminus of recombinant antibody. Chin J Pharm Anal, 2012, 32(6):1059–1063 (in Chinese).郭玮, 张晶, 张峰, 等. 基因工程单克隆抗体N-端氨基酸序列的测定. 药物分析杂志, 2012,32(6): 1059–1063.
[11]Zhiqiang An. Therapeutic Monoclonal Antibodies:From Bench to Clinic. John Wiley & Sons, Inc.Sep, 2009.
[12]The United States Pharmacopeial Convention. US Pharmacopoeia. US: The United States Pharmacopeial Convention, 2013.
[13]Liu H, Gaza-Bulseco G, Faldu D, et al.Heterogeneity of monoclonal antibodies. J Pharm Sci, 2008, 97(7): 2426–2447.
[14]Khawli LA, Goswami S, Hutchinson R, et al.Charge variants in IgG1: isolation, characterization,in vitro binding properties and pharmacokinetics in rats. MAbs, 2010, 2(6): 613–624.
[15]Vlasak J, Ionescu R. Heterogeneity of monoclonal antibodies revealed by charge-sensitive methods.Curr Pharm Biotechnol, 2008, 9(6): 468–481.
[16]Marshall SA, Lazar GA, Chirino AJ, et al. Rational design and engineering of therapeutic proteins.Drug Discov Today, 2003, 8(5): 212–221.
[17]Almagro JC, Fransson J. Humanization of antibodies. Front Biosci, 2008, 13: 1619–1633.
[18]Pelat T, Hust M, Thullier P. Obtention and engineering of non-human primate (NHP)antibodies for therapeutics. Mini Rev Med Chem,2009, 9(14): 1633–1638.
[19]Haidar JN, Yuan QA, Zeng L, et al. A universal combinatorial design of antibody framework to graft distinct CDR sequences: a bioinformatics approach. Proteins, 2012, 80(3): 896–912.
[20]Kim SJ, Hong HJ. Humanization by guided selections. Methods Mol Biol, 2012, 907: 247–257.
[21]Laffleur B, Pascal V, Sirac C, et al. Production of human or humanized antibodies in mice. Methods Mol Biol, 2012, 901: 149–159.
