A型肉毒素重链干预神经细胞组蛋白3乙酰化水平的初步研究
2018-06-26李志强赵明伟袁海霞李夏青
兰 婧,刘 福,高 扬,李志强,刘 雅,赵明伟,袁海霞,李夏青*
(1.山西医科大学病理生理教研室,太原 030001; 2.山西医科大学第一临床医学院,太原 030001)
A型肉毒素(botulinum neurotoxin serotype A,BoNT/A)是目前研究较为广泛、也是临床作为药物应用的主要生物毒素制剂之一,例如:利用BoNT/A阻止神经突触前膜神经递质释放的毒性机制将其用于缓解或治疗某些与肌肉收缩过度有关的临床疾患(斜颈、面肌痉挛、尿失禁、偏头痛、簇集性头痛、多汗症、皮肤除皱等)。BoNT/A分子由一条重链(heavy chain-HC, 分子量为100×103)和一条轻链(light chain-LC,分子量为50×103)构成,由二硫键相互连接。重链的羧基端含有与突触前膜蛋白受体结合的位点,可与膜受体结合形成毒素-受体复合物,轻链随重链内吞进入细胞发挥毒性作用[1]。本研究团队的前期研究结果显示人工重组的BoNT/A重链可促进体外培养的神经细胞突起生长;在体实验也进一步证实BoNT/A重链可干预脊髓损伤后局部多种分子量水平的蛋白表达[2-3]。然而,就目前而言,BoNT/A的很多功能并不能单独用毒素的致毒机理解释。毒素分子中的重链与宿主细胞膜受体结合所引起的细胞内信号系统的改变及其影响已受到重视。
经典遗传学信息提供了各种蛋白(包括表观遗传学修饰蛋白在内)、RNA的结构信息,而表观遗传学信息则提供何时、何处合成何种蛋白及 RNA的指令,从而严密地控制着蛋白及RNA的功能[4]。组蛋白乙酰化属于组蛋白表观修饰的表现之一,组蛋白的乙酰化/去乙酰化相互作用可形成特殊的密码而影响其他蛋白因子的活动[5]。在所有的组蛋白中,组蛋白3(H3)和组蛋白4(H4)的乙酰化对基因表达调控及随后的蛋白合成表达的影响已有较为广泛的研究[4]。
神经损伤后的再生修复依赖于蛋白合成、尤其是生长相关蛋白的合成。有文献报道[6],BoNT/A重链可以促进体外培养的运动神经细胞突起增长,本研究团队的前期实验也观察到在体应用BoNT/A重链可以使脊髓损伤局部蛋白表达出现多种变化。这些研究结提示:BoNT/A重链可干预蛋白合成相关的细胞内各种信号途径。基于组蛋白乙酰化对蛋白合成及表达的重要作用,本研究拟通过离体和在体两种方法观察BoNT/A对组蛋白亚型3的乙酰化水平的影响,旨在对BoNT/A重链的生物学作用有更进一步的认识。
1 材料和方法
1.1 实验动物
SPF级SD大鼠48只,雄性,体重200~220 g,6周龄,来源于北京海淀兴旺实验动物养殖场[SCXK(京)2014-0013],饲养于本实验室独立动物房[SYXK(晋)2015-0001]。动物模型的手术操作按照山西医科大学动物使用伦理委员会的规定执行(IACUC2017-001)。
1.2 主要试剂与仪器
Neuro-2a细胞购自中国科学院上海细胞库; BoNT/A重链、A型肉毒素重链购自美国List Biological Laboratories, Inc; Bradford 法蛋白浓度测定试剂盒 (Sangon Biotech, C503031,China); EasySee Western blot kit (TRAN, DW101, China); 10%胎牛血清(美国Hyclone公司);兔抗乙酰化-H3抗体 (1∶1000,monoclone,CST,USA);HRP标记的goat anti rabbit二抗(1∶500,上海生工);凝胶成像系统(Bio-Rad,USA); 多功能酶标仪(Molecular Devices, SpectraMax@190,USA);多功能电泳仪(Bio-Rad, USA)。
1.3 实验方法
1.3.1细胞培养
将Neuro-2a细胞悬浮含有10%胎牛血清和1%青链霉素的DMEM-HG培养液后、接种于用0.01%多聚赖氨酸铺被的培养板内, 置于37℃ 5% CO2的孵箱内进行培养。用于蛋白表达测定的细胞接种密度为1×106/mL,置于24孔培养板内,每6孔为一组,分为4组:(1)正常对照组;(2)BoNT/A重链处理24 h组;(3)BoNT/A重链处理48 h组;(4)BoNT/A重链处理72 h组。根据前期实验结果,BoNT/A给予剂量为: 1 ng/L (终浓度)。待细胞完全贴壁生长后(4 h左右)加入BoNT/A重链,用于神经突起测定的细胞接种密度为每孔1×105,置于96孔培养板内,分组和BoNT/A重链剂量同上。
1.3.2神经突起测定
BoNT/A重链作用后Neuro-2a 细胞突起测定:细胞接种后随机分为对照组和实验组(0.1 nmol/L 组和1 nmol/L 组)每组8个孔,于细胞贴壁生长后4 h时,实验组加入不同浓度的BoNT/A重链,阴性对照组加入等剂量的DMEM 基础培养液,分别于给药后24 h、48 h 和72 h将细胞置于相差倒置显微镜摄影,每孔随机视野拍摄2~3张图片,每组共20张图片,用于细胞突起的测定,包括:(1)具有突起的细胞占细胞总数的比例(%),细胞计数采用Photoshop CS软件;(2)测量神经突起长度,采用ImageJ软件进行。
1.3.3脊髓损伤及BoNT/A重链给药
采用鞘内注射给药:6 μg/20 μL,BoNT/A重链+生理盐水,收取不同时间点脊髓组织。经皮腰骶部鞘内给药的方法参照文献[3]略作改动,具体方法如下:1%的戊巴比妥钠腹注射麻醉,0.4 mL/100 g。将全身麻醉后的脊髓损伤模型大鼠后背位固定于鼠台,大鼠腰骶部下方放置直径约为3~5 cm圆柱状筒物体,使L6~S1间隙充分张开便于实验操作。剪毛,碘伏消毒穿刺中心皮肤,拇指和中指触摸大鼠双侧髂嵴并向两侧绷紧皮肤,食指于两侧髂嵴连线同一水平触摸大鼠脊椎,触及最高点即为L6 棘突,在 L6~S1 间隙采用 20 G穿刺针垂直刺入皮肤、皮下肌层,当出现落空感、同时看到大鼠甩尾,证明针尖已经进入蛛网膜下腔,此时将针头旋转180°,同时刺针向尾侧倾斜约30°,继续向前推进1 mm 左右。随后将充满生理盐水的经改造的PE-10 聚乙烯导管从穿刺针内部缓慢插入约1 cm,导管插入过程中可出现脑脊液流出、动物甩尾等显著特征以充分证明导管置入成功。此时用微量注射器将6 μg/20 μL,BoNT/A重链+生理盐水沿PE-10管缓慢注射到鞘内,注射完成后停留片刻再将20 μL的生理盐水沿PE-10管注入鞘内,以保证BoNT/A重链制剂全部进入鞘内。单独脊髓损伤动物注射相同剂量生理盐水。在注射后保持头低足高位约5 min。给药后每只单独饲养,分别于给药后2 h、12 h、24 h、48 h、4 d、8 d收取大鼠脊髓标本,每组6只。
模型动物术后的大体解剖及组织学观察皆显示明显的脊髓单侧损伤(图1)。
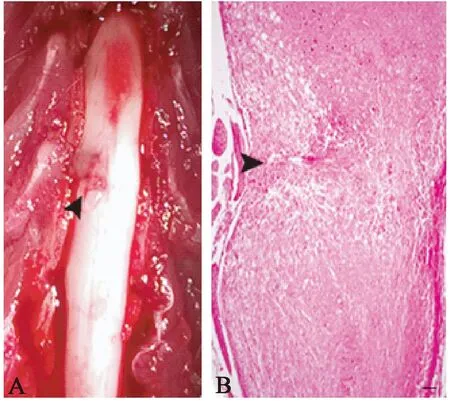
注:箭头:损伤部位。图1 脊髓损伤的大体及组织学观察(Bar=100 μm)Note.The arrow heads indicate the injury sites.Fig.1 Gross and histological changes of spinal cord injury in a rat
1.3.4Western blot
组织和细胞样本经Bradford protein assay确定蛋白含量后,每个样本上量样为30 μg。进行SDS-PAGE后转至PDVF膜,将膜浸于5%脱脂奶粉溶液内封闭1 h,加入兔抗乙酰化-H3抗体(1∶1000,monoclone,CST,USA),4℃摇床过夜,次日用TBST液充分洗涤(5次× 5 min),HRP标记的goat anti rabbit二抗(1∶500)孵育1 h,TBST洗膜(5次× 5 min),发光液作用3 min,暗室曝光,Bio-Rad图像处理。
1.4 统计学方法
2 结果
2.1 BoNT/A重链的促神经突起生长与细胞内H3乙酰化水平相匹配
将不同浓度的BoNT/A 重链加入Neuro-2a细胞培养不同时间可见细胞突起生长明显增长,尤以浓度为1 nmol/L时作用最为显著。24,48,72 h三个时间点的突起测定结果显示,1 nmol/L浓度时神经突起增长的长度约是对照组细胞突起长度的2倍以上(P< 0.001)。但是,1 nmol/L浓度各时间点所测得的神经突起长度之间的差异无显著性。除此外,在重链作用下,具有突起的细胞占所计数细胞的百分比较对照组明显增加,以浓度为1 nmol/L、作用24 h最为明显,其百分比约为对照组的2.5倍(P< 0.001)。(图2)
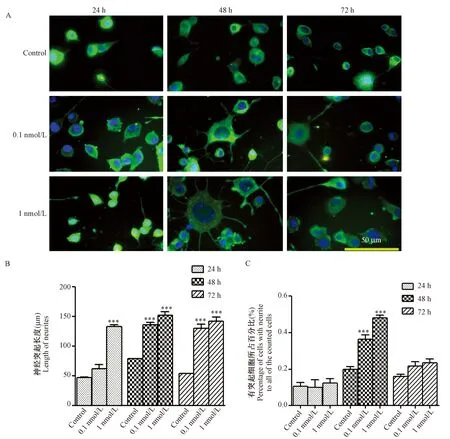
注:与同一时间段对照组相比,***P< 0.001。图2 不同浓度BoNT/A 重链对Neuro-2a 细胞生长的影响及β-tublin免疫荧光染色(Bar=50 μm)Note. Compared with the control group at the same time point,***P< 0.001.Fig.2 The effect of BoNT/A heavy chain on the growth of Neuro-2a cells and the immunofluorescence staining of β-tubulin

注:BoNT/A HC为A型肉毒素重链;AcH3为乙酰化的组蛋白3; 与对照组相比,***P< 0.001。图3 BoNT/A 重链对Neuro-2细胞组蛋白H3乙酰化水平的影响(Bar=50 μm)Note. BoNT/A HC: Botulinum neurotoxin serotype A heavy chain. AcH3: Acetylated histone 3. Compared with the control group,***P< 0.001.Fig.3 The effect of BoNT/A heavy chain on the acetylation of H3 in the Neuro-2a cell cultures
SDS-PAGE 和Western blot 结果显示:给予BoNT/A 重链后,在不同时间段(短时程 1~8 h;长时程48~72 h),H3的乙酰化呈现双时相增多现象(图3)。第一个H3乙酰化水平增高的时间出现于重链作用后的1 h和2 h,此时H3乙酰化水平是对照组的2倍(P< 0.001);第二个H3乙酰化高峰时间点为BoNT/A重链作用后48 h,Neuro-2细胞的组蛋白H3乙酰化水平也达到对照组的2倍(P< 0.001)。
从神经突起的增长及H3乙酰化水平的变化趋势及程度可以推测,BoNT/A重链引起的Neuro-2a细胞乙酰化水平增高似乎与细胞突起生长之间有一定的内在联系。
2.2 在体应用BoNT/A 重链促进脊髓损伤局部H3乙酰化
结果显示:脊髓损伤同时给予BoNT/A重链的动物其损伤局部H3乙酰化水平较单纯损伤组明显升高。同细胞培养结果相似,脊髓组织的乙酰化水平也呈现两个时相的高峰,第一个处于给药后的2 h,第二个处于给药后2 d(48 h),其升高水平为对照组的1.5~2倍(P< 0.05)。(图4)

注:BoNT/A HC为A型肉毒素重链;与对照组相比,*P< 0.05,**P< 0.01。图4 脊髓损伤基础上给予BoNT/A重链后不同时间脊髓组织H3乙酰化变化Note. BoNT/A HC: Botulinum neurotoxin serotype A heavy chain. Compared with the control group,*P< 0.05,**P< 0.01.Fig.4 Alterations in the acetylation of histone 3 after treated with BoNT/A heavy chain based on the spinal cord injury model
3 讨论
组蛋白是真核生物染色体的基本结构蛋白,是一类小分子碱性蛋白质,有6种类型:H1、H2A、H2B、H3、H4及古细菌组蛋白,由于其结构中多为碱性氨基酸,因此可以同DNA中带负电荷的磷酸基团相互作用。H3、H4的乙酰化可打开一个开放的染色质结构,增加基因的表达。更重要的是组蛋白的乙酰化/去乙酰化可形成一种特殊的密码,被其他蛋白质识别,故可影响多种蛋白因子的功能活动[5]。研究表明[7-8],组蛋白通过乙酰化/去乙酰化相互作用参与神经系统蛋白功能的调节,组蛋白乙酰化的增强可促进某些胞内蛋白质的合成。还有研究者认为,细胞内组蛋白乙酰化,尤其是H3的乙酰化过程增强有助于神经再生[9]。
神经突起生长或损伤后的轴突再生是以胞浆内生长相关蛋白合成增加为基础的。本实验的结果表明:BoNT/A促神经轴突增长的同时,神经细胞及其组织内组蛋白3乙酰化水平同时增高,因此可以推测,组蛋白的乙酰化增强可能是BoNT/A重链促进神经突起再生的核内机制之一,通过组蛋白3的乙酰化增强机制或间接干预胞浆内多种蛋白质的合成,从而促使神经突起延长再生。然而,由于组蛋白本身在核酸序列的分布及种类不同,发生乙酰化后所涉及的表观遗传改变复杂多样,H3乙酰化与去乙酰化密切相关,因此,BoNT/A 重链干预组蛋白乙酰化的途径还需通过探讨其他组蛋白的亚类(H4, H9等)进一步证实。不同组蛋白乙酰化与神经突起再生之间的确切内在联系还需进一步澄清。
根据本实验的结果,可以推论:BoNT/A 重链可促进组蛋白3的乙酰化;在同一时间点,组蛋白3的乙酰化水平与神经突起增长的长度相一致;组蛋白3乙酰化可能是BoNT/A重链促神经突起生长的相关机制之一。
