2013年北京市药品注册形势分析
2014-10-31北京市药品审评中心100061张雪田晓娟佟利家
北京市药品审评中心(100061)张雪 田晓娟 佟利家
2013年国家食品药品监督管理总局正式成立,目前正着手对已实施了6年多的现行《药品注册管理办法》[1]进行修订。为了掌握北京市药品注册趋势和动态,现将我市2013年药品注册基本情况及近五年药品注册变化的基本趋势分析如下。
1 2013年药品注册申请情况
2013年我局全年共接收受理药品注册申请1709件,新药和仿制药申请(以下简称“注册申请”)312件,补充申请1397件。注册申请按药品类别分,化学药品(以下简称“化药”)281件,天然药物和中药(以下简称“中药”)10件,生物制品21件;按注册类别分,新药申请199件(占63.7%),仿制药申请115件(占36.8%),化学药品注册申请有较明显增加(比2012年增加51.8%),尤其1类新药有明显增加。具体见附图1,2012年相应数据见附图2。

附图1 2013年各类注册申请分布图(单位:件)
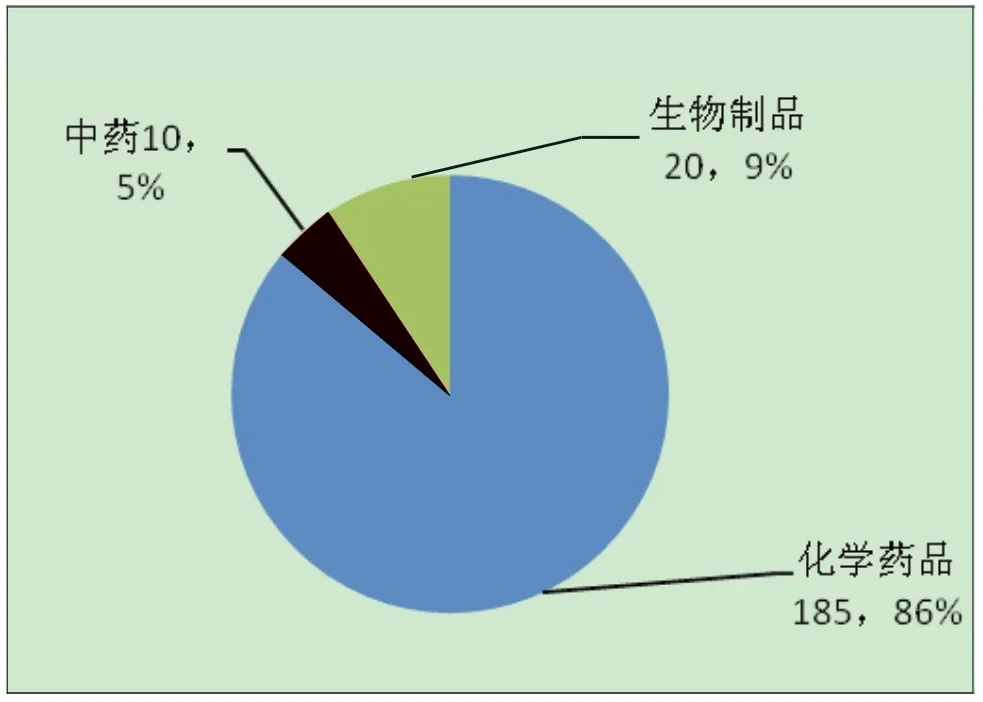
附图2 2012年各类注册申请分布图(单位:件)
与往年情况相似,化学药品注册申请以化药3类为主,共133件(占化药新药申请的82%),与2012年的104件(占化药新药申请的91.2%)相比数量有所增加;中药注册申请均为新药申请,以中药6类为主(占中药申请的60.0%),与2012年情况相似。化药1类新药20件(占化药新药申请的11.8%),较2012年有明显增加(2012年共5件,占新药申请的4.3%);生物制品1类新药7件,占生物制品申请的33.3%,与2012年相似。仿制药申请共计115件(占申请量的36.8%),其中3件是生物制品,其余均为化学药品,与前一年75件(占申请量的34.8%)相比,数量和比例均有较明显的增加,2012年仍然延续了中药仿制药零申报的状况。
2 2009年~2013年药品注册变化趋势分析
从近五年我局接收受理注册申请和补充申请统计图来看,申请数量呈上升趋势,其中2010年是接收受理申请数量最多的一年,尤其补充申请数量远远高于其他年份,全年共接收受理注册申请224件,补充申请1654件。根据数据显示,近五年受理的注册申请数量呈稳定增长趋势,平均每年受理约231件。相对于注册申请,补充申请数量波动较大,这可能与补充申请受政策导向和技术要求变化影响较大(见附图3)有关。注册申请按药品类别分,五年共受理化学药品983件,中药48件,生物制品101件。化学药品注册数量波动较大,呈上升趋势(见附图4)。中药和生物制品注册申报数量变化不明显,相对比较稳定。化学药品注册申报数量呈上升趋势,可能与市场需求状况、研发环境和水平、研发投入和风险以及政策导向等均有关系。
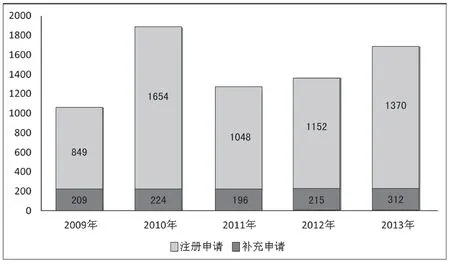
附图3 近五年北京市受理注册申请和补充申请情况(单位:件)
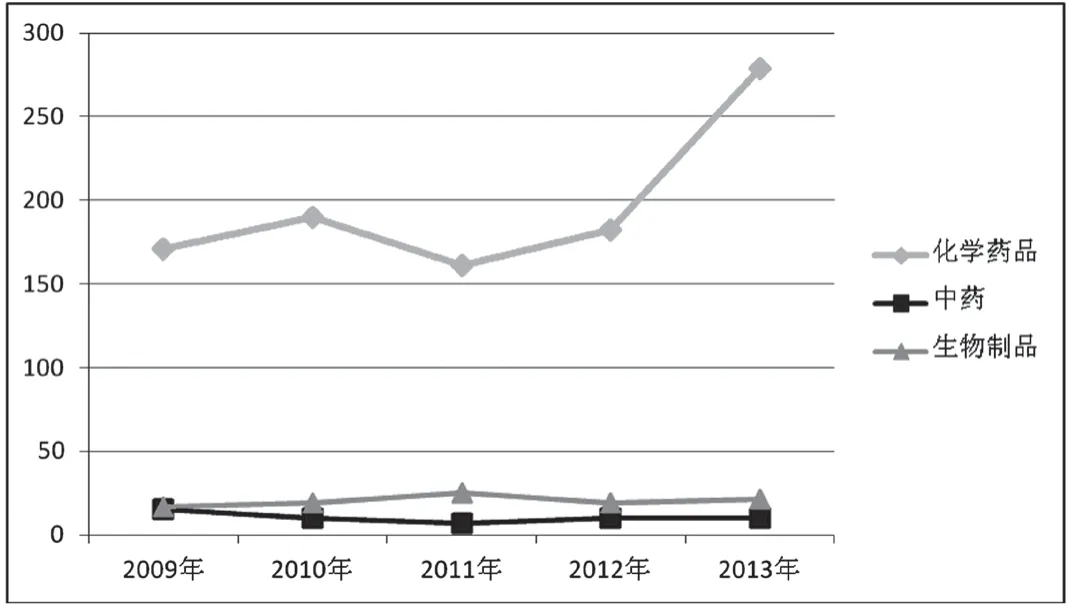
附图4 近五年北京市注册申请药品分类统计图(单位:件)
按照注册类别分,五年共受理新药申请787件(占71.9%),仿制药申请307件(占28%)。总体情况较稳定,新药申请数量变化不大,仿制药品申报数量有较明显的上升趋势,具体见附图5。
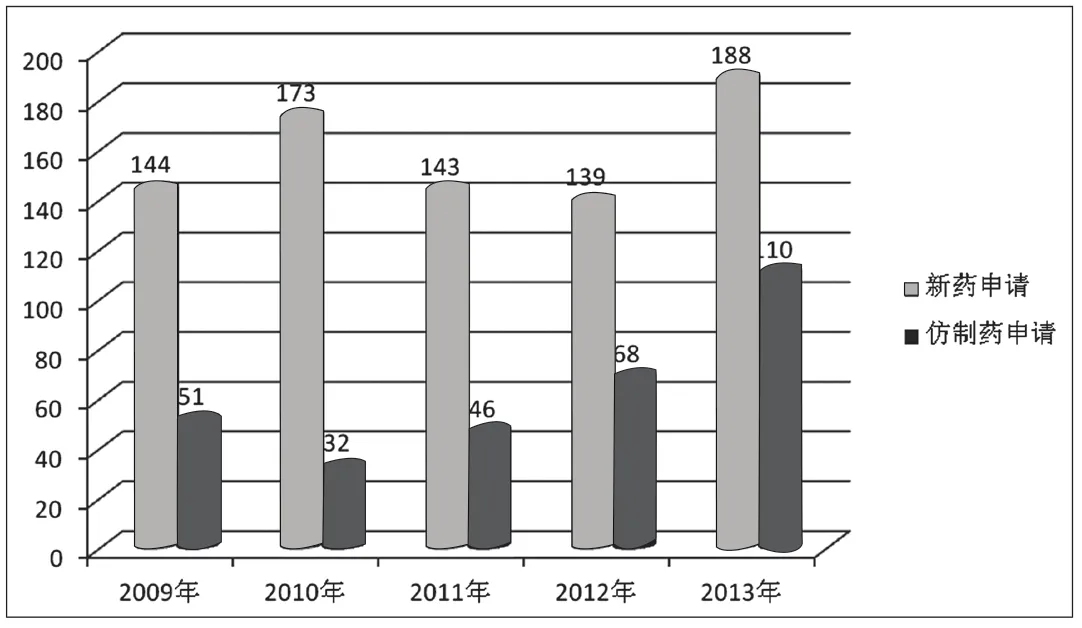
附图5 近五年北京市药品注册类别统计图(单位:件)
近五年,化学药品注册申请以化药3类为主,平均每年约受理115件,占化药新药申请的88.5%(见附表1)。

附表1 2009年~2013年北京市化学药品注册品种统计(单位:件)
中药注册申请均为新药申请,以中药6类为主,平均每年约受理6件,占中药新药申请的63.3%(见附表2)。

附表2 2009年~2013年北京市中药注册品种统计(单位:件)
生物制品各类注册申请中,数量最大的是1类新药,共26件,占生物制品申请的25.7%。在1类新药的注册申请,主要是化药和生物制品,中药1类数量较少(见附表3)。

附表3 2009年~2013年北京市药品注册1类新药申报数量(单位:件)
由于近年来化学药品申报数量比重较大,且存在一些较明显的变化,下面着重对化学药品变化趋势做一简要分析。从化学药品注册分类来看,化药1类和已有国家标准的申请上升最为显著(见附表4)。2013年化药1类注册申请数量是20件,与往年相比数量明显增加,除去存在可能申报较为集中的偶然因素外,也可能是整个创新药物研发水平和积极性提高的信号,与政府近年来对创新药的大力扶持不无关系。2013年化药6类注册申请上升至110件,比往年有明显增加。近五年仿制药品申报数量每年呈明显增加的趋势。化药6类虽然在受理后即进行生产现场检查,对申报单位来说虽存在一定的风险,但相较于新药研发需要进行临床试验来说,其投入成本和风险要小得多。
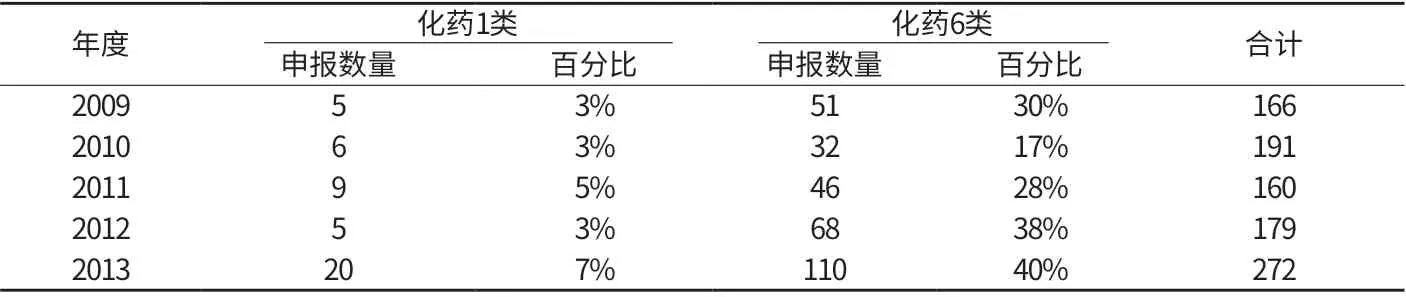
附表4 2009年~2013年北京市药品注册申请化药1类和6类申请数量(单位:件)
从近五年我局受理补充申请数量来看,每年平均受理1214件,申请事项主要是变更药品生产企业名称、修改药品说明书、变更药品生产场地、变更药品包装规格、变更原料药产地、变更药品有效期和补充说明书安全性内容等几项。总体看来,以上7项补充申请数量约占全部补充申请的75%,如附表5所示,其他未列入表中的补充申请事项,每类每年的申报数量一般低于20件。2010年发布新版GMP以来,为了满足新版GMP的要求,一些企业开始进行兼并重组或整体搬迁。因此,自2010以来,变更企业名称、变更生产场地补充申请数量大幅增加。此外,近年由于环保要求越来越高,一些原料药生产厂家受到限制,使得变更制剂原料药产地的补充申请数量处在较高的水平。见附表5。

附表5 2009年~2013年北京市药品补充申请类别分布表(单位:件)
3 2009年~2013年注册单位现状分析
近五年,北京市进行新药和仿制药注册申请的研发和生产企业数量变化不大。从数据中显示,2011年申请注册的单位数量偏少,仅有81家企业,具体见附图6。
新药和仿制药注册申报一般有三种情况:研究单位(注:只进行药品研究开发,没有药品生产资质的单位)或具备研究开发能力的生产企业单独申报,或生产企业与研究单位联合申报。五年内,研究单位单独申报总数达451件(占39%),生产企业单独申报总数达290件(占25%),联合申报数量达415件(占36%),具体见附表6。

附表6 2009年~2013年北京市新药仿制药注册各类单位申报情况(单位:件)

附图6 2009~2013年北京市注册单位数量统计图(单位:个)
近五年新药和仿制药药品注册,各单位平均申报数量呈U字型变化,有一定的波动。2011年企业申报最大量为9件,且没有企业申请数量在10件以上。2013年某生产企业共申报24件注册申请,是五年中单个企业申报数量最多的。各年上报数量五件以上的申报单位分布情况见附表7。此外,处在注册申报数量前五位的单位每年均有所不同,且各单位每年上报数量也均有不同程度的变化,即没有某个或某几个企业持续五年申报数量处在前五位。

附表7 2009年~2013年北京市新药仿制药注册申报单位申请数量分布情况
现行《药品注册管理办法》颁布之初,对药品注册工作产生了显著的影响,药品的注册类别和申报数量都有显著变化,突击申报、无序申报得到有效控制。《药品注册管理办法》已实施6年多,与之相适应,药品注册逐步趋于稳定,但也呈现出一定的变化趋势。2009~2013年,新药和仿制药申报数量呈现一定的增长趋势,尤其化药仿制药有较明显的增加。从申报单位来看,由研究单位单独申报数量逐步减少,而由药品生产企业单独申报或联合申报数量逐步增加,即渐渐显现出了以生产和市场主导药品研发的趋势。期望通过新修订的《药品注册管理办法》,能够使得药品注册更加规范理性,为人民不断增长的用药需求提供更好的保障。
