基于牛血清白蛋白偶联微球的蛋白-药物结合常数快速测定方法研究
2014-10-17贾桂颖
吕 波,贾桂颖
(天津大学药物科学与技术学院,天津 300072)
药物经给药部位吸收入血,在人体内通过与蛋白迅速可逆的结合,从而影响到药物作用的产生、发展和消除。研究药物与蛋白结合机理、结合常数、部位、作用力等不仅对药物代谢动力学,临床用药有一定意义,且对药物分子设计、新药研发也有重要指导意义。药物蛋白结合常数(Ka)是评价药物性质的重要参数,简单快速的测定Ka值,对于药物蛋白相互作用研究,药物评价与筛选具有重要意义。
Ka常见的测定方法有平衡透析法[1]、荧光光谱法[2]、亲和色谱法[3]、核磁共振分析法[4]等。这些方法都存在一定缺陷,如透析法测定周期长,且往往是单点测量,测量误差大;荧光法中蛋白不可重复利用,不利于一些昂贵的蛋白研究;亲和色谱法需要制备特殊的键合蛋白的色谱填料并进行装柱;核磁共振分析法虽获得信息量大,但是测定周期长,仪器昂贵,且不利于定量分析,对蛋白纯度要求也极高。磁性微球曾被用于药物蛋白结合常数测定[5-6],最近王秋玲等[7]将磁性微球应用于凝血酶蛋白-抑制剂解离常数的快速测定,但磁性材料其特殊性质(如含有Fe3+)容易造成非特异性吸附高、蛋白失活、测量误差大等结果。
瑞替加滨是首个开发的钾离子通道开放剂,用于成人癫痫部分发作的辅助治疗,在血药浓度0.1~2μg/mL范围内,本品约80%与血浆蛋白结合[8],但是其结合常数还未见报道。本文以非磁性微球为载体,以BSA为蛋白模型,通过筛选微球、优化蛋白偶联方法,降低了微球对药物的非特异性吸附,通过一步步探究将可能引起误差原因降至最低。最终采用一种氨基化微球用于Retigabine与BSA的结合常数测定,并与传统荧光光谱法测定结果进行对比。新方法测定准确、精密度高、方法简易、成本低、且蛋白可重复利用,对研究药物蛋白相互作用提供了新方法、新思路。
1 实验部分
1.1 试剂与仪器
瑞替加滨原料药(纯度 >99.5%),自制;牛血清白蛋白,生物级;BCA蛋白浓度测定试剂盒;无定形氨基硅胶(氨基279.16 μmol/g,40 ~60 μm);球形氨基硅胶(氨基303.28 μmol/g,5 μm);氨基聚苯乙烯微球(氨基102.36 μmol/g,5 μm);羧基聚苯乙烯微球(羧基 256.96 μmol/g,5 μm);1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC,纯度97%);N-羟基琥珀酰亚胺(NHS,纯度98%);戊二醛、氰基硼氢化钠、甲醇均为分析纯。
Waters高效液相色谱仪(包括Waters 510高压输液泵,Waters 486紫外检测器和N2000在线色谱工作站);C18色谱柱(4.6 mm ×250 mm,5 μm);970CRT荧光分光光度计;SHZ-82恒温振荡器。
1.2 牛血清白蛋白偶联微球的制备
1.2.1 EDC/NHS法 取50 mg氨基微球均匀分散于1 mL PBS缓冲液中。加入9 mg BSA,涡旋分散均匀,加入12.5 mg NHS,缓慢振摇后加入25 mg EDC,室温振荡反应2 h,用缓冲液充分洗涤,即得。
1.2.2 戊二醛交联法 取50 mg氨基微球均匀分散于 1 mL PBS 缓冲液(0.01 mol/L,pH 7.4)中,加入3 mL戊二醛水溶液(0.529 mol/L),27℃活化反应2 h。用PBS离心洗涤3次,加入2 mL BSA溶液(10 mg/mL),37℃恒温振荡反应19 h。加入50 mg氰基硼氢化钠继续反应4 h。用缓冲液充分洗涤,得蛋白偶联微球。
1.3 蛋白偶联微球应用于瑞替加滨与BSA结合研究
1 mL的EP管中加入300μL瑞替加滨溶液(0.75μmol/L),设置自由组、空白组和实验组,对应的再分别加入500μL的PBS缓冲液、空白微球PBS溶液(12.5 mg/mL)、键合蛋白微球PBS溶液(12.5 mg/mL),混合均匀后37℃恒温振荡15 min,经离心分离,用高效液相色谱法分别测定三组上清液中瑞替加滨药物浓度。改变药物浓度,重新测定,最后相应数值代入Rosenthal方程[9],计算得到瑞替加滨与BSA的结合常数。
1.4 分析方法
1.4.1 微球键合蛋白量测定 采用BCA蛋白浓度测定法。取20μL球液(50 mg/mL)与200μL工作液混合,60℃孵育30 min,13 000 r/min离心3 min。取100μL上清液,用酶标仪测定562 nm波长条件下吸光度值。同法在0~45.45 mg/L浓度范围内建立BSA标准浓度曲线。对比标准曲线计算得微球键合蛋白量。
1.4.2 高效液相色谱法测定上清液中瑞替加滨药物浓度条件 流动相甲醇∶磷酸缓冲液(0.03%,v/v,pH 2.6),比例为 70∶30(v/v),流速 0.7 mL/min,紫外检测波长252 nm,进样体积20μL。
1.4.3 荧光分光光度法测定瑞替加滨与BSA结合常数 激发波长为285 nm,在200~800 nm范围内扫描发射波长,灵敏度4,入射狭缝 10 nm,出射狭缝10 nm。
5 mL荧光比色皿中加入2.5 mL BSA溶液(1.0×10-5moL/L),连续扫描3次,加入10μL瑞替加滨溶液(1.48μmoL/L),反复吹打混合均匀后,连续扫描3次。再次重复加入药物溶液,重复上述步骤。加入药液总量不超过100μL,记录保存图谱,取374 nm波长条件下荧光强度作为计算值代入Stern-Volmer方程[10],计算得瑞替加滨与BSA的结合常数。
2 结果与讨论
2.1 不同粒子对瑞替加滨的非特异性吸附研究
空白微球会与瑞替加滨产生非特异性吸附,为了尽可能的降低非特异性吸附,减少误差,对几种常见的非磁性粒子——无定形氨基硅胶、球形氨基硅胶(SiO2-NH2)、氨基聚苯乙烯微球(PS-NH2)、羧基聚苯乙烯微球(PS-COOH)的非特异性吸附进行考察,结果见图1。

图1 不同粒子对瑞替加滨的非特异性吸附研究Fig.1 The study of nonspecific adsorption for different particles to Retigabine
由图1可知,在同一药物初始浓度(5μmol/L)下,加入相同量(6.25 mg)的空白粒子,4种粒子的非特异性吸附分别占药物初始浓度的0.33%,3.96%,8.26%,27.57%。无定形氨基硅胶对瑞替加滨几乎没有吸附,这与其表面亲水,孔径较大有关,但是无定形硅胶与蛋白键合量很低,亲水性强,后续离心操作中很容易丢失,不宜作为蛋白载体。SiO2-NH2与PS-NH2吸附量接近,PS-NH2吸附量更高,这主要是因其表面亲脂。经二步溶胀的羧基化聚苯乙烯微球空白吸附量最高,原因一是其表面亲脂,二是表面为疏松多孔结构,三在pH 7.4的PBS缓冲液条件下,其表面羧基官能团(pKa4.74)易与碱性药物瑞替加滨(pKa10.8)静电结合。综上初步确定球形氨基硅球(SiO2-NH2)与氨基化聚苯乙烯微球(PS-NH2)为测定结合常数所用微球。
2.2 EDC/NHS法与戊二醛交联法对蛋白键合量影响
考察了EDC/NHS法中蛋白浓度对蛋白偶联量的影响,结果见图2。
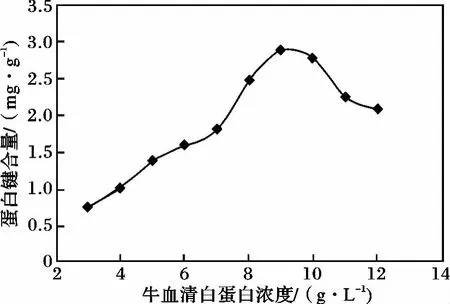
图2 EDC/NHS法中BSA浓度对蛋白键合量影响Fig.2 Effect of BSA concentration on the protein binding content for EDC/NHSmethod
由图2可知,随BSA浓度增加,蛋白键合量出现先增加后降低的趋势,PS-NH2(表面氨基量102.36 μmoL/g)最高键合量为 2.88 mg/g。初始键合量增加,是因为EDC/NHS相对过量,BSA中羧基官能团与微球上的氨基键合。蛋白浓度进一步升高,EDC/NHS不足以使过量的蛋白键合到微球表面,相反会引起BSA蛋白间的相互反应,所以键合量下降。经计算该方法的蛋白利用率仅为1.6%,表面氨基利用率为0.42‰。
戊二醛法中戊二醛浓度与蛋白浓度对蛋白偶联量影响结果见图3和图4。
由图3(蛋白浓度2 g/L)可知,随戊二醛浓度增大,蛋白键合量增加,且低浓度范围内,键合量增加显著。戊二醛浓度为0.529 moL/L(与微球表面氨基反应比例为4.1∶10)时,蛋白键合量最高。继续增大戊二醛浓度,容易使蛋白失活,且戊二醛分子两端醛基会同时与微球表面氨基反应,无法起到桥接作用,不利于蛋白键合。

图3 戊二醛浓度对蛋白键合量影响Fig.3 Effect of glutaraldehyde concentration on the protein binding content

图4 BSA浓度对蛋白键合量影响Fig.4 Effect of BSA concentration on the protein binding content
由图4(戊二醛浓度0.529 moL/L)可知,蛋白浓度在0.3~25 g/L范围内变动,蛋白键合量增势逐渐趋于平缓。这是因为戊二醛活化氨基数量有限,过高浓度蛋白也无法键合到微球表面。BSA浓度为10 g/L时,PS-NH2蛋白键合量为12.44 mg/g,SiO2-NH2可达 39.86 mg/g,均比 EDC/NHS 法高出数倍,因此,选用戊二醛法作为蛋白偶联方法。SiO2-NH2微球有最高的蛋白键合量,确定选用SiO2-NH2微球为载体。
2.3 药物蛋白相互作用结合时间考察
在瑞替加滨浓度为5μmoL/L条件下,加入6.25 mg SiO2-NH2-BSA 微球,测定2~30 min条件下药物吸附量,结果见图5。
由图5可知,起始阶段,瑞替加滨与蛋白结合急剧增加,从2 min开始,吸附逐渐变缓,后达到饱和,10 min时吸附量已不再增加。为使瑞替加滨与蛋白充分结合,同时考虑到测量时间与药物稳定性,将结合时间定为15 min。

图5 结合时间对药物吸附量影响Fig.5 Effect of bonding time on the quantity of drug adsorption
2.4 药物浓度对结合常数的影响
键合蛋白微球用量6.25 mg,测定吸附前后上清药物浓度变化,绘制等温吸附曲线,见图6。
由图6可知,瑞替加滨吸附量随药物浓度增大而增大,低浓度范围内增大较快,后逐渐平缓,达到饱和吸附。选取测量浓度应注意,一药物浓度不宜过高,否则药物相对蛋白过量,易造成吸附不完全,引起误差。二药物浓度不宜过低,否则达到紫外检测器极限,引起偶然误差。三为模拟人体环境,药物浓度应尽量与血药浓度接近,即在微摩尔每升浓度范围内。最终确定选取1.25~15μmol/L浓度范围为测定范围。
2.5 结合常数测定
在1.25~15μmol/L范围内改变瑞替加滨药物浓度,通过HPLC-UV方法测定上清浓度变化,结果见图7(药物初始浓度为7.5μmol/L),将相应数值代入Rosenthal方程:

式中 [Db]——药物与蛋白净结合浓度,mol/L;
[D']——药物与微球非特异性吸附浓度,mol/L;
Bmax——固定化蛋白活性结合位点数,mol/L;
Kd——药物与蛋白解吸附平衡常数,mol/L。
[Db]由[Dtotal]-[D']得到,[Dtotal]是药物与键合蛋白微球结合总量。以[Db]/[D']为纵轴,[Db]为横轴,绘图见图8,拟合线性方程 y=-2.09×104x+0.200 1,斜率即为瑞替加滨与牛血清白蛋白的结合常数 Ka=2.09×104L/mol。将微球用 PBS洗净干燥后连续测定3次,计算 Ka为(2.09±0.025)×104L/mol。

图7 吸附前后上清瑞替加滨液相色谱图Fig.7 Chromatogram of Retigabine of supernatant before and after adsorption

图8 瑞替加滨药物的Rosenthal曲线Fig.8 Rosenthal plots of Retigabine
2.6 荧光光谱法测定结合常数
以285 nm波长为激发光,荧光滴定结果见图9。
由图9可知,在374,695 nm处有两个最大发射峰。随着滴加药物浓度增加(箭头方向),两个波长处的荧光发射强度逐渐降低,且两峰均出现蓝移。BSA荧光发射峰与其色氨酸残基内环境有关,蓝移说明BSA腔内疏水环境的极性减弱,疏水性增强,肽链收缩。
以374 nm波长处荧光强度及对应药物浓度代入Stern-Volmer方程:

式中,F0为蛋白的初始荧光强度,F为药物浓度为[Q]时的荧光强度,[Q]为药物浓度,K为淬灭常数即药物蛋白结合常数。
拟合线性方程后得 K310.15=1.607 ×104L/mol,与SiO2-NH2微球测定结果一致。蛋白键合到微球表面有一定失活,而且荧光滴定法采用的公式不同,Ka计算值也不同,这可能是造成结果微小差别的原因。

图9 37℃下瑞替加滨与BSA结合的荧光光谱图Fig.9 Fluorescence spectra of Retigabine and BSA at 37℃
3 结论
以新型抗癫痫药物瑞替加滨与牛血清白蛋白为模板,氨基化粒子为蛋白固定载体,用高效液相色谱紫外检测法,测定了瑞替加滨与BSA的结合常数,并与传统荧光滴定方法对比,两者结果一致。微球经洗涤后仍可重复使用,且不影响测量精密度。新方法实用、便捷、经济,可用于药物蛋白结合常数的测定,为研究药物小分子与蛋白大分子相互作用提供了新方法新思路。
[1] Barre J,Chamouard JM,Houin G,et al.Equilibrium dialysis,ultrafiltration,and ultracentrifugation compared for determining the plasma-protein-binding characteristics of valproic acid[J].Clinical Chemistry,1985,31(1):60-64.
[2] Wybranowski T,Cyrankiewicz M,Ziomkowska B,et al.The HSA affinity of warfarin and flurbiprofen determined by fluorescence anisotropy measurements of camptothecin[J].Biosystems,2008,94(3):258-262.
[3] Hage D S.High-performance affinity chromatography:A powerful tool for studying serum protein binding[J].Journal of Chromatography B,2002,768(1):3-30.
[4] Ji Z S,Yuan H Z,Liu M L,et al.1H NMR study of the effect of acetonitrile on the interaction of ibuprofen with human serum albumin[J].Journal of Pharmaceutical and Biomedical Analysis,2002,30(1):151-159.
[5] Marszall M P,Buciński A,Goryński K,et al.Magnetic beads method for determination of binding of drugs to melanin[J].Journal of Chromatography A,2011,1218(2):229-236.
[6] Marszall M P,Bucinski A.A protein-coated magnetic beads as a tool for the rapid drug-protein binding study[J].Journal of Pharmaceutical and Biomedical Analysis,2010,52(3):420-424.
[7] 王秋玲,潘晓霞,吕波.磁性微球用于蛋白-抑制剂复合物解离常数的快速测定[J].应用化工,2013(5):950-954.
[8] 王丹,高颖,刘婷立,等.抗癫痫新药瑞替加滨[J].中国新药杂志,2012(5):467-469.
[9] Marszall M P,Buciński A,Kruszewski S,et al.A new approach to determine camptothecin and its analogues affinity to human serum albumin[J].Journal of Pharmaceutical Sciences,2011,100(3):1142-1146.
[10]唐金艳.光谱法研究三种药物与BSA的相互作用[D].黄石:湖北师范学院,2011.
