槲皮素-铝配合物的制备及其与BSA的结合作用
2014-10-11张怀斌陈文静刘丽娟孙艳萍
张怀斌,陈文静,张 明,刘丽娟,孙艳萍,王 丽
(1.滨州医学院(烟台校区)药学院,山东 烟台264003; 2.山东师范大学 人口资源与环境学院,山东 济南250014)
黄酮是广泛存在于自然界的一类多酚物质,具有良好的抗癌、抗炎、抗肿瘤、抗氧化、保护心脑血管等功效[1],但有动物实验表明黄酮类物质在动物体内的吸收利用率较低[2].在对黄酮类活性小分子与血清白蛋白的结合实验研究时,研究者试图通过实验对黄酮类物质体内利用率较低的问题进行解释[3],但这些解释并不能完全反映黄酮类化合物有效成分在体内的转运、代谢、贮存、药理、毒理机制,因此黄酮类物质功能成分的体内运转过程还有待进一步探究.槲皮素(Que)是一种黄酮类化合物,具有显著的生物活性,但槲皮素的水溶性极差(<7mg/L),药代动力学性质导致了生物利用度较低(<3.6%),在临床上的使用受到了很大的限制[4].槲皮素在 Que结构中存在3-羟基-4-酮,3′,4′-二羟基,5-羟基-4-酮三个配位点,可与金属离子形成稳定的配位结构,并且有的槲皮素金属配合物的医药生物活性明显高于槲皮素[4].所以近年来对槲皮素金属配合物的研究逐年增多,为槲皮素的开发利用及寻找新药开辟了新的途径.
蛋白质是药物作用的靶标,发生在生命体内的重要的生物化学过程大多数是由蛋白质介导完成的.牛血清白蛋白(BSA)与人血清白蛋白结构相似,因此常作为体外模型进行研究[5].鉴于此,本实验选取Que和铝离子(Al3+)结合形成槲皮素-铝配合物(Que-Al),探讨了Que-Al小分子与BSA的结合作用及热力学特征,为Que-Al在生物医学开发与应用方面提供一些有价值的信息.
1 实验部分
1.1 仪器与药品
756PC紫外-可见分光光度计(上海光谱仪器总厂),WQF-510FTIR红外光谱仪(北京瑞利仪器公司),LS-55荧光仪(America,PE company),pHS-3C数显酸度计(湖北科学器材公司),DK-S电热恒温水浴锅(龙口先科仪器集团).
Tris试剂,氯化钠,AlCl3,盐酸均为分析纯,购自天津试剂厂,溶剂为二次蒸馏水;牛血清白蛋白(BSA,购自国药集团,生化试剂),槲皮素(国药集团,生化试剂).用0.1mol·L-1NaCl维持离子强度,配制0.1mol·L-1Tris溶液,用HCl调节其pH为7.40,形成Tris-HCl缓冲溶液;用Tris-HCl缓冲溶液配制浓度为1.04×10-6mol·L-1的BSA溶液.
1.2 实验内容
1.2.1 槲皮素-铝配合物的制备
准确称取槲皮素0.054 1g于100mL圆底烧瓶中,在不断搅拌下缓慢加入AlCl3溶液,槲皮素与铝离子最终的物质的量之比为2∶1,充分搅拌2h,避光自然挥发干燥,测其紫外-可见吸收光谱和红外光谱.配制浓度为5.95×10-3mol·L-1的 Que-Al的甲醇溶液作为贮备液.
1.2.2 荧光测试
取3mL BSA溶液加入石英比色皿中,依次加入10μL Que-Al的甲醇溶液(加入体积<100μL,忽略体积对浓度的影响),固定激发波长为285nm,荧光发射与激发狭缝宽度比为8∶5,扫描速率为500 nm·min-1,在285K时测BSA的荧光光谱,记录最大发射峰处的荧光强度;在301K时重复上述实验.
2 结果与讨论
2.1 Que-Al配合物的表征
Que与铝离子按物质的量之比为2∶1混合,避光磁力搅拌2h,自然挥发蒸干,测其吸收光谱、红外光谱如图1A、1B所示.图1A是Que-Al的紫外-可见吸收光谱,Que在紫外区有2个吸收带分别位于256nm和373nm[6].加入铝离子后,256nm处的吸收峰红移至265nm处,而373nm处的吸收峰则蓝移到368nm处,同时在428nm处出现一个强的新的吸收峰,在304nm处出现一弱的吸收峰;图1B是Que-Al配合物的红外光谱,1 667cm-1处的C=O振动峰移到了1 641cm-1,640cm-1处Al-O键振动峰增强,这些变化均显示有配位结构的生成.根据文献[6-7]可知,当Que与Al3+的物质的量之比为2∶1时,Que中3-羟基-4-酮结构与Al3+形成了配位化合物,结构如图2所示.
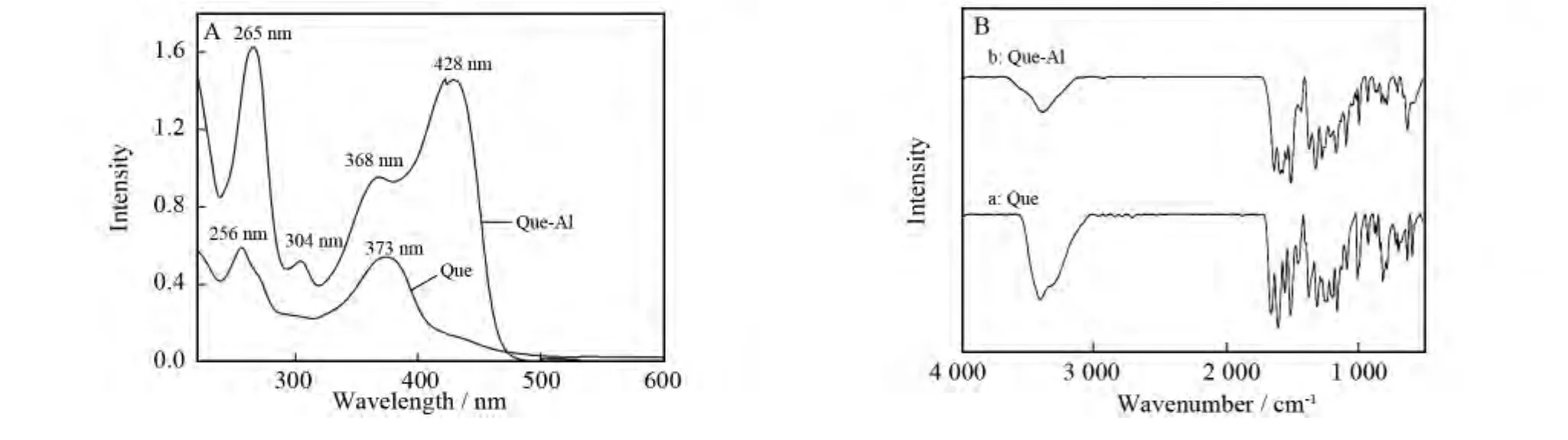
图1 Que-Al配合物的吸收光谱和红外光谱Fig.1 The absorption spectra and infrared spectra of the Que-Al complexes

图2 Que-Al配合物的结构Fig.2 The structure of the Que-Al complex
2.2 Que-Al对BSA荧光光谱的影响
图3为BSA在285K时,BSA溶液中加入Que-Al以后的荧光光谱.由图3可见,在285K时,BSA的最大发射峰位于351nm处,随着Que-Al浓度的增加BSA的荧光强度降低,最大发射峰位蓝移至348nm处,表明Que-Al与BSA之间发生了相互作用,使发色团的微环境发生了改变.
当药物小分子与蛋白质作用后会导致其荧光强度下降,这种现象称为荧光猝灭,其作用过程遵循Stern-Volmer方程[8]

式中F0和F分别表示猝灭剂不存在和存在时体系的荧光强度;Ksv为动态猝灭常数(即Stern-Volmer猝灭常数);cq为猝灭剂的浓度.由式(1)作出Que-Al对BSA荧光猝灭的Stern-Volmer曲线(图4).由直线的斜率求出Ksv(285K)=2.59×106L·mol-1,Ksv(301K)=3.58×106L·mol-1.通常,动态猝灭随温度的升高,有效碰撞加剧,猝灭常数增大[9],据此我们推测BSA与Que-Al作用的猝灭机制主要为动态猝灭.

图3 Que-Al对BSA的荧光猝灭光谱Fig.3 Fluorescence quenching spectra of BSA in the presence of Que-Al
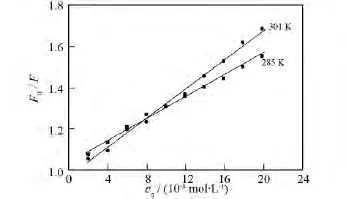
图4 Que-Al与BSA作用的Stern-Volmer曲线Fig.4 The Stern-Volmer curves of interaction between Que-Al and BSA
2.3 Que-Al与BSA的结合作用及热力学函数
生物大分子与药物小分子等的结合作用可由公式(2)表示[10]:

以lg(F0/F-1)对lgcq作图得一直线(图5),据此可求出药物小分子与BSA作用的结合常数(KA).依据热力学公式(3)、(4),当温度(T)变化不大时,结合作用的焓变(△H)可以看成一个常数,由此可求得相互作用的热力学函数(△G,△H,△S).

药物小分子和蛋白质之间的结合力有多种,主要包括氢键,疏水作用力,范德华力以及静电引力等.根据ROSS[11]等总结出的药物小分子和蛋白质作用力的结果,△H和△S都大于零时主要为疏水作用力.从表1数据可知,Que-Al与BSA之间的作用力主要是疏水作用力.反应的△G<0说明反应可以自发的进行,并且根据热力学参数△H>0,△S>0说明该反应是一个熵驱动的过程.

图5 不同温度时lgcq与lg(F0/F-1)的关系Fig.5 Plot of lgcqversus lg(F0/F-1)in the different temperatures
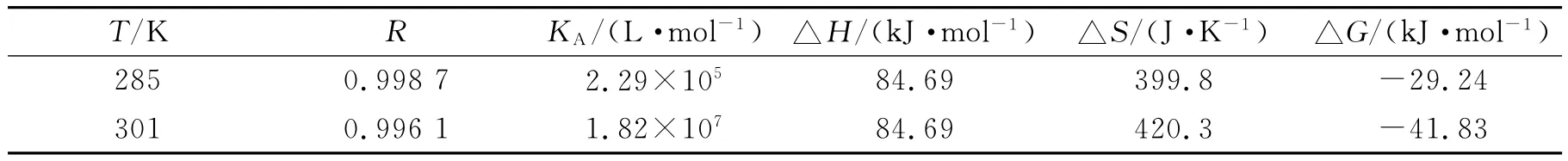
表1 不同温度下的热力学参数Table 1 The thermodynamic parameters at different temperatures
3 结论
在甲醇溶液中合成了Que-Al配合物,并用紫外-可见吸收光谱和红外光谱进行了表征;探讨了该化合物在pH=7.40Tris-HCl缓冲溶液中与BSA的相互作用.结果显示,Que-Al对BSA的荧光光谱具有猝灭作用,二者之间的作用力主要为疏水作用力.
[1]CROZIER A,DEL RIO D,CLIFFORD M N.Bioavailability of dietary flavonoids and phenolic compounds[J].Mol Aspects Med,2010,31(6):446-467.
[2]曾晓丽,谢 燕,袁秀荣.黄酮类化合物体内过程的研究进展[J].中国新药杂志,2010(9):750-754.
[3]MORRIS M E,ZHANG S.Flavonoid-drug interactions:effects of flavonoids on ABC transporters[J].Life Sci,2006,78(18):2116-2130.
[4]翟广玉,马海英,段艳丹,等.槲皮素金属配合物及其生物活性[J].信阳师范学院学报,2010,23(2):310-315.
[5]YAN C N,ZHANG H X,MEI P,et al.Study on binding reaction between flucytosine and bovine serum albumin[J].Chin J Chem,2005,23(9):1151-1156.
[6]林天乐,严宝珍,胡高飞.Al(Ⅲ)-槲皮素金属配合物的光谱分析[J].分析化学,2006,34(8):1125-1128.
[7]JEAN PAUL C,JEAN CLAUDE M.Complexes of aluminium(III)with isoquercitrin:spectroscopic characterization and quantum chemical calculations[J].Polyhedron,2002,21(27/28):2801-2810.
[8]ZHANG P J,LAN P,MA Y N,et al,Spectroscopic investigation on the interaction of Cr(VI)with bovine serum albumin[J].J biochem mole toxicol,2012,26(2):54-59.
[9]许金钩,王尊本.荧光分析法[M].北京:科学出版社,2006:64-85.
[10]张怀斌,荣先国.三价铁对灯盏花素与牛血清白蛋白相互作用的影响[J].化学研究.2013,24(3):224-227.
[11]ROSS D P,SUBRAMAIAN S E.Thermodynamics of protein association reactions:Forces contributing to stability[J].Biochemistry,1981,20(11):3096-3101.
