苦参碱对慢性心力衰竭大鼠心肌重构的干预作用△
2014-09-26郑萍张伟买淑霞姚婉霞郑捷戴贵东
郑萍,张伟,买淑霞,姚婉霞,郑捷,戴贵东
(1.宁夏医科大学 药学院,宁夏 银川 750004;2.宁夏回药现代化工程技术研究中心,宁夏 银川 750004;3.宁夏回族自治区第三人民医院,宁夏 银川 750004;4.凯里学院 化学与材料工程学院,贵州 凯里 556011)
研究开发
苦参碱对慢性心力衰竭大鼠心肌重构的干预作用△
郑萍1,2,张伟1,2,买淑霞3,姚婉霞1,2,郑捷1,2,戴贵东4*
(1.宁夏医科大学 药学院,宁夏 银川 750004;2.宁夏回药现代化工程技术研究中心,宁夏 银川 750004;3.宁夏回族自治区第三人民医院,宁夏 银川 750004;4.凯里学院 化学与材料工程学院,贵州 凯里 556011)
目的:研究苦参碱对异丙肾上腺素(isoproterenol,ISO)致慢性心力衰竭模型大鼠心室重构及心功能衰竭的干预作用。方法:Sprague-Dawley大鼠皮下注射ISO(5 mg·kg-1·d-1,连续7 d)建立大鼠慢性心衰模型,同时观察苦参碱低(25 mg·kg-1·d-1,连续7 d)、中(50 mg·kg-1·d-1,连续7 d)、高(100 mg·kg-1·d-1,连续7 d)剂量组对模型大鼠体重、心脏质量、心肌组织形态学结构、ODC/SSAT系统蛋白表达的影响。结果:各实验组大鼠体重差异无统计学意义(P>0.05)。与空白对照组相比,模型组大鼠心肌肥厚指数和血清心肌损伤标志酶显著增加,提示模型组大鼠具有显著性心肌肥厚并伴随心肌细胞坏死或凋亡;组织病理学显示模型组大鼠心肌细胞直径(CD)和横截面积(CSA)显著增加,表明大鼠心肌细胞和心肌成纤维细胞显著性肥大或增殖,心室发生重构。苦参碱低、中、高剂量组显著降低心肌肥厚指数(全心湿质量/体质量、左心室湿质量/体质量);组织病理学结果显示,苦参碱可显著减轻大鼠肥厚性心肌组织病理结构的异常改变即抑制心肌细胞肥大;与正常组相比,模型组大鼠心肌组织内ODC、SSAT蛋白含量显著提高,苦参碱低、中、高剂量组可下调模型大鼠心肌组织ODC蛋白的表达,但对SSAT含量显著升高无影响。结论:苦参碱对ISO致大鼠心力衰竭模型心室重构及心功能衰竭具有保护作用,与下调心肌组织中ODC蛋白表达、降低心肌组织内多胺的生成相关。
苦参碱;心室重构;异丙肾上腺素;鸟氨酸脱羧酶/精胺乙酰基转移酶
苦参碱是从宁夏特色回药材豆科槐属植物苦豆子SophoraalopecuroidesL.中提取的具有四环喹嗪啶类结构的生物碱之一,其分子骨架可看作2个喹嗪啶环的稠合体,分子式为C15H24N2O。国内外研究表明,苦参碱具有降血脂、抗心律失常、正性肌力、保护心肌缺血再灌注损伤等多种心血管药理作用[1-4]。苦参碱抗心室重构的相关研究目前正被很多研究者所关注。多胺包括腐胺(Pu)、精脒(Spd)、精胺(Sp),广泛存在于原核及真核生物的组织细胞中,在组织细胞的生长、发育及细胞凋亡中发挥重要的作用[5-6]。研究发现在异丙肾上腺素(ISO)诱导的心肌肥厚大鼠心组织内多胺水平显著增加,且伴随着心肌细胞的体积增大和间质纤维化。而给予多胺合成抑制剂治疗则逆转这些病理改变,表明多胺水平的增加和心肌肥厚的发生相关,能够诱导心肌细胞肥大和心肌成纤维细胞增殖以及间质纤维化,起到促进心肌肥厚的作用[7]。鸟氨酸脱羧酶(ODC)和精脒/精胺乙酰基转移酶(SSAT)为多胺合成代谢的2个关键酶,所以本研究将通过对大鼠心肌组织内ODC/SSAT等信号通路蛋白表达的测定,明确苦参碱通过对该信号转导通路发挥抗心室重构的作用。
1 材料
1.1 动物
Sprague-Dawley大鼠60只,雌雄各半,SPF级,体重(250±20)g,由宁夏医科大学实验动物中心提供,合格证号:SYXK(宁)2009-0001,预养一周后进行实验。
1.2 药品与试剂
苦参碱(宁夏紫荆花药业股份有限公司,批号:80041122,纯度:99.8%);盐酸异丙肾上腺素(美国Sigma公司);乌拉坦(Urethane,中国医药上海化学试剂公司);cTn-I ELISA检测试剂盒(美国R&D公司);全蛋白提取试剂盒、BCA蛋白定量试剂盒(南京凯基生物科技有限公司);驴抗ODC抗体、驴抗SSAT抗体(Santa Cruz公司);山羊抗兔IgG-HRP抗体(Cell Signaling公司)、山羊抗驴IgG-HRP抗体(Santa Cruz公司);增强化学发光底物反应试剂盒(Thermo scientific公司);兔抗β-actin抗体(北京博奥森公司)。
1.3 仪器
-20 ℃低温冰箱(合肥荣事达电冰箱有限公司);-80℃超低温冰箱(日本三洋电器股份有限公司);低温高速离心机(德国赫默公司);全自动酶标仪(上海Thermo Labsystems公司);Quantity One凝胶成像仪(美国Bio-Rad公司);PowerPac Basic电泳仪(美国Bio-RAD公司)。
2 方法
2.1模型的建立
SD大鼠60只,雌雄各半,随机分为5组:对照组(灌胃给予0.9%氯化钠溶液7 d;皮下注射0.9%氯化钠溶液5 mg·kg-1);模型组(灌胃给予0.9%氯化钠溶液7 d;皮下注射ISO 5 mg·kg-1);苦参碱低剂量组(25 mg·kg-1,每天1次,连续7 d)、中剂量组(50 mg·kg-1,每天1次,连续7 d)、高剂量组(100 mg·kg-1,每天1次,连续7 d)。模型组大鼠通过皮下注射ISO,每天1次,连续给药7 d,建立大鼠心力衰竭模型,实验周期为7 d。
各组大鼠于末次给药24 h后,20%乌拉坦(6 mL·kg-1,腹腔注射)麻醉。大鼠右颈总动脉取血,室温下静置1 h,低温离心(4 ℃,3 500 r·min-1,10 min)分离血清,-80 ℃保存,待测。开胸摘取心脏,剪去心耳及周围结缔组织,用预冷的0.9%氯化钠溶液清洗,滤纸吸干水分,用电子天平准确称量全心湿质量、左心室(包括室间隔)质量,计算全心湿质量/体质量、左心室湿质量/体质量。取心尖部,用4%多聚甲醛溶液固定,其余左心室组织置于液氮中速冻后,转入-80 ℃冰箱保存备用。
2.2 心肌组织形态学检测
将固定于4%多聚甲醛溶液的心肌组织石蜡包埋(制片过程中,统一将左心室朝上,即面向实验操作者,用手术刀切下心尖,包埋时切面朝向不锈钢模具底面,模具横向放置,左心室方向朝向左侧,切片方向为左心室至右心室方向)切片4 μm,常规HE染色,光镜下观察心肌细胞及心肌间质的变化。用Image-Pro Plus 6.0软件分析测量400倍光镜下HE染色图片中每个心肌细胞跨核的最窄直径和心肌细胞横截面积(每只动物取1张切片,每张切片观察6个视野,取测量均值)。
2.3 Western blotting检测
每100 mg经液氮研磨的心肌组织中加入0.7 mL冷裂解缓冲液,冰浴下超声破碎细胞(4 ℃,10 000 r·min-1离心10 min)取上清蛋白定量,剩余上清液加上样缓冲液沸水中水浴8 min,冷却后-20 ℃保存。取蛋白样本45 μg上样,10% SDS-PAGE凝胶电泳(初始恒压80 V,电流为20~40 mA,样本进入分离胶后提高电压至120 V,继续电泳至彻底分离),200 mA恒定电流转膜至硝酸纤维素膜,封闭液中室温摇动,封闭2 h,然后用5%封闭液稀释的特异性一抗(ODC,1∶500;SSAT,1∶200;β-actin,1∶2 000)孵育,4 ℃过夜。反应完毕后回收一抗,用PBST洗膜3次(10 min/次),将硝酸纤维素膜与辣根过氧化物酶偶联的二抗(山羊抗兔IgG-HRP抗体,1∶2 000;山羊抗驴IgG-HRP抗体,1∶4 000,用5%封闭液稀释的二抗)室温孵育2 h,反应完毕后弃二抗,PBST洗膜3次(10 min/次)。加入增强化学发光底物反应液(A、B试剂以1∶1混合),曝光胶片。胶片扫描结果经Quantity-one软件进行分析,计算净光密度值,将目的条带的光密度值与其相对应的内参β-actin的光密度值相比以校正误差,所得比值代表该目的蛋白的相对含量。
2.4 统计学处理

3 结果
3.1 苦参碱对心力衰竭大鼠体重及心脏质量的影响
大鼠初始体重和终末体重在各实验组间均无差别(P>0.05);与对照组比较,模型组大鼠心脏质量、左心室质量、全心湿质量/体质量以及左心室湿质量/体质量都显著增加(P<0.01),提示ISO可诱导大鼠发生心肌肥厚;与模型组相比,苦参碱低、中、高剂量组大鼠心脏质量、左心室质量、全心湿质量/体质量以及左心室湿质量/体质量显著降低(P<0.01或P<0.05),提示苦参碱能够预防ISO致大鼠心肌肥厚。见表1。
3.2 苦参碱对心力衰竭大鼠心肌组织病理改变的影响
心肌组织切片HE染色结果显示:对照组大鼠心肌组织无异常改变,心肌纤维排列整齐、横纹清晰、细胞核居中,间质未见血管扩张及炎性细胞的浸润;模型组大鼠心肌细胞肥大、排列紊乱,间质可见不同程度的细胞凋亡、坏死及炎性细胞浸润;苦参碱低、中、高剂量组表现为心肌细胞肥大显著减轻,伴少量炎性细胞浸润,表明苦参碱预处理显著减轻了心衰大鼠心肌组织异常改变。用Image-Pro Plus 6.0软件分析测量心肌细胞跨核的最窄直径和心肌细胞横截面积,可见苦参碱能显著减轻ISO诱导的心肌细胞肥大(P<0.01)。见表2、图1。
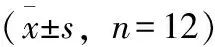
表1 苦参碱对心力衰竭大鼠体重及心肌质量的影响
注:与对照组相比,**P<0.01;与模型组相比,△P<0.05,△△P<0.01,下同

表2 苦参碱对慢性心脏衰竭大鼠心肌细胞直径和心肌细胞横截面积的影响

A.对照组 B.模型组 C.苦参碱低剂量组 D.苦参碱中剂量组 E.苦参碱高剂量组图1 苦参碱对ISO诱导慢性心力衰竭大鼠心肌组织形态的影响(HE,×400)
3.3 苦参碱对大鼠心肌组织ODC和SSAT表达的影响
与空白对照组相比,模型组大鼠心肌组织内ODC和SSAT的表达显著增高(P>0.05);与模型组相比,苦参碱低、中、高剂量组心肌组织内ODC表达显著降低,但对心肌组织内SSAT表达无影响。见图2、图3。

图2 苦参碱对心肌慢性心肌衰竭大鼠心肌组织ODC表达的影响
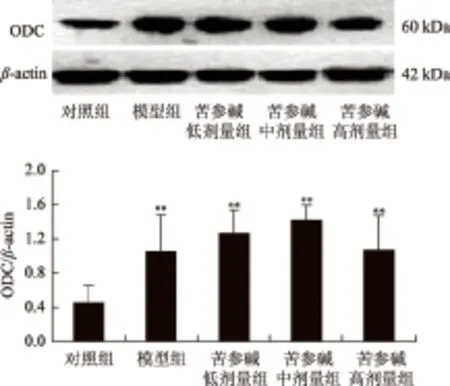
图3 苦参碱对心肌慢性心肌衰竭大鼠心肌组织SSAT表达的影响
4 讨论
依据课题组前期实验结果及相关文献[8],笔者确定了苦参碱的给药剂量。
心室重构是心肌对各种原因导致的血流动力学超负荷作出的适应性反应,是慢性心力衰竭的重要病理学特征,是多种心血管疾病的共同归宿,主要表现为心肌细胞肥大、心肌成纤维细胞增殖,并伴随着间质纤维化。心肌细胞肥大、心肌成纤维细胞增殖以及心肌细胞的凋亡是心室重构的细胞学基础,心肌纤维化是心室重构的主要病理学特征。本实验大鼠体重和心脏质量结果提示,ISO可诱导大鼠发生慢性心衰,使心肌细胞肥大,而苦参碱能够抑制并逆转大鼠心肌肥厚。病理研究结果显示,随着苦参碱剂量的增加,减轻ISO致大鼠肥厚性心肌组织病理学结构的异常改变越来越显著,其心肌细胞排列逐渐整齐,肥大心肌细胞范围变小,纤维化、间质水肿和炎细胞浸润减少,心肌细胞直径和横截面积减小,提示苦参碱对ISO致大鼠心肌肥厚的心肌组织形态结构具有保护作用,且苦参碱高剂量组对心肌肥厚的抑制作用强于中、低剂量组。
研究发现,ISO诱导的心肌肥厚大鼠心组织内多胺水平显著增加,能够诱导心肌细胞肥大和心肌成纤维细胞增殖以及间质纤维化,促进心肌肥厚[7]。张雅娟等[9-10]研究表明ISO诱导的心室重构不但表现为心肌细胞的肥大和间质成纤维细胞的增殖及其由成纤维细胞产生的大量胶原纤维,还经常伴随心肌细胞的凋亡和坏死。 ODC和SSAT为多胺合成代谢的2个关键酶,其可被多种应激事件激活,引起多胺合成增加[11]。ODC是多胺合成的初始限速酶,它催化鸟氨酸脱羧基形成腐胺,然后在SSAT的作用下依次加一个丙胺基,分别形成精脒和精胺,然后SSAT分别使精脒和精胺乙酰化形成乙酰化的多胺,最后或被排除细胞或被乙酰多胺氧化酶(APAO)氧化[12]。有研究报道表明ODC的活性可被甲状腺素以及β受体激动剂等一些刺激心肌肥厚的因子所诱导[13-15]。实际上,ODC活性提高已成为心肌肥厚形成的标志[16]。细胞水平研究也证实ODC可由β肾上腺素能受体刺激的心肌细胞肥大性反应所诱导,其诱导对β肾上腺素能受体刺激这一细胞体系的肥大性反应起主要作用[17]。SSAT极易被调控,其含量大小根据多胺含量的多少而进行调节,以维持多胺的静态平衡。研究显示[18]皮下注射ISO会使心脏ODC活性和多胺水平显著增加;进一步研究证实多胺是促进ISO介导的大鼠心肌损伤的细胞内因子之一[19]。另外在ISO诱导的心肌肥厚大鼠心肌组织中也可见ODC和SSAT蛋白表达显著增加[20]。
本实验结果显示,ISO组大鼠心肌组织内ODC和SSAT蛋白表达较对照组显著上调,这与已报道实验结果相一致,而苦参碱预防给药后则显著下调ISO组ODC蛋白表达的增多,但对SSAT含量显著性升高无影响。笔者认为苦参碱抗大鼠心肌肥厚的作用是通过下调心肌组织中ODC蛋白的表达,减少多胺的生成,抑制多胺对心肌的肥大性刺激,从而发挥抗心室重构的作用。
[1] 杨彩艳,郑萍,戴贵东,等.苦参碱对高胆固醇血症大鼠心肌缺血性损伤的保护作用[J].中草药,2008,39(6):880-884.
[2] Li X,Chu W,Liu J,et al.Antiarrhythmic properties of long-term treatment with matrine in arrhythmic rat induced by coronary ligation[J].Biol Pharm Bull,2009,32(9):1521-1526.
[3] Zhou Y,Shan H,Qiao G,et al.Inotropic effects and mechanisms of matrine,a main alkaloid from Sophora flavescens AIT[J].Biol Pharm Bull,2008,31(11):2057-2062.
[4] 李丽,于宏伟,李雪峰,等.苦参碱对大鼠缺血再灌注心肌损伤的保护作用[J].中国误诊学杂志,2009,9(3):529-530.
[5] Wang Y,Casero R A Jr.Mammalian polyamine catabolism:a therapeutic target,a pathological problem,or both?[J].J Biochem,2006,139(1):17-25.
[6] Zhao Y J,Xu C Q,Zhang W H,et al.Role of polyamines in myocardial ischemia/reperfusion injury and their interactions with nitric oxide[J].Eur J Pharmacol,2007,562(3):236-246.
[7] Tipnis U R,He G Y,Li S,et al.Attenuation of isoproterenol-mediated myocardial injury in rat by an inhibitor of polyamine synthesis[J].Cardiovasc Pathol,2000,9(5):273-280.
[8] 李南,高艳,李海讯.苦参碱对大鼠慢性酒精性肝损伤肝组织病理学影响的研究[J].北方药学,2011,(1):65-66.
[9] 张雅娟,赵玉兰,董静.替米沙坦对异丙肾上腺素所致心肌肥厚大鼠GATA4表达的影响[J].中国现代医药杂志,2011,3(2):10-12.
[10] 韩蕾,周晓辉,维伟,等.白芍总苷对不同药物诱导所致心肌重构的影响[J].辽宁中医药大学学报,2011,13(2):43-47.
[11] Shantz L M,Feith D J,Pegg A E.Targeted overexpression of ornithine decarboxylase enhances beta-adrenergic agonist-induced cardiac hypertrophy[J].Biochem J,2001,358(1):25-32.
[12] Pegg A E.Spermidine/spermine-N(1)-acetyltransferase:a key metabolic regulator[J].Am J Physiol Endocrinol Metab,2008,294(6):E995-1010.
[13] Pegg A E.Effect of a-difluoromethylornithine on cardiac polyamine content and hypertrophy[J].J Mol Cell Cardiol,1981,13(10):881-887.
[14] Bartolome J,Huguenard J ,Slotkin T A.Role of ornithine decarboxylase in cardiac growth and hypertrophy[J].Science,1980,210(4471):793-794.
[15] Cubria J C,Reguera R,Balana-Fouce R,et al.Polyamine-mediated heart hypertrophy induced by clenbuterol in the mouse[J].J Pharm Pharmacol,1998,50(1):91-96.
[16] Shimizu M,Irimajiri O,Nakano T,et al.Effect of captopril on isoproterenol-induced myocardial ornithine decarboxylase activity[J].Mol Cell Cardiol,1991,(6):665-670.
[17] Schlüter K D,Frischkopf K,Flesch M,et al.Central role for ornithine decarboxylase in beta-adrenoceptor mediated hypertrophy[J].Cardiovasc Res,2000,45(2):410-417.
[18] Boluyt M O,Long X,Eschenhagen T,et al.Isoproterenol infusion induces alterations in expression of hypertrophy-associated genes in rat heart[J].Am J Physiol,1995,269(2):H638-647.
[19] Tipnis U R,He G Y,Li S,et al.Attenuation of isoproterenol-mediated myocardial injury in rat by an inhibitor of polyamine synthesis[J].Cardiovasc Pathol,2000,9(5):273-280.
[20] Yan lin,Xu changing,Zhao yajun,et al.Effect of polyamine on cardiac hypertrophy induced by isoproterenol in rats[J].Chinese Journal of Pathophysiology,2009,25(3):417-421.
InterventionEffectofMatrineonMyocardialRemodelingofChronicHeartFailureinRats
ZHENG Ping1,2,ZHANGWei1,2,MAIShuxia1,2,YAOWanxia1,2,ZHENGJie1,2,DAIGuidong3*
(1.DepartmentofPharmacology,SchoolofPharmacy,NingxiaMedicalUniversity,Yinchuan750004,China;2.NingxiaEngineering&TechnologyResearchCenterforModernizationofHuiMedicine,Yinchuan750004,China;3.TheThirdHospitalofNingxia,Yinchuan750021,China;4.DepartmentofPharmaceuticalEngineering,SchoolofChemicalandMaterialsEngineering,KailiUniversity,Kaili556011,China)
Objective:This study was designed to explore the intervention effect of matrine on cardiac remodeling and heart failurein isoproterenol-induced chronic heart failure model in rats.Methods:Heart failure model was established in Sprague-Dawley rats by daily subcutaneous injection of isoproterenol(ISO,5 mg·kg-1·d-1)for seven days.Simultaneously,the effect to rat body weights,heart weights,myocardial tissue morphological structureand ODC/SSAT protein expression systemwere observed for matrine dosage groupon low(25 mg·kg-1·d-1for seven dayscontinuously),medium(50 mg·kg-1·d-1for seven days continuously)and high(100 mg·kg-1·d-1)level.Results:The rat body weights had no significant differences among all groups(P>0.05).Compared with the control,myocardial hypertrophy indexes and serum myocardial injury biomarker were increased,which shown that the rats in ISO group had significant myocardial hypertrophy with cell necrosis or apoptosis.Histopathological examination demonstrated that CD and CSA were significantly increased,which demonstrated that myocardial cell and cardiac fibroblasts were become hypertrophy,hyperplasia or ventricular remodeling significantly.Oral administration of matrine(25,50 or 100 mg·kg-1·d-1for 7 days respectively)significantly reduced the increased myocardial hypertrophy indexes in ISO-induced heart failure rats.Histopathological examination demonstrated that matrine could reduce the abnormal change of hypertrophic myocardium tissue pathology structurein the isoproterenol-induced heart failure rats.Compared with the control,the protein levels of ODC and SSAT in myocardial tissuewere significantly increased.Matrine(25,50,100 mg·kg-1level)treatment could significantly reducethe expression of ODCprotein,but it had no effect onthe increase of the content forSSAT in isoproterenol group.Conclusion:Matrine could protect the ventricular remodeling and cardiac function failurein ISO-induced chronic heart failure in rats,which was relative to the down-regulation of the expression for ODC protein and decrease the produce of polyamine in myocardial tissue.
Matrine;Cardiac remodeling;Isoproterenol;ODC/SSAT
2014-07-05)
教育部新世纪优秀人才支持计划(NECT-06-0916)
*
戴贵东,教授,博士,硕士生导师,研究方向:心血管药理和肿瘤药理;Tel:(0855)8558093,E-mail:daiguidong@163.com
10.13313/j.issn.1673-4890.2014.12.004
