人源化抗肝癌双链抗体纳米颗粒对荷人肝癌裸鼠放射免疫显像研究*
2014-09-20别彩群梁旭竞汤绍辉孙士敏范红梅
别彩群,梁旭竞,汤绍辉,李 萌,孙士敏,范红梅
肝癌是全球第五大常见的癌症,占所有癌症的5.6%。全球每年的新发病例约为 564,000例[1~3],其中50%以上的肝癌发生在我国。肝癌恶性程度高,总体治疗效果差,一般平均生存时间只有3个月左右。传统的治疗肝癌的手段包括外科手术治疗、肿瘤局部治疗、放射治疗、化学抗肿瘤药物治疗以及综合治疗等。尽管治疗方面有很多进展,但总体的疗效并不理想。因此,探索更有效的诊断和治疗方法是目前肝癌研究亟待解决的重点课题之一。 肝癌的分子靶向治疗研究有望成为治疗肝癌的新手段,其中新型肝癌基因工程抗体作为载体的导向治疗是未来肝癌免疫治疗的研究热点。本课题组在前期工作中已成功构建了抗肝癌噬菌体scFv库,并从中筛选出1株抗肝癌单链抗体,命名为 scFv4-16(GenBank登录号:DQ640759),经体外亲和力成熟及初步鉴定,获得了特异性较强、亲和力较高的抗肝癌单链抗体scFvDM[4]。我们完成了对该抗体进行人源化改造[5],构建和表达了单链抗体二聚体(又称双链或双价抗体),并对其进行了生物活性鉴定,获得了一株免疫原性低、亲和力高、稳定性好、活性高的抗肝癌双链抗体,被命名为BDM3[6]。纳米颗粒是通过载药微粒将治疗药物靶向导向到病灶部位,而对非靶组织、器官、细胞影响很小,从而达到精确给药的目的。在体外细胞试验,我们发现BDM3及壳聚糖包封BDM3的免疫纳米颗粒有抑制肝癌细胞增殖的作用[7]。BDM3及BDM3免疫纳米颗粒有望成为肝癌导向治疗较理想的载体。99mTc具有半衰期短、能量低等良好的物理特性。本研究将进行99mTc标记抗体,观察其在荷肝癌动物体内的靶向分布,及其对肿瘤的抑制作用,以探讨放射免疫显像诊断肝癌和靶向治疗的价值。
1 材料与方法
1.1 动物、试剂和仪器 取4~6周龄雌性BALB/c-nu裸鼠30只,由中山大学医学院动物实验中心提供;肝癌细胞株 (Bel-7402、HepG2、SMMC-7721)为本实验室贮藏;抗肝癌双链抗体及抗体纳米颗粒均为本实验室制备,等电点为5.9;壳聚糖(脱已酰度>85%,黏度=2500 cps)为济南海得贝生物技术有限公司产品;壳聚糖使用前用Co60γ-辐射(25 kGy剂量)灭菌;DMEM(Dulbecco's modified Eagle medium)细胞培养基干粉为美国Gibco公司产品,亚甲基二磷酸盐(MDP)、二氯化锡(SnCl2-H2O)及新鲜淋洗液99mTc为本院核医学科提供;使用美国CAPINTEC公司GE Infinia-Hawkeye同位素分析仪。
1.2 抗肝癌双链抗体及抗体纳米颗粒的制备 按文献
[8~10]方法进行BDM3及BDM3纳米颗粒制备。纳米粒子具体制备方法如下:离子交联法制备壳聚糖/抗体二聚体BDM3纳米粒子,称取壳聚糖6 mg,搅拌溶解于1%冰醋酸溶液6 ml中,配制得到壳聚糖溶液,将抗肝癌单链抗体二聚体BDM3分别配制成浓度为0.1、0.5、1 g/L的水溶液;分别取去离子水和不同浓度抗体二聚体溶液1 ml,加入壳聚糖溶液,调节溶液的pH,用电磁搅拌器中速搅拌5 min;磁力搅拌下缓慢滴加1 ml TPP(0.1%)水溶液,继续搅拌30 min,得到乳光液;4℃条件下,20000 r/m的转速高速离心30 min;沉淀物用蒸馏水反复洗涤,冷冻干燥,得到的白色粉末即为壳聚糖纳米粒子和壳聚糖/抗体二聚体BDM3纳米粒子。
1.3 纳米颗粒浓度、包封率及载药量的测定 将负载了不同浓度的抗肝癌单链抗体二聚体BDM的纳米粒子悬浮液用20000 r/m超速离心30 min,用BCA试剂盒测定上清液中游离的抗肝癌单链抗体二聚体BDM的量,纳米粒子对抗肝癌单链抗体二聚体BDM的包封率和载药量用以下公式计算:BDM的包封率=(投入BDM总量-游离BDM量)/投入BDM总量×100%;BDM的载药量 =已包裹BDM总量/微球总量×100%
1.4 抗肝癌抗体及抗体纳米颗粒的99mTc标记 采用99mTc预亚锡标记法[11]标记,即取亚甲基二膦酸钠冻干品 1支,内含亚甲基二膦酸钠 5 mg,二氯化锡 0.5 mg。加2 ml生理盐水溶解。分别取 5 mg抗BDM3抗体及BDM3纳米颗粒,加入上述亚甲基二膦酸钠稀释液40μl,99mTc新鲜淋洗液37MBq 0.2 ml,充分混合后,在室温下放置5 min。采用同位素分析仪检测BDM3及其纳米颗粒的99mTc标记率。
1.5 荷人肝癌裸鼠模型的建立 将30只 BALB/c-nu裸鼠随机分为3组。分别将Bel-7402、HepG2和SMMC-7721细胞消化,按1∶1∶1混匀,用DMEM细胞培养液稀释成1×107/ml,取0.1 ml接种于裸鼠左上肢腋窝皮下,2 w后肿瘤长至0.5~1 cm3时开始实验。
1.699mTc标记抗体及抗体纳米颗粒在荷人肝癌裸鼠体内的分布 将荷人肝癌裸鼠30只随机分为A、B、C三组,每组10只。A组通过腹腔注射99mTc-生理盐水,B组注射99mTc-BDM3,C组注射99mTc-BDM3纳米颗粒。在注入上述99mTc标记物后分别于1 h、4 h和8 h将裸鼠固定后置于SPECT仪下,窗宽20%,VPC6准直器,矩阵128×128,采集计数为1×105。完成图像采集后,分别处死各组裸鼠,取肿瘤、全血及肝脏、心脏、肾脏及脑,予滤纸吸干血液,分别称质量,测放射性计数,计算瘤(T)/非瘤(NT)比值。
1.7 统计学处理 所有数据用SPSS15.0 for Windows软件包进行处理,实验数据用(±s)表示,采用t检验,检验水准为α=0.05。
2 结果
2.1 抗肝癌双链抗体及抗体纳米颗粒的制备情况 抗肝癌双链抗体BDM3的等电点为5.9,浓度为1 g/L,BDM3纳米颗粒的抗体包封率为53%,每毫克壳聚糖纳米粒子含BDM3为75μg。
2.299mTc的测定情况 使用同位素分析仪检测生理盐水的99mTc标记率为90%,抗肝癌双链抗体BDM3的99mTc标记率为91%,BDM3纳米颗粒的99mTc标记率为92%。
2.3 放射性显像情况99mTc标记的抗肝癌双链抗体BDM3及抗体纳米颗粒在荷人肝癌裸鼠体内的生物学分布见表1~表3。B组在注射99mTc-BDM3后1~8 h,裸鼠肿瘤组织中均可出现放射性浓聚,其中在4 h时放射性浓集明显高于其他器官组织;C组在注射99mTc-BDM3纳米颗粒后1~8 h,裸鼠肿瘤组织中均出现较高的放射性浓聚,在4 h时放射性浓集明显高于其他器官组织;而A组在注射99mTc生理盐水后1~8 h,任何器官均无特异性放射性浓聚。C组肿瘤 /血比值在4 h最高,达到(5.63±0.26),与其他时间比较差异有统计学意义。B组和C组 20只裸鼠瘤区明确显像,显像率为100%,A组与B组T/NT比值比较差异有统计学意义(P<0.01),A组与C组T/NT比值比较差异有统计学意义(P<0.001),B组与C组T/NT比值比较差异有统计学意义(P<0.05)。4 h肿瘤显像见图1a和图1b,血液本底及其他脏器检查核素分布显著降低,与体内生物学分布测定结果一致。A组在4 h时肿瘤组织始终没有特异性核素浓聚(图1c)。
表1 荷肝癌裸鼠腹腔注入99mTc-BDM3后各脏器T/NT值(±s)变化
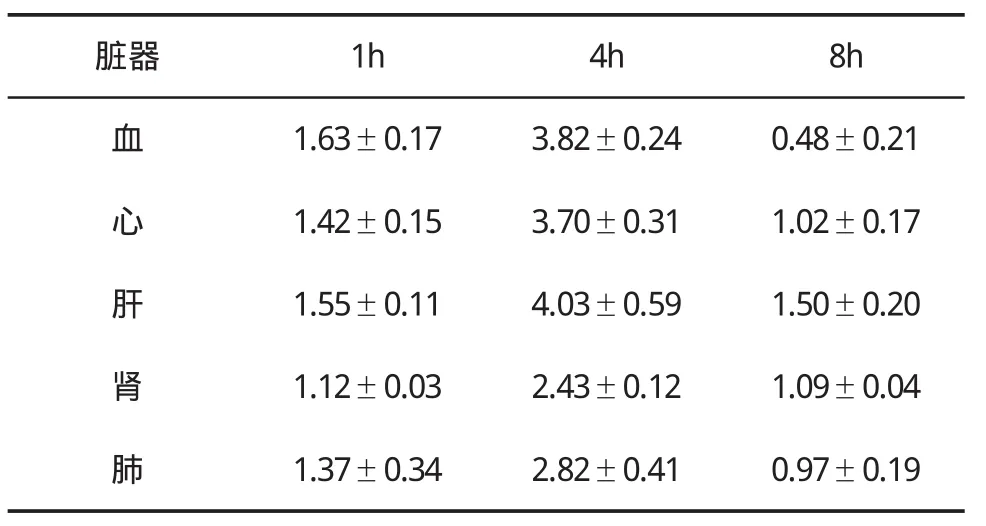
表1 荷肝癌裸鼠腹腔注入99mTc-BDM3后各脏器T/NT值(±s)变化
脏器 1h 4h 8h血1.63±0.173.82±0.240.48±0.21心1.42±0.153.70±0.311.02±0.17肝1.55±0.114.03±0.591.50±0.20肾1.12±0.032.43±0.121.09±0.04肺1.37±0.342.82±0.410.97±0.19
表2 荷肝癌裸鼠腹腔注入99mTc-BDM3纳米颗粒后各脏器T/NT值(±s)变化
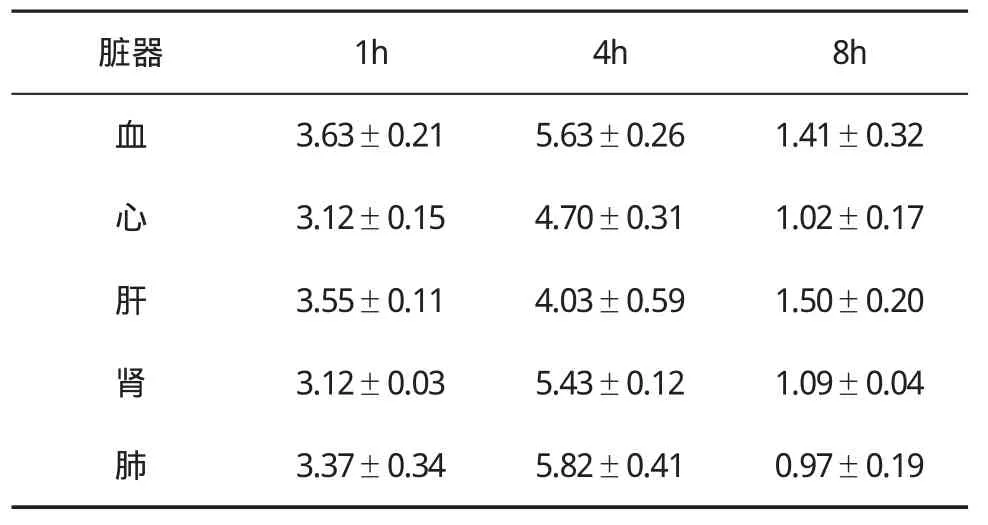
表2 荷肝癌裸鼠腹腔注入99mTc-BDM3纳米颗粒后各脏器T/NT值(±s)变化
脏器 1h 4h 8h血3.63±0.215.63±0.261.41±0.32心3.12±0.154.70±0.311.02±0.17肝3.55±0.114.03±0.591.50±0.20肾3.12±0.035.43±0.121.09±0.04肺3.37±0.345.82±0.410.97±0.19
表3 荷肝癌裸鼠腹腔注入99mTc–生理盐水后各脏器T/NT值(±s)变化
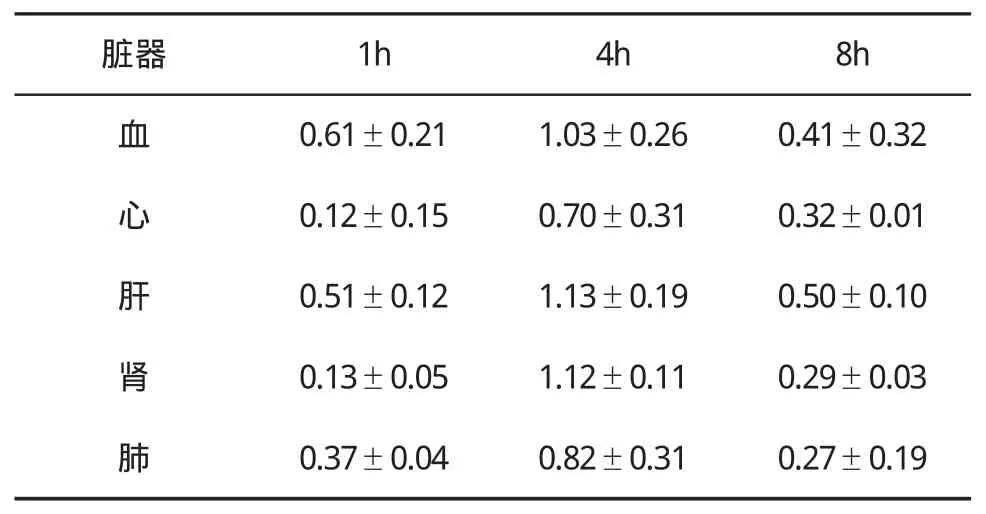
表3 荷肝癌裸鼠腹腔注入99mTc–生理盐水后各脏器T/NT值(±s)变化
脏器 1h 4h 8h血0.61±0.211.03±0.260.41±0.32心0.12±0.150.70±0.310.32±0.01肝0.51±0.121.13±0.190.50±0.10肾0.13±0.051.12±0.110.29±0.03肺0.37±0.040.82±0.310.27±0.19

图1 三组动物在腹腔注射99mTc后4 h显像情况
3 讨论
近年来,抗肿瘤抗体靶向治疗受到密切关注,用单克隆抗体及单链抗体进行放射免疫显像对肿瘤进行早期诊断及治疗在国内外已经有很多报道[12~15]。但由于完整的抗体分子量大,不容易穿透组织到达肿瘤部位,或在肿瘤组织中清除缓慢,不易到达靶组织,特别是由于单克隆抗体为鼠源性抗体,可诱发人抗鼠抗体(human anti-mouse antibody,HAMA)反应,而由于单链抗体分子量太小,只有完整抗体的1/6,存在亲和力弱、稳定性差和体内清除过快等不足,使其在人体内的应用受到不同程度的限制。
本实验室所制备的双链抗体为二价抗体,克服了单克隆及单链抗体的不足,具有亲和力好、免疫原性低、稳定性好、活性高等优点,适合肿瘤的放免显像和靶向治疗[3]。而纳米载药系统具有超微小体积,可通过人体最小的毛细血管,不易被吞噬细胞迅速清除,延长了在循环系统中的存留时间和药物的半衰期,可维持有效的血药浓度,减少给药次数,提高疗效;能够穿透组织间隙并被细胞吸收,改变生物膜运转机制,增加药物对膜的透过性,有利于吸收和细胞内药效的发挥;由于载药纳米粒子的粘附性以及小的粒径,既有利于局部用药时滞留性的增加,也有利于提高药物与肠壁的接触时间和接触面积,提高生物利用度[16~18],目前也被广泛用于靶向治疗。本研究的主要目的在于分析抗肝癌双链抗体BDM3及其纳米颗粒在荷肝癌裸鼠体内的靶肿瘤分布特性,从而为肝癌早期诊断及治疗提供一个新的途径。
本研究经腹腔分别注射99mTc-生理盐水、99mT c-BDM3和99mT c-BDM3纳米颗粒至荷肝癌裸鼠,观察 1 h、4 h和8 h肿瘤显像。在注射99mTc-BDM3和99mTc-BDM3纳米颗粒后1~8 h,裸鼠肿瘤组织中均可出现放射性浓聚,其中在4 h时裸鼠肿瘤组织中的放射性分布明显高于其他器官组织,而对照组在注射99mTc-生理盐水后1~8 h均无特异性放射性浓聚。注射99mTc-BDM3和99mT c-BDM3纳米颗粒裸鼠的显像率为100%。
本研究结果显示,同位素标记的双链抗体及双链抗体纳米颗粒均能很好地在肿瘤组织中浓聚,而在非肿瘤组织中无浓聚现象,原因考虑为该抗体为抗肝癌特异性抗体,具有明确靶向性,而抗体纳米颗粒注射组浓聚现象较抗体组更显著,考虑为抗体纳米颗粒具有双重靶向作用,能更好地聚集在肿瘤组织,增加显像效果。该结果符合我们目前肿瘤治疗的策略,既可最大限度地发挥抗肿瘤作用,同时又最大限度地减少对正常细胞的毒副作用。故本实验室制备的抗肝癌双链抗体及其纳米颗粒对肝癌组织具有很好的亲和力,可望作为肝癌诊断和治疗的靶向载体。
[1]Lai EC,Lau WY.The continuing challenge of hepatic cancer in Asia.Surgeon,2005,3(3):210-215.
[2]Bosch FX,Ribes J,Diaz M,et al.Primary liver cancer:worldwide incidence and trends.Gastroenterology,2004,127 (Suppl):S5-16.
[3]任正刚,林芷英.原发性肝癌//陈灏珠.实用内科学.12版.北京:人民卫生出版社,2005:2011-2021.
[4]Okuda K.Hepatocellular carcinoma.J Hepatol,2000,32 (suppl1):225-231.
[5]杨冬华.肝癌的免疫治疗现状及前景.中华肝脏病杂志,2003,11(12):757.
[6]卢筱华,杨冬华,周旻,等.抗肝癌单链抗体体外亲和力成熟的改造及意义.中华肝脏病杂志,2006,3:192-195.
[7]叶刚,杨冬华,汤绍辉,等.抗体库优化策略对特异性抗肝癌单链抗体的人源化.世界华人消化杂志,2008,11:1144-1150.
[8]别彩群,韩利民,王启章,等.抗肝癌抗体免疫纳米颗粒的制备及其初步应用研究.世界华人消化杂志,2010,18(13):1326-1330.
[9]Calvo P Remu án-López C,Vila-Jato JL,et al.Novel hydrophilic chitosan-polyethylene oxide nanoparticles as protein carriers.J Appl Polym Sci,1997,63:125-132.
[10]Calvo P,Remu án-López C,Vila-Jato JL,Al.et al.Chitosan and chitosan/ethylene oxidepropylene oxide block copolymer nanoparticles as novel carriers for proteins and vaccines.Pharm Res,1997,14:1431-1436.
[11]Siccardi AG,Buraggi GL,Callegaro L,et al.Multicenter study of immunoscintigraphy with radiolabeled melanoclonal antibodies inpatients with melanoma.Cancer Res,1986,46:4817-4822.
[12]张歌萌,乔宏庆,刘彦仿,等.抗肝癌抗原单链抗体在荷人肝癌裸鼠体内的放射免疫显像效果.第四军医大学学报,2003,24(14):1253-1255.
[13]Kuan CT,Reist CJ,Foulon CF,et al.125Ⅰ-labeled anti-epidermal growth factor receptor-ⅴⅢsingle-chain Fv exhibits specific and high-level targeting of glioma xenografts.Clin Cancer Res,1999,5(6):1539-1549.
[14]Chen Y,Xun Y,Huang W.Study on antibody-mediated targeting of doxorubicin-containing immune phospholipid nanoparticle against human liver cancer.China Pharmacist,2002,5:712-714.
[15]Na K,Bum Lee T,et al.Self-assembled nanoparticles of hydrophobically-modified polysaccharide bearing vitamin H as a targeted anticancer drug delivery system.Eur J Pharm Sci,2003,18:165-173.
[16]Sun QH,De Lisser HM,et al. Ⅰndividually distinct Ⅰg homology domains in PECAM-1 regulate homophilic binding and modulate receptor affinity.J Biol Chem,1996.271:1090-1098.
[17]徐祖顺,易昌凤.聚合物纳米粒子.北京,化学工业出版社,2006:15-25.
[18]张阳德,肖志刚,张浩伟.载药纳米粒在肝癌靶向治疗中的研究进展.中国医学工程,2005,13(6):609-616.
