益生菌对断奶仔猪生长性能、免疫器官指数及胃肠道pH的影响
2014-09-20张乃锋董晓丽王黎文纪守坤张立霞刁其玉
周 盟 张乃锋 董晓丽 王黎文 屠 焰 纪守坤张立霞 崔 祥 楼 灿 刁其玉*
(1.中国农业科学院饲料研究所,北京 100081;2.新疆农业大学动物科学学院,乌鲁木齐 830052;3.全国畜牧兽医总站,北京 100081)
断奶是养猪生产过程中最重要的环节之一,早期断奶可以提高母猪的生产效率,并且降低饲养成本。但是仔猪在断奶期间会由于多方面的因素而引起应激,从而导致在断奶后的第1~2周出现生长抑制,有时候还会使腹泻率增加。这些因素主要有营养因素(饲粮由易消化吸收液态的母乳变为不易消化的颗粒饲料)及环境因素(离开母猪、转群、混栏等)。新断奶的仔猪需要专门的管理和最佳的饲养环境。为了提高断奶仔猪的生长性能,仔猪饲粮中一般需添加促生长的抗生素、益生元、益生菌和酸化剂。在这些添加剂中抗生素的使用最为广泛,历史也最长。但随着抗生素的广泛使用,其弊端也日益凸显,逐渐被人们所认识。抗生素对动物生长及其产品质量的副作用主要包括:使细菌产生抗药性、造成畜禽机体的免疫力下降、引起畜禽内源性感染和二重感染、导致肉蛋奶品质下降、会在畜产品和环境中造成残留等,直接威胁到人类健康与安全。目前世界各国已采取了一定的措施,在饲料业和饲养业中限制或禁止抗生素的使用,我国农业部先后发布了168号和193号公告,就饲料中药物添加剂的使用做了明确规定。但相关研究发现,饲料中抗生素的使用量减少后,肉鸡和猪抗病能力下降,用于控制动物亚临床疾病的成本显著提高,给畜禽生产带来了一定的负面影响[1]。
益生菌不仅能通过改善肠道微生态平衡促进机体健康,而且能够减少养殖环境及粪便中氨气、硫化氢、有机磷等有害物质的含量,减少畜牧业对环境造成的污染,保护生态环境,具有明显的经济效益和社会效益。本试验通过在断奶仔猪饲粮中添加益生菌(植物乳杆菌、枯草芽孢杆菌及其复合菌),探讨益生菌对断奶仔猪生长性能、免疫器官指数及胃肠道pH的影响。
1 材料与方法
1.1 试验材料
枯草芽孢杆菌和植物乳杆菌由中国农业科学院饲料研究所家畜研究室实验室制备,活菌数≥2×109CFU/g。
1.2 试验动物及设计
采用单因素随机试验,选用128头42日龄断奶的“长×大”二元杂交健康仔猪,按性别比例一致的原则随机分为4个组,每组4个重复,每个重复8头仔猪。对照组(CT)饲喂基础饲粮(不添加抗生素和益生菌),植物乳杆菌组(LB)饲喂基础饲粮+植物乳杆菌GF103制剂[8.6×109CFU/(头·d)],枯草芽孢杆菌组(BS)饲喂基础饲粮+枯草芽孢杆菌B27制剂[2.0×108CFU/(头·d)],复合菌组(LBS)饲喂基础饲粮+植物乳杆菌 GF103制剂[4.3×109CFU/(头·d)]+枯草芽孢杆菌B27制剂[1.0×108CFU/(头·d)]。试验全期共35 d,分为2个阶段,第1阶段为第1~14天,第2阶段为第15~35天。
1.3 饲粮配方和饲养管理
仔猪基础饲粮参照猪场实际饲粮配制,基础饲粮组成及营养水平见表1。试验于北京市大兴区种猪场完成。试验猪饲养在封闭式猪舍内,自动料槽,通风良好,舍温保持在20~25℃,每天早、中、晚加3次饲料,保证自动料槽内一直有料,自由采食,自由饮水。每日清粪2次,保持舍内清洁,每周猪舍消毒2次。试验期间按照仔猪常规免疫程序进行免疫。
1.4 测定指标
1.4.1 生长性能
于试验的第1天、第15天和试验结束前08:00空腹称体重,每天记录加料量,每周称1次剩料量,计算仔猪的平均日增重、平均日采食量和料重比。
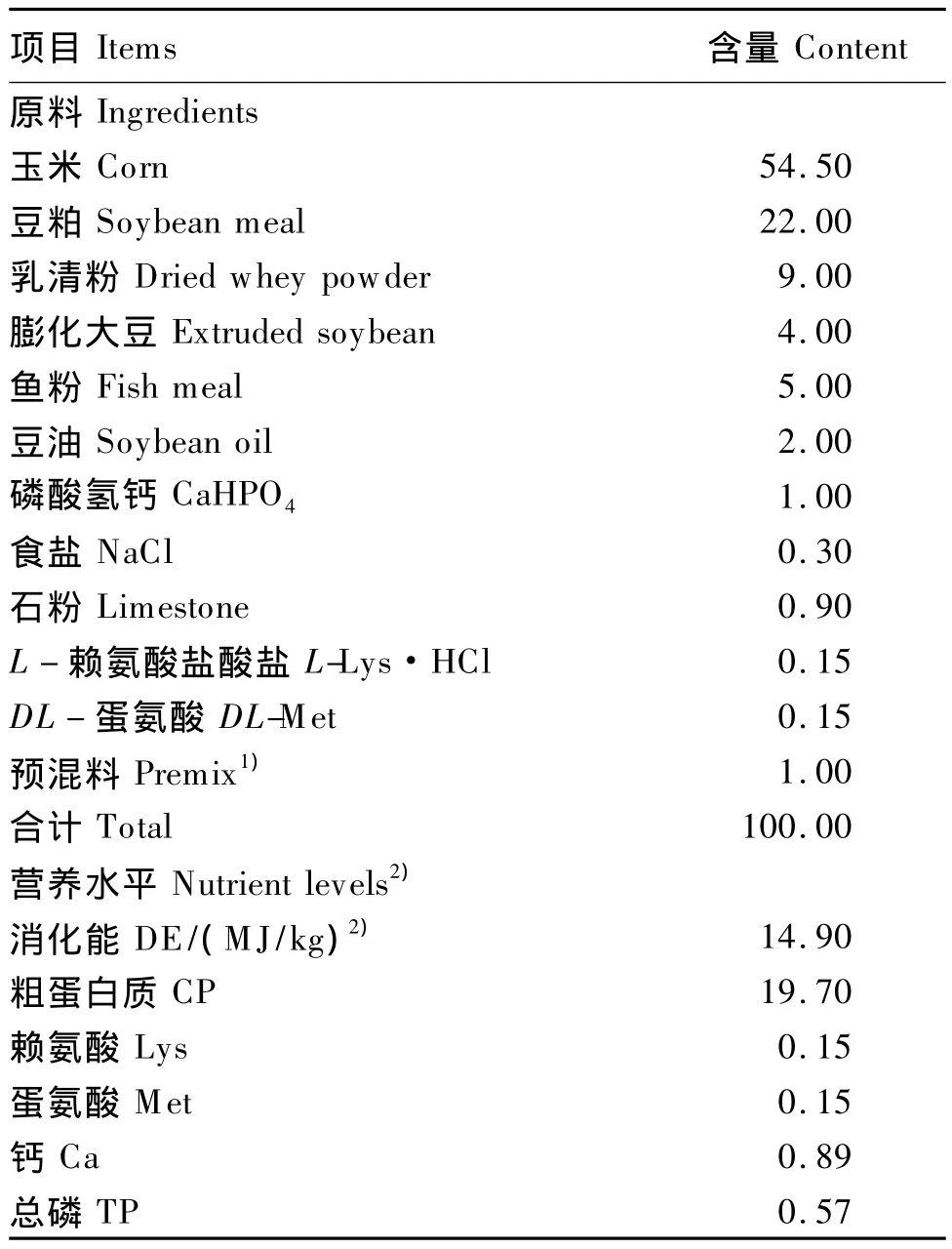
表1 基础饲粮组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of the basal diet(DM basis) %
1.4.2 消化免疫器官指数
于试验的第15天和第36天08:00空腹称重后,每组选取体重相近的4头仔猪进行屠宰试验,分别采集肝脏和脾脏,称取湿重,计算器官指数。器官指数(g/kg)=器官湿重(g)/猪活体重(kg)。
1.4.3 胃肠道pH
采用PHB-2型便携式pH计测定胃、十二指肠、空肠、回肠及盲肠内容物的pH。
1.5 数据处理
数据先用Excel 2007进行初步处理,然后用SAS 8.0进行单因素方差分析(one-way ANOVA),以P<0.05作为差异显著性判断标准。
2 结果
2.1 益生菌对断奶仔猪生长性能的影响
由表2可以看出,各组初始重差异不显著(P>0.05)。在试验的前2周,与对照组相比,各组平均日增重均无显著差异(P>0.05);各益生菌组均显著降低了平均日采食量和料重比(P<0.05),植物乳杆菌组、枯草芽孢杆菌组和复合菌组分别比对照组降低了23.27%、20.61%、15.39%及24.75%、24.75%、23.23%。在试验的第3~5周,各组平均日采食量、平均日增重和料重比均无显著差异(P>0.05)。整个试验期,各组平均日采食量和平均日增重无显著差异(P>0.05),但各益生菌组料重比显著低于对照组(P<0.05),分别降低了12.23%、10.64%、9.04%。
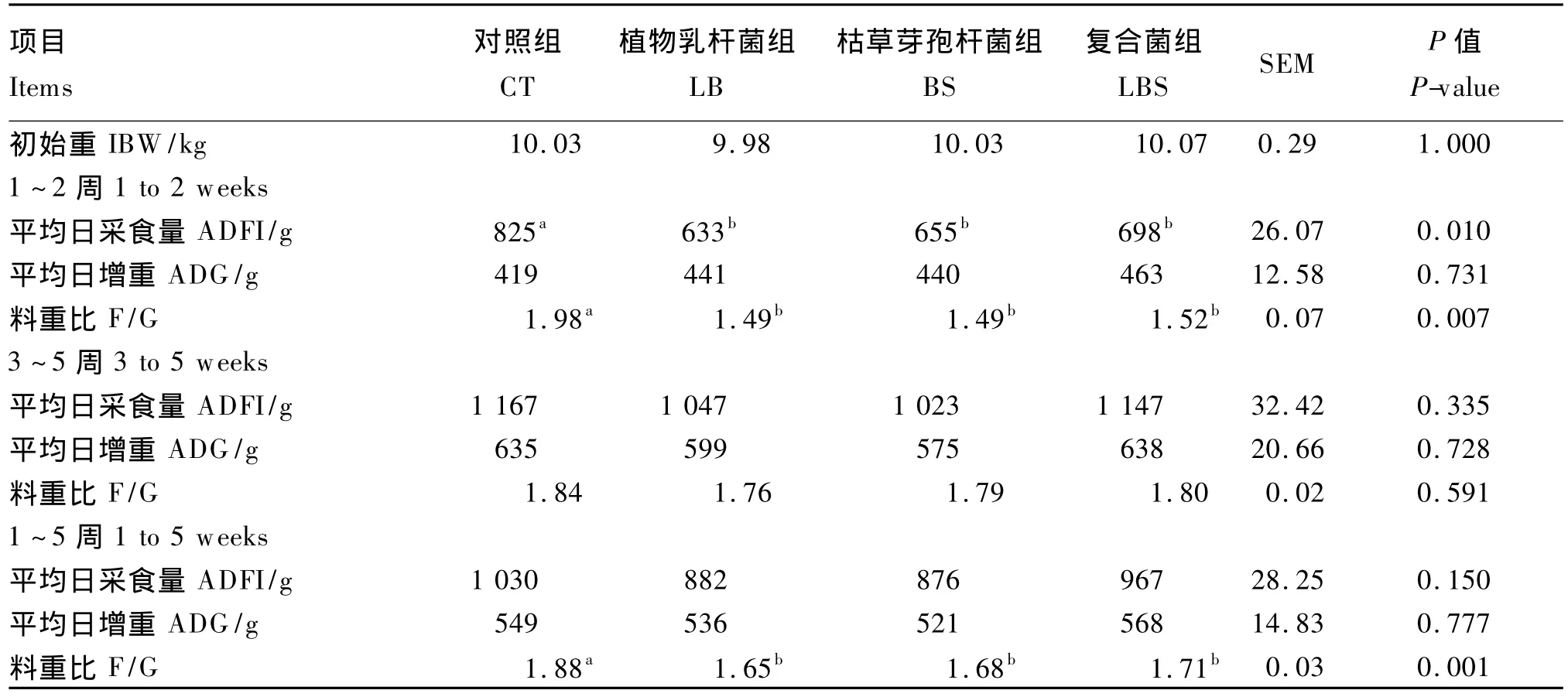
表2 益生菌对断奶仔猪生长性能的影响Table 2 Effects of probiotics on growth performance of weaner piglets(n=16)
2.2 益生菌对断奶仔猪免疫器官指数的影响
由表3可以看出,在试验的第15天,复合菌组的肝脏指数显著高于对照组、植物乳杆菌组和枯草芽孢杆菌组(P<0.05),分别提高了13.52%、12.63%和15.25%;而对照组、植物乳杆菌菌组和枯草芽孢杆菌组之间无显著差异(P>0.05);各组脾脏指数无显著差异(P>0.05),但植物乳杆菌组、枯草芽孢杆菌组和复合菌组分别比对照组提高了3.24%、25.41%、22.67%(P>0.05)。在试验的第36天,各组肝脏指数和脾脏指数无显著差异(P>0.05)。
2.3 益生菌对断奶仔猪胃肠道pH的影响
由表4可以看出,在试验的第15天,与对照组相比,复合菌组显著降低了胃和十二指肠的pH(P<0.05),分别降低了33.93%和16.50%;但各组空肠、回肠和盲肠的pH无显著差异(P>0.05);植物乳杆菌组和枯草芽孢杆菌组胃、十二指肠、空肠、回肠和盲肠的pH与对照组差异不显著(P>0.05)。在试验的第36天,各组胃、十二指肠、空肠、回肠及盲肠的 pH无显著差异(P>0.05)。
3 讨论
3.1 益生菌对断奶仔猪生长性能的影响
通常,动物在消化道内有特定的有益微生物来维持消化道内的菌群平衡,促进动物的生长和对饲料的消化吸收,但在环境和饲料组成发生改变时引起的应激会造成消化道内微生物区系的紊乱,使病原菌大量繁殖,引起消化道疾病,使动物生长受阻[2]。益生菌是一类含有活菌或其代谢产物的生物制剂,能够促进肠道有益菌的定植和优化肠道微生物区系,并且能改善宿主的消化和免疫功能。国内外大量研究发现,益生菌可以提高仔猪的采食量[3]和生长性能[4],并且提高机体免疫力[5],促进肠道益生菌的生长并抑制有害菌的生长。然而,在实际生产中,益生菌的作用并不是十分一致[6]。张董燕等[4]对断奶仔猪饲喂不同剂量的猪源罗伊氏乳酸杆菌,结果表明,添加0.50%和0.75%猪源罗伊氏乳酸杆菌组断奶仔猪平均日增重分别比对照组提高了7.56%和20.07%,料重比分别比对照组降低了1.96%和14.90%。但辛娜等[7]的研究结果表明,饲喂芽孢杆菌对断奶仔猪的平均日增重及饲料转化率均没有影响。引起益生菌对断奶仔猪产生不同作用效果的原因有很多,主要原因是试验采用的菌种及其用量不同。目前的研究多数为单一菌或同属间的复合菌,不同属间的复合菌作用效果的研究相对较少,而Rolfe[8]认为复合菌比单一菌效果更好,因为复合菌更能促进乳酸菌的增殖。

表3 益生菌对断奶仔猪免疫器官指数的影响Table 3 Effects of probiotics on immune organ indexes of weaner piglets(n=16)

表4 益生菌对断奶仔猪胃肠道pH的影响Table 4 Effects of probiotics on gastrointestinal pH of weaner piglets(n=16)
在本试验中,试验的前2周,益生菌组平均日采食量和料重比均显著低于对照组,但对平均日增重没有显著影响。这些结果表明,对断奶仔猪饲喂植物乳杆菌、枯草芽孢杆菌及其复合菌,可以使益生菌组与对照组在具有相同平均日增重的情况下,采食较少的饲料,在养殖生产中节约饲料成本。仔猪在断奶后,由于断奶应激会造成采食、饮水行为的减少[9],由应激引起的采食量下降会对仔猪的生长性能产生影响,出现生长抑制的现象[9],并且会引起小肠吸收功能的下降[10]。但在本试验中,试验的前2周各益生菌组虽然平均日采食量下降,但其生长性能未受到影响,并且料重比也比对照组显著降低。其原因可能是在本试验条件下,各组仔猪的生长性能已经达到较高水平,益生菌组在相近平均日增重的情况下提高了仔猪的饲料转化率,从而使其平均日采食量下降。这个结果与 Ross等[11]的研究结果相似,Ross等[11]向仔猪饲粮中添加食淀粉乳杆菌和肠球菌35 d后发现,在试验全期,试验组采食量均显著低于对照组,但其生长性能未受影响。
在本试验的第3~5周,益生菌组与对照组之间的平均日增重、平均日采食量和料重比均没有显著差异。同时Giang等[12]也发现,向23日龄断奶仔猪中添加不同组合的益生菌后,在试验的前2周,益生菌组能显著提高仔猪的平均日增重、平均日采食量和饲料转化率,但在试验的3~5周,各益生菌组对仔猪的平均日增重、平均日采食量及饲料转化率均无显著影响。这可能与仔猪因断奶应激所引起的肠道内变化有关[13],并且仔猪肠道也需要时间来适应其变化[14]。在断奶过程中,有一些关键的营养和环境因素促使胃肠道结构和功能发生显著变化[15-21],从而导致胃肠道结构和功能的短暂变化。Pluske等[17]将这个时期分为急性期和适应期。在急性期内,由于采食量的下降会导致肠道重量下降和黏膜厚度的降低[23],同时小肠绒毛高度显著降低[17],从而使小肠的吸收功能下降。在适应期内,仔猪采食量恢复到正常水平,主要表现为小肠、胃和大肠的重量显著增加并且超过断奶前的重量[24]。此外,肠道消化酶活性,尤其是胃蛋白酶、胰蛋白酶和α-淀粉酶活性大幅提高[25]。因此,益生菌的作用效果在试验的前2周较明显,当应激的影响减弱直到消失后,仔猪肠道功能恢复正常[13],益生菌的作用效果也会减弱[26]。
3.2 益生菌对断奶仔猪免疫器官指数的影响
益生菌在动物疾病特别是肠道感染的防治中起着重要作用,主要有以下2个方面。1)刺激机体产生抗体,提高免疫细胞的活性。马明颖等[27]的研究发现,向雏鸡饲喂益生菌后可以显著提高雏鸡血清中免疫球蛋白A(IgA)、免疫球蛋白G(IgG)、免疫球蛋白 M(IgM)的水平。司振书等[28]研究表明,饲喂微生态制剂后,10和17日龄肉鸡的脾脏T细胞百分数显著高于对照组。此外,王莉莉等[29]利用嗜酸乳杆菌细胞壁提取成分对小鼠上皮淋巴细胞共同孵育后发现小鼠淋巴细胞杀伤活性明显增强。研究表明,益生菌可以提高动物的免疫器官指数,从而提高动物机体的免疫力。2)促进免疫细胞、组织和器官生长发育。马明颖等[27]研究表明,向雏鸡饲喂微生态制剂后,法氏囊指数和脾脏指数有了显著的提高。刘克琳等[30]用微生态制剂饲喂雏鸡后,试验组免疫器官的重量均高于对照组,面积大于对照组。其胸腺的皮质较宽,皮质内T淋巴细胞明显增多,法氏囊褶皱数量多,盲肠扁桃体面积增大,表明试验组雏鸡的中枢免疫器官胸腺和法氏囊器官生长发育快和成熟度高。辛娜等[7]研究发现,添加0.75%芽孢杆菌组仔猪的胸腺指数比对照组提高了62.30%,脾脏指数提高了12.04%。在本试验条件下,试验的前2周,复合菌组可以提高仔猪的肝脏指数,且对脾脏指数没有显著影响;在试验的3~5周,各组间的免疫器官指数无显著差异,说明饲喂益生菌对断奶仔猪消化免疫器官的发育没有影响。
3.3 益生菌对断奶仔猪胃肠道pH的影响
胃肠道不但是动物机体营养物质消化吸收的场所,而且还能通过多种非特异的免疫机制和免疫防御机制,形成阻止外界环境中有害物质入侵机体的天然屏障。仔猪胃肠道酸度是影响其消化环境的重要因素,也是调节仔猪内环境酸碱平衡、电解质平衡的基础条件,适宜的酸度是维持仔猪消化系统正常生理功能的关键,尤其是断奶仔猪。但仔猪在断奶应激的条件下,仔猪肾上腺皮质酮的分泌增加,由消化道分泌的做为厌氧菌营养源的黏蛋白数量下降,结果肠道内有机酸产生减少,产酸乳酸杆菌数量减少[31],导致胃肠道内环境pH升高。而胃肠道内环境pH的升高不仅会影响消化酶的活性,还会引起大肠杆菌等病原菌的增殖[32]。研究表明,益生菌能增加仔猪肠道中挥发性脂肪酸的含量,并且降低肠道的pH[33],抑制病原菌的增殖作用[34]。
苏勇等[35]研究发现,断奶后,仔猪空肠和结肠食糜中乳酸菌和大肠杆菌的数量均明显下降,乳酸菌的下降更显著,与对照组相比,芽孢乳杆菌S1能提高断奶后仔猪空肠和结肠食糜中乳酸菌与大肠杆菌的数量比值,断奶后,仔猪结肠挥发性脂肪酸(VFA)含量明显下降,与对照组相比,试验组结肠VFA含量明显升高。陈惠等[36]和王红宁等[37]研究表明,在生长育肥猪饲粮中添加芽孢杆菌,肠道中芽杆菌、双歧杆菌、乳酸杆菌的数量均较对照组显著增加,而大肠杆菌数量显著减少。金鹿等[38]在蛋种鸡基础饲粮中分别添加 50、100、200 g/t的复合微生态制剂,饲养16周后,分3个时期比较了微生态制剂组与空白组的小肠pH和盲肠微生物区系,结果发现,试验1、2组蛋种鸡21日龄空肠和回肠的pH显著低于对照组,试验3组蛋种鸡21、42、112日龄十二指肠及42日龄空肠的pH也显著降低,微生态制剂组可以显著提高21日龄蛋种鸡盲肠乳酸菌的数量。
在本试验中,试验的前2周,复合菌组可以显著降低胃、十二指肠的pH,说明仔猪饲粮中添加复合益生菌可以维护仔猪肠道的健康。健康的仔猪胃肠道中虽然也有大肠杆菌等致病菌,但由于这些致病菌不耐酸,因此并不是优势菌群,但仔猪在受到应激时,胃肠道pH升高,导致其快速增殖从而引发肠道疾病。而饲喂益生菌可以促进动物肠道中有益菌的增殖,使肠道形成一个稳定的酸环境,从而抑制病原菌的增殖,减少肠道疾病的发生。
4 结论
本试验结果表明,益生菌在试验的前2周能够降低料重比,提高肝脏指数,降低胃、十二指肠的pH,说明益生菌在仔猪断奶的前期具有改善仔猪生长性能、节约饲料成本、维持肠道健康的作用,但随着断奶后时间的推移,其作用效果减弱。
[1]黄春玲,黄瑞华.抗生素对动物生长与动物产品质量的影响[J].饲料广角,2011(3):36-38.
[2]吴毅芳,周常义,苏国成,等.禽用微生态制剂的研究和应用现状[J].饲料研究,2010(10):12-15.
[3]王士长,陈静,潘健存,等.植物乳杆菌对断奶仔猪生产性能和血液生化指标的影响[J].中国畜牧兽医,2006,33(8):67-69.
[4]张董燕,季海峰,王晶,等.猪源罗伊氏乳酸杆菌对断奶仔猪生长性能和血清指标的影响[J].动物营养学报,2011,23(9):1553-1559.
[5]WEN K,LI G,BUI T,et al.High dose and low dose Lactobacillus acidophilus exerted differential immune modulating effects on T cell immune responses induced by an oral human rotavirus vaccine in gnotobiotic pigs[J].Vaccine,2012,30(6):1198-1207.
[6]BOMBA A,NEMCOVÁ R,MUDROÑOVÁ D,et al.The possibilities of potentiating the efficacy of probiotics[J].Trends in Food Science & Technology,2002,13(4):121-126.
[7]辛娜,刁其玉,张乃锋,等.芽孢杆菌制剂对断奶仔猪生长性能、免疫器官指数及胃肠道pH值的影响[J].饲料工业,2011,32(9):33-36.
[8]ROLFE R D.The role of probiotic cultures in the control of gastrointestinal health[J].The Journal of Nutrition,2000,130(2S):396S-402S.
[9]全炳昭,唐玉新,黄仁友,等.早期断奶应激(EWS)对仔猪影响的研究——对生长、体重、行为和发病率影响的试验观察[J].江西农业大学学报,1997,19(1):59-64.
[10]高俊杰,郝瑞荣,韩俊文.断奶应激对仔猪肠黏膜形态的影响[J].四川畜牧兽医,2003,30(3):26-28.
[11]ROSS G R,GUSILS C,OLISZEWSKI R,et al.Effects of probiotic administration in swine[J].Journal of Bioscience and Bioengineering,2010,109(6):545-549.
[12]GIANG H H,VIET T Q,OGLE B,et al.Effects of different probiotic complexes of lactic acid bacteria on growth performance and gut environment of weaned piglet[J].Livestock Science,2010,133(1/2/3):182-184.
[13]PLUSKE J R.Morphological and functional changes in the small intestine of the newly-weaned pig[M]//PIVA A,BACH KNUDSEN K E,LINDBERG J E.Gut environment of pigs.Nottingham:Nottingham U-niversity Press,2001:1-27.
[14]MCCRACKEN K J,KELLY D.Development of digestive function and nutrition/disease interactions in the weaned pig[C]//Recent Advances in Animal Nutrition in Australia.New England:University of New England,1993:182-192.
[15]MAXWELL F J,TEWAT C S.The microbiology of the gut and the role of probiotics[M]//谯仕彦,郑春田,管武太,译.断奶仔猪.北京:中国农业大学出版社,2009:243.
[16]PLUSKE J R,WILLIAMS I H,AHEME F X.Nutrition of neonatal pig[M]//谯仕彦,郑春田,管武太,译.断奶仔猪.北京:中国农业大学出版社,2009:243.
[17]PLUSKE J R,HAMPSON D J,WILLIAMS I H.Factors influencing the structure and function of the small intestine in the weaned pig:a review[J].Livestock Production Science,1997,51(1/2/3):215-236.
[18]FRUSTER D,MILLIGAN B N,PAJO E A,et al.Behavioural perspectives on weaning in domestic pig[M]//谯仕彦,郑春田,管武太,译.断奶仔猪.北京:中国农业大学出版社,2009:243.
[19]DREAU D,LALLES J P.Contribution to the study of gut hypersensitivity reactions to soybean proteins in pre-ruminant calves and early weaned piglets[J].Livestock Production Science,1999,60(2):209-218.
[20]LE DVIDICH J,SEVE B.Effects of underfeeding during the weaning period on growth,metabolism,and hormonal adjustments in the piglet[J].Domestic Animal Endocrinology,2000,19(2):63-74.
[21]STOKES C R,BAILEY M,HAVERSON K.Development and function of the pig gastrointestinal immune system[M]//LINDBERG J E,OGLE B.Digestive physiology of pigs.United Kingdom:CABI Publishing,2001:59-65.
[22]谯仕彦,郑春田,管武太,译.断奶仔猪[M].北京:中国农业大学出版社,2009:243-244.
[23]BRAGG L E,THOMPSON J S,RILLERS L F.Influence of nutrient delivery on gut structure and function[J].Nutrition,1991,7(4):237-243.
[24]JIANG R H,CHANG X Y,STOLL B,et al.Dietary plasma protein reduces small intestinal growth and lamina propria cell density in early weaned pigs[J].The Journal of Nutrition,2000,130(1):21-26.
[25]BACH KNUDSEN E,JORGENSEN H.Intestinal degradation of dietary carbohydrates-form birth to maturity[M]//谯仕彦,郑春田,管武太,译.断奶仔猪.北京:中国农业大学出版社,2009:247.
[26]HUANG C H,QIAO S Y,LI D F,et al.Effects of Lactobacilli on the performance,diarrhea incidence,VFA concentration and gastrointestinal microbial flora of weaning pigs[J].Asian-Australasian Journal of Animal Sciences,2004,17(3):401-409.
[27]马明颖,钟权,于永军.微生态制剂对雏鸡生产性能及免疫功能的影响[J].中国兽医杂志,2011,2:67-68.
[28]司振书,孟喜龙.微生态制剂对肉鸡免疫器官发育的影响[J].河南农业科学,2007(9):104-105.
[29]王莉莉,杨晓临,周正任.嗜酸性乳杆菌细胞壁提取成分对小鼠小肠上皮内淋巴细胞免疫功能的影响[J].中国微生态学杂志,1999,11(2):68-70.
[30]刘克琳,何明清,余成瑶,等.鸡微生物饲料添加剂对肉鸡免疫功能影响的研究[J].四川农业大学学报,1994,12(S1):606-612.
[31]程玲摘,译.家畜肠道细菌与生产性能的关系[J].国外畜牧科技,1995,22(2):13-16.
[32]张振斌,蒋宗勇,林映才,等.超早期断奶应激对仔猪胃肠内容物pH值和微生物区系的影响[J].养猪,1998(3):14-15.
[33]刘虎传,张敏红,李素霞,等.益生菌制剂对早期断奶仔猪肠道pH、黏膜形态结构和挥发性脂肪酸含量的影响[J].动物营养学报,2012(7):1329-1335.
[34]WANG J Q,YIN F G,ZHU C,et al.Evaluation of probiotic bacteria for their effects on the growth performance and intestinal microbiota of newly-weaned pigs fed fermented high-moisture maize[J].Livestock Science,2012,145(1/2/3):79-86.
[35]苏勇,姚文,黄瑞华,等.芽孢乳杆菌S1对断奶前后仔猪肠道乳酸菌、大肠杆菌和挥发性脂肪酸含量变化的影响[J].福建农林大学学报:自然科学版,2006,35(1):73-76.
[36]陈惠,朱继喜,吕道俊.芽孢杆菌对生长育肥猪肠道菌群及酶活性的影响[J].四川农业大学学报,1994,12(增刊):550-553.
[37]王红宁,胡廷秀,何明清,等.微生物添加剂饲喂鲤鱼肠道菌群的变化研究[J].四川农业大学学报,1994,12(增刊):654-657.
[38]金鹿,杨晓虹,任景乐,等.日粮中添加复合微生态制剂对蛋种鸡肠道pH及微生物的影响[J].中国畜牧兽医,2012,39(5):86-90.
