晶体色氨酸和包膜色氨酸对幼建鲤生长性能、蛋白质代谢及消化吸收能力影响的比较
2014-09-20孙崇岩邝声耀周小秋
唐 凌 孙崇岩 邝声耀 冯 琳,3 周小秋,3*
(1.四川农业大学动物营养研究所,温江 611130;2.四川省畜牧科学研究院动物营养研究所,成都 610099;3.鱼类营养与安全生产四川省高校重点实验室,雅安 625014)
色氨酸为普通鲤鱼等多种水生动物的必需氨基酸[1],同时是玉米蛋白粉和小麦蛋白粉等植物性蛋白质源中除赖氨酸和蛋氨酸外最重要的限制性氨基酸[2]。外源添加氨基酸是保证饲料氨基酸平衡的有效措施,但有关水生动物对合成氨基酸利用效果的报道存在差异。涂永锋等[3]研究表明,在缺乏异亮氨酸的血粉饲料中加入晶体异亮氨酸后促进了鲫鱼的生长;而王冠等[4]研究发现,在赖氨酸和蛋氨酸缺乏的饲料中加入晶体赖氨酸和晶体蛋氨酸后对异育银鲫的生长无促进作用;此外,相关研究还发现鲤鱼[5]、斑点叉尾[6]等水生动物对游离晶体氨基酸的利用效率低于对与蛋白质结合氨基酸的利用效率。鱼类对外源添加晶体氨基酸的利用效果不确定的原因通常认为是由晶体氨基酸的吸收速度过快,导致与蛋白质来源氨基酸的利用不同步[7]引起的,故对晶体氨基酸进行包膜处理是改善其利用效果的有效途径。目前,在水生动物上关于色氨酸的研究主要集中在单一形式的色氨酸对其生长性能的影响上,未见晶体色氨酸和包膜色氨酸对水生动物生长性能、蛋白质代谢和消化吸收能力影响的比较研究。因此,本试验旨在比较研究晶体色氨酸和包膜色氨酸对幼建鲤生长性能、蛋白质代谢、消化吸收能力的影响,为实际生产中色氨酸的使用提供理论指导。
1 材料与方法
1.1 试验材料
试验用晶体色氨酸(L-色氨酸)和包膜色氨酸(包膜材料为乙基纤维素)均由四川省畜科饲料有限公司提供。参考Teshima等[8]的方法,用高效液相色谱(HPLC)法测定晶体色氨酸和包膜色氨酸中色氨酸的含量分别为97.21%和32.46%。
1.2 试验饲料
以酪蛋白和明胶为主要蛋白质源,分别以晶体色氨酸和包膜色氨酸为色氨酸源配制2种试验饲料,并使得2种试验饲料的色氨酸含量均为0.25%[参考NRC(1993)鲤鱼色氨酸需要量]。试验饲料中除色氨酸以外的其他必需氨基酸模仿32%全卵鸡蛋蛋白中的氨基酸模式[9]添加,吡哆醇[10]、泛酸[11]、肌醇[12]和核黄素[13]参考本实验室得出的幼建鲤相关营养的需要量,粗蛋白质、粗脂肪、有效磷、ω-3脂肪酸、ω-6脂肪酸、微量元素和其余维生素参照NRC(1993)鲤鱼营养需要标准。试验饲料经逐步添加6.0 mol/L的氢氧化钠(NaOH)调整 pH至 7.0,制成颗粒料,储藏于-20℃的冰柜中备用。试验饲料组成及营养水平见表1。
1.3 饲养管理
试验在四川农业大学动物营养研究所水生动物营养试验场进行。鱼苗购自四川雅安鱼苗孵化场,鱼苗购回后进行30 d的驯养后开始正式饲养试验。选择初始体重为(7.73±0.03)g的健康幼建鲤300尾,随机分成2组,每组设3个重复,每个重复50尾,组间初始体重差异不显著(P>0.05)。2组试验鱼分别饲喂添加晶体色氨酸和包膜色氨酸的试验饲料。采用连续充氧的循环水系统进行养殖,放养于水族箱(长 ×宽 ×高 =90 cm×30 cm×40 cm)中。试验鱼每天饲喂6次,饲喂时间分别为 08:00、10:30、13:00、15:30、18:00、20:30,试验期60 d。试验期间定期检查水质,水体定期消毒,每天日光灯光照12 h,水温和pH分别保持在(25±3)℃和7.0±0.3。
1.4 样品收集及指标测定
每箱鱼在试验开始前和试验结束后分别称重,并记录试验期间每箱鱼的摄食量。试验开始前在试验鱼中随机选择20尾鱼-70℃保存用于初始鱼体成分的分析,试验结束后每箱随机选择5尾鱼-70℃保存用于终末鱼体成分分析,鱼体成分分析方法参考AOAC(1998)[14]的方法。最后1次饲喂6 h后,按照饲喂先后顺序每箱随机选择5尾鱼尾静脉采血,一部分放置在用肝素钠预先处理的离心管中,4℃离心(3 000×g)15 min后分离血浆并立即测定血浆中氨浓度,另一部分血样装在离心管中置于4℃冰箱中静置过夜,第2天4℃离心(3 000×g)15 min分离血清,进行分装后-20℃保存待测血清中谷草转氨酶(GOT)和谷丙转氨酶(GPT)的活力。试验结束并饥饿12 h后每箱随机选择15尾鱼解剖,分离肠道、肝胰脏和肌肉,分别称重后在液氮中快速冷冻,并保存在-70℃的冰箱中,用于肠道、肝胰脏蛋白质含量以及肠道、肝胰脏和肌肉相关酶活力指标的测定。每箱另随机选择5尾鱼,分离其肠道,参照Lin等[15]的方法测定其肠长和肠道皱襞高度。
以冰冻的生理盐水为匀浆介质,用超声波分别粉碎肠道、肝胰脏和肌肉样品,然后离心(6 000×g,4℃)20 min,收集上清液用于测定肠道、肝胰脏和肌肉相关酶活力。胰蛋白酶活力的测定参考Hummel[16]的方法,脂肪酶和淀粉酶活力的测定参考 Furné等[17]的方法。碱性磷酸酶(AKP)、γ -谷氨酰转肽酶(γ-GT)和 Na+,K+-ATP酶(Na+,K+-ATPase)活力的测定分别参考Bessey 等[18]、Rosalki 等[19]和 McCormia[20]的 方法。肠道和肝胰脏的蛋白质含量采用考马斯亮蓝法测定(试剂盒由南京建成生物工程研究所提供)。肝胰脏、肌肉和血清中GOT和GPT的活力均采用试剂盒(由BITKT临床试剂有限公司提供)进行测定,血浆中氨浓度的测定采用酶两点法(试剂盒由中生北控试剂有限公司提供)。参考López-Alvarado等[21]的方法分别测定晶体色氨酸和包膜色氨酸在 15、30、45、60、75、90、105、120、180和240 min时的体外释放速率。
1.5 计算公式
饲料系数(feed conversion ratio,FCR)=摄食量(g)/增重(g);
特定生长率(specific growth rate,SGR,%/d)=100×[ln终末体重(g)-ln初始体重(g)]/试验天数(d);
蛋白质效率(protein efficiency ratio,PER)=增重(g)/蛋白质摄入量(g);
蛋白质沉积率(protein retention rate,PRR,%)=100×体蛋白质增量(g)/蛋白质摄入量(g);
脂肪沉积率(lipid retention rate,LRR,%)=100×体脂肪增量(g)/脂肪摄入量(g);
肝体指数(hepatosomatic index,HSI,%)=100×肝胰脏重量(g)/体重(g);
肠体指数(intestosomatic index,ISI,%)=100×肠道重量(g)/体重(g);
肠长指数(intestinal length index,ILI,%)=100×肠道长(cm)/体长(cm)。

表1 试验饲料组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of experimental diets(DM basis) g/kg
1.6 数据处理与统计
试验结果以平均值±标准差表示,采用SPSS 11.5对数据进行t检验,比较组间的差异显著性,以P<0.05作为差异显著性判断标准。
2 结果
2.1 晶体色氨酸和包膜色氨酸对幼建鲤生长性能影响的比较
由表2可知,与晶体色氨酸相比,包膜色氨酸显著提高了幼建鲤的终末体重、特定生长率、蛋白质效率、蛋白质沉积率和脂肪沉积率(P<0.05),显著降低了饲料系数(P<0.05),但二者对摄食量的影响差异不显著(P>0.05)。
2.2 晶体色氨酸和包膜色氨酸对幼建鲤蛋白质代谢相关指标影响的比较
由表3可知,与晶体色氨酸相比,包膜色氨酸显著降低了血浆氨浓度以及肌肉和肝胰脏中GPT和GOT活力(P<0.05),但二者对血清中GOT和GPT活力的影响差异不显著(P>0.05)。
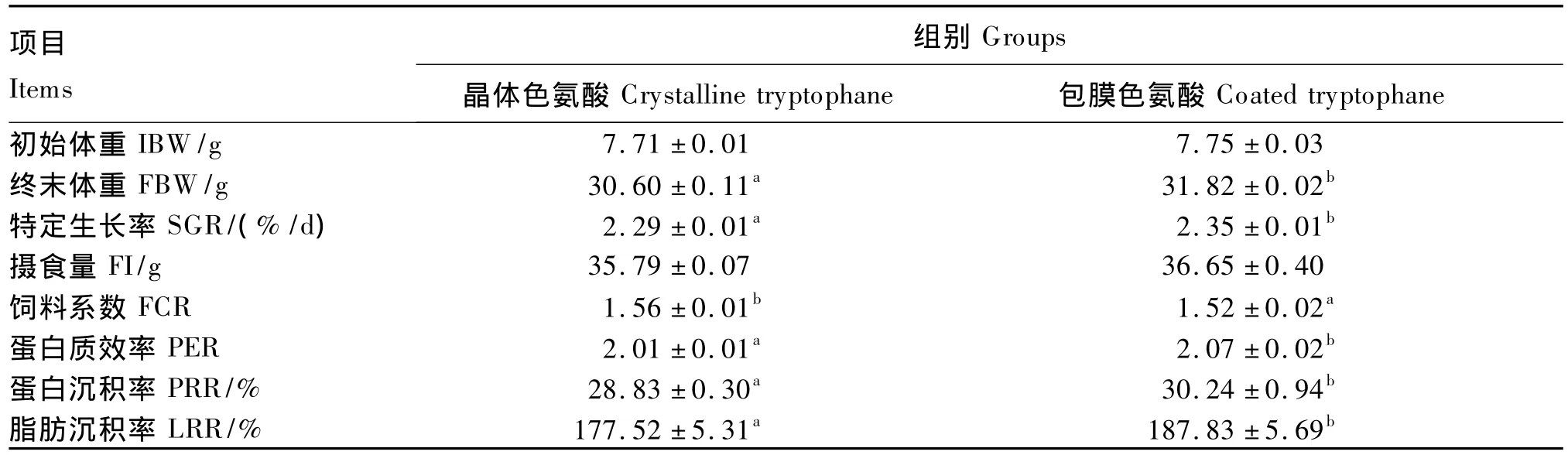
表2 晶体色氨酸和包膜色氨酸对幼建鲤生长性能影响的比较Table 2 Comparison of effects of crystalline tryptophane and coated tryptophane on growth performance of juvenile Jian carp

表3 晶体色氨酸和包膜色氨酸对幼建鲤蛋白质代谢相关指标影响的比较Table 3 Comparison of effects of crystalline tryptophane and coated tryptophane on related indices of protein metabolism of juvenile Jian carp
2.3 晶体色氨酸和包膜色氨酸对幼建鲤消化吸收能力影响的比较
2.3.1 晶体色氨酸和包膜色氨酸对幼建鲤肠道和肝胰脏生长发育指标影响的比较
由表4可知,与晶体色氨酸相比,包膜色氨酸显著提高了幼建鲤的肠长指数、肠体指数和肝体指数(P<0.05),显著增加了肠道和肝胰脏蛋白质含量(P<0.05)。

表4 晶体色氨酸和包膜色氨酸对幼建鲤肠道和肝胰脏生长发育指标影响的比较Table 4 Comparison of effects of crystalline tryptophane and coated tryptophane on growth and development indices of intestine and hepatopancreas of juvenile Jian carp %
2.3.2 晶体色氨酸和包膜色氨酸对幼建鲤肠道皱襞高度影响的比较
由表5可知,与晶体色氨酸相比,包膜色氨酸显著提高了幼建鲤的前肠、中肠、后肠皱襞高度(P<0.05)。
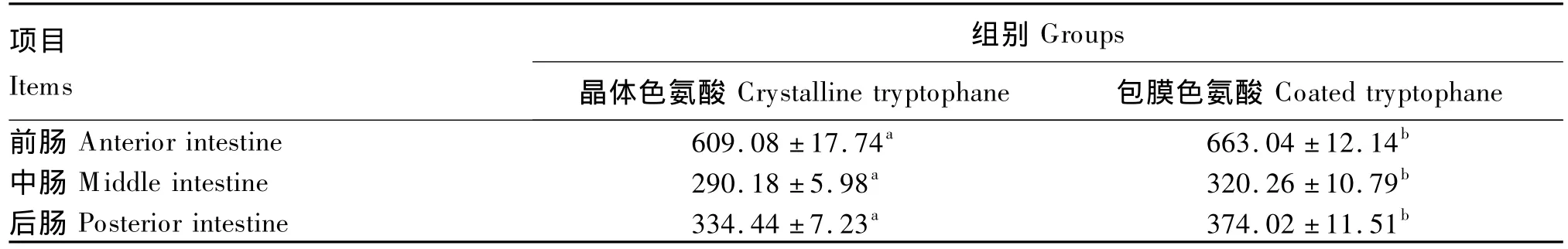
表5 晶体色氨酸和包膜色氨酸对幼建鲤肠道皱襞高度影响的比较Table 5 Comparison of effects of crystalline tryptophane and coated tryptophane on intestinal fold height of juvenile Jian carp μm
2.3.3 晶体色氨酸和包膜色氨酸对幼建鲤肠道和肝胰脏消化酶活力影响的比较
由表6可知,与晶体色氨酸相比,包膜色氨酸显著提高了幼建鲤的肠道和肝胰脏胰蛋白酶和脂肪酶活力(P<0.05),但二者对肠道和肝胰脏淀粉酶活力的影响差异不显著(P>0.05)。
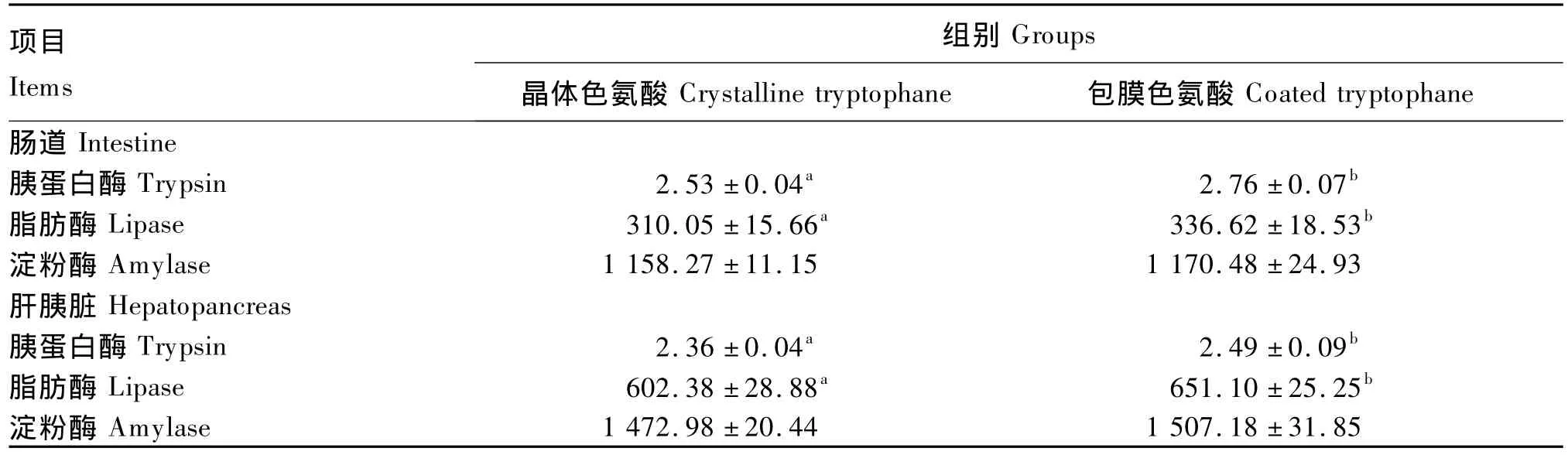
表6 晶体色氨酸和包膜色氨酸对幼建鲤肠道和肝胰脏消化酶活力影响的比较Table 6 Comparison of effects of crystalline tryptophane and coated tryptophane on digestive enzyme activities in intestine and hepatopancreas of juvenile Jian carp U/g
2.3.4 晶体色氨酸和包膜色氨酸对幼建鲤肠道刷状缘酶活力影响的比较
由表7可知,与晶体色氨酸相比,包膜色氨酸显著提高了幼建鲤中肠、后肠Na+,K+-ATP酶和γ-GT以及前肠、中肠、后肠AKP活力(P<0.05),但二者对前肠Na+,K+-ATP酶和γ-GT活力的影响差异不显著(P>0.05)。

表7 晶体色氨酸和包膜色氨酸对幼建鲤肠道刷状缘酶活力的影响Table 7 Comparison of effects of crystalline tryptophane and coated tryptophane on brush border enzyme activities in intestine of juvenile Jian carp U/g
2.4 晶体色氨酸和包膜色氨酸的体外释放速率
由表8可知,晶体色氨酸在15 min内就释放完全,而包膜色氨酸在15 min时仅释放了不到11%,但120 min后2种形式的色氨酸体外释放速率差异不显著(P>0.05)。

表8 晶体色氨酸和包膜色氨酸的体外释放速率Table 8 Release rate of crystalline tryptophane and coated tryptophan in vitro %
3 讨论
3.1 晶体色氨酸和包膜色氨酸对幼建鲤生长性能影响的比较
从本试验结果可知,与晶体色氨酸相比,包膜色氨酸显著提高了幼建鲤的特定生长率。有研究表明,与晶体赖氨酸相比,包被处理的赖氨酸促进了幼建鲤生长[22];微囊(包膜的一种形式)苏氨酸与晶体苏氨酸相比能显著提高幼建鲤的增重[23];与晶体氨基酸相比,包被处理的氨基酸能显著提高日本对虾的生长[24]。同时,本试验结果表明,与晶体色氨酸相比,包膜色氨酸显著提高了幼建鲤的饲料利用率、蛋白质沉积率和脂肪沉积率。这与本课题组在不同形式的赖氨酸[22]、苏氨酸[23]和蛋氨酸[25]对幼建鲤生长性能影响的研究上所得结果一致。饲料利用率的提高和营养物质沉积的增加可能与包膜色氨酸促进了幼建鲤肠道的生长发育以及提高肠道皱襞、增加肠道的吸收面积有关。因此,包膜色氨酸与晶体色氨酸相比能更有效地促进幼建鲤的生长,提高其饲料利用率和蛋白质、脂肪的沉积。
3.2 晶体色氨酸和包膜色氨酸对幼建鲤蛋白质代谢相关指标影响的比较
氨氮是鱼类蛋白质代谢的最主要的代谢废物[23]。在本试验中,包膜色氨酸组血浆氨浓度显著低于晶体色氨酸组,说明包膜色氨酸可能较晶体色氨酸更有利于体氮沉积。这与本课题组对晶体形式和包膜形式的赖氨酸[22]、苏氨酸[23]和蛋氨酸[25]影响幼建鲤血氨浓度的比较上的结果一致。这可能与晶体氨基酸和包膜氨基酸在体内与其他氨基酸的吸收同步性不同有关。本试验对晶体色氨酸和包膜色氨酸的体外释放速率的测定结果表明:晶体色氨酸在15 min内完全释放,而包膜色氨酸则需要180 min才能完全释放,说明包膜色氨酸对氮沉积的促进效果优于晶体氨基酸可能是由于其在体内释放速率较慢,能更有效地与其他氨基酸的吸收保持同步性,从而有利于蛋白质的合成。本课题组前期的研究发现包膜形式的赖氨酸[22]、苏氨酸[23]和蛋氨酸[25]在体外的释放速率也显著低于其晶体形式,与本研究结果一致。GOT和GPT是蛋白质代谢中最重要的2种酶,其活力的大小能反映动物体氨基酸代谢强度的大小[26]。本试验结果表明,与晶体色氨酸相比较,包膜色氨酸显著降低了幼建鲤肝胰脏和肌肉中GOT和GPT活力,虽然到目前为止未见不同形式色氨酸对鱼类肝脏或肝胰脏和肌肉中转氨酶活力影响的研究,但该结果与晶体苏氨酸和包膜苏氨酸对幼建鲤肝胰脏和肌肉中转氨酶活力的影响变化趋势一致[23],推测其可能的原因为晶体色氨酸在动物体内与其他氨基酸吸收不同步,导致大量的晶体氨基酸用于分解代谢供能,但其具体的作用机制还有待进一步研究。
3.3 晶体色氨酸和包膜色氨酸对幼建鲤消化吸收能力影响的比较
肠道是鱼类消化吸收的主要场所,肠道蛋白酶、脂肪酶和淀粉酶的活力能直接反映其对营养物质的消化能力[27]。本试验结果表明,与晶体色氨酸相比,包膜色氨酸显著提高了幼建鲤肠道胰蛋白酶、脂肪酶活力,说明包膜色氨酸能更有效地提高幼建鲤对蛋白质和脂肪的消化能力。消化能力的提高可能与其能更有效地促进幼建鲤消化器官的生长发育有关。肠道和胰腺是鱼类最主要的消化器官。本试验结果表明,与晶体色氨酸相比,包膜色氨酸显著提高了幼建鲤肠道和肝胰脏的蛋白质含量,肠长指数、肠体指数及肝体指数也显著增加,说明包膜色氨酸能更有效地促进肠道和肝胰脏的生长发育。胰腺是鱼类分泌蛋白酶和脂肪酶的主要场所,胰腺中消化酶活力的大小能反映其分泌消化酶的能力[27]。本试验结果表明,与晶体色氨酸相比,包膜色氨酸显著提高了幼建鲤肝胰脏胰蛋白酶和脂肪酶活力,说明包膜色氨酸能更有效地提高幼建鲤分泌消化酶的能力,这也是包膜色氨酸比晶体色氨酸能更有效地提高幼建鲤消化蛋白质和脂肪能力的可能原因之一。
肠道同时也是鱼类,特别是无胃鱼类吸收的主要场所[7]。肠道刷状缘酶 Na+,K+-ATP酶、AKP、γ-GT活力能有效反映鱼类对营养物质的吸收能力[27]。本试验结果表明,与晶体色氨酸相比,包膜色氨酸显著提高了幼建鲤中肠和后肠Na+,K+-ATP酶、γ-GT活力,显著提高了其前肠、中肠和后肠AKP活力。本课题组前期的研究结果表明,幼建鲤中肠、后肠刷状缘酶活力显著高于其前肠,幼建鲤吸收营养物质的最主要场所是中肠和后肠[10-12]。上述结果说明包膜色氨酸能更有效地提高幼建鲤的吸收功能。肠道皱襞高度能反映鱼类肠道的吸收面积[27]。本试验结果表明,与晶体色氨酸相比,包膜色氨酸显著提高了幼建鲤的肠道皱襞高度,从而有效增加了其肠道的吸收面积,为提高其吸收能力奠定了基础。因此,包膜色氨酸较晶体色氨酸可更有效地促进幼建鲤肝胰脏和肠道的生长发育,增加肠道的吸收面积,从而提高其对营养物质的消化和吸收能力。
4 结论
①与晶体色氨酸相比,包膜色氨酸能更有效地提高幼建鲤的生长性能。
②与晶体色氨酸相比,包膜色氨酸释放速率较低,能与体内其他氨基酸的吸收速率保持较好的同步性,能更有效地提高幼建鲤的消化吸收能力,有利于其体蛋白质的合成。
[1]NOSE T.Summary report on the requirements of essential amino acids for carp[M]//TIEWS K,HALVER J E.Finfish nutrition and fishfeed technology.Berlin:OAI,1979:145-156.
[2]COSOSO R M,TIRO L B,BENITEZ L V.Requirement for tryptophan by milkfish(Chanos chanos Forsskal)juveniles[J].Fish Physiology and Biochemistry,1992,10(1):35-41.
[3]涂永锋,叶元土,宋代军,等.游离异亮氨酸对鲫鱼的促生长作用[J].饲料工业,2004,25(8):52-55.
[4]王冠,冷向军,李小勤,等.饲料中添加包膜氨基酸对异育银鲫生长和体成分的影响[J].上海水产大学学报,2006,15(3):365-369.
[5]BOGUT I,ADAMKOVA I,RASTIJA T,et al.Effect of additive lysine to fodder on the growth of carp fry(Cyprinus carpio)and protein conservation[J].Krmiva,2000,42(2):59-64.
[6]AOKI H,AKIMOTO A,WATANABE T.Periodical changes of plasma free amino acid levels and feed digesta in yellowtail after feeding non-fishmeal diets with or without supplemental crystalline amino acids[J].Fisheries Science,2001,67(4):614-618.
[7]李爱杰.水产动物营养与饲料学[M].北京:中国农业出版社,1996.
[8]TESHIMA S,KANAZAWA A,YAMASHITA M.Dietary value of several proteins and supplemental amino acids for larvae of the prawn Penaeus japonicus[J].Aquaculture,1986,51(3/4):225-235.
[9]WILSON R P,ALLEN O W,Jr,ROBINSON E H,et al.Tryptophan and threonine requirements of fingerling channel catfish[J].The Journal of Nutrition,1978,108(10):1595-1599.
[10]HE W,ZHOU X Q,FENG L,et al.Dietary pyridoxine requirement of juvenile Jian carp(Cyprinus carpio var.Jian)[J].Aquaculture Nutrition,2009,15(4):402-408.
[11]WEN Z P,ZHOU X Q,FENG L,et al.Effect of dietary pantothenic acid supplement on growth,body composition and intestinal enzyme activities of juvenile Jian carp(Cyprinus carpio var.Jian)[J].Aquaculture Nutrition,2009,15(5):470-476.
[12]JIANG W D,ZHOU X Q,FENG L,et al.Growth,digestive capacity and intestinal microflora of juvenile Jian carp(Cyprinus carpio var.Jian)fed graded levels of dietary inositol[J].Aquaculture Research,2009,40(8):955-962.
[13]LI W,ZHOU X Q,FENG L,et al.Effect of dietary riboflavin on growth,feed utilization,body composition and intestinal enzyme activities of juvenile Jian carp(Cyprinus carpio var.Jian)[J].Aquaculture Nutrition,2010,16(2):137-143.
[14]AOAC.Official methods of analysis of AOAC international[S].16th ed.Gaithersburg,MD:AOAC International,1998.
[15]LIN Y,ZHOU X Q.Dietary glutamine supplementation improves structure and function of intestine of juvenile Jian carp(Cyprinus carpio var.Jian)[J].Aquaculture,2006,256(1/2/3/4):389-394.
[16]HUMMEL B C W.A modified spectrophotometric determination of chymotrypsin,trypsin,and thrombin[J].Canadian Journal of Physiology and Pharmacology,1959,37:1393-1399.
[17]FURNÉ M,HIDALGO M C,LÓPEA A,et al.Digestive enzyme activities in Adriatic sturgeon Acipenser naccarii and rainbow trout Oncorhynchus mykiss.A comparative study[J].Aquaculture,2005,250(1/2):391-398.
[18]BESSEY O A,LOWRY O H,BROCK M J.Rapid coloric method for determination of alkaline phosphatase in five cubic millimeters of serum[J].Journal of Biological Chemistry,1946,164:321-329.
[19]ROSALKI S B,RAU D,LEHMANN D,et al.Determination of serum gamma-glutamyl transpeptidase activity and its clinical applications[J].Annals of Clinical Biochemistry,1970,7:143-147.
[20]MCCORMIA S D.Methods for nonlethal gill biopsy and measurement of Na+,K+-ATPase[J].Canadian Journal of Fisheries and Aquatic Sciences,1993,50(3):656-658.
[21]LÓPEZ-ALVARADO J,LANGDON C J,TESHIMA S I,et al.Effects of coating and encapsulation of crystalline amino acids on leaching in larval feeds[J].Aquaculture,1994,122(4):335-346.
[22]ZHOU X Q,ZHAO C R,LIN Y.Compare the effect of diet supplementation with uncoated or coated lysine on juvenile Jian carp(Cyprinus carpio var.Jian)[J].Aquaculture Nutrition,2007,13(6):457-461.
[23]冯琳,彭艳,刘杨,等.晶体苏氨酸和微囊苏氨酸对幼建鲤生长性能和消化吸收能力影响的比较研究[J].动物营养学报,2011,23(5):771-780.
[24]ALAM M S,TESHIMA S,KOSHIO S,et al.Effects of supplementation of coated crystalline amino acids on growth performance and body composition of juvenile kuruma shrimp Marsupenaeus japonicus[J].Aquaculture Nutrition,2004,10(5):309-316.
[25]帅柯.蛋氨酸对幼建鲤消化功能和免疫功能的影响[D].硕士学位论文.雅安:四川农业大学,2006.
[26]BERGE G E,SVEIER H,LIED E.Nutrition of Atlantic salmon(Salmo salar):the requirement and metabolic effect of lysine[J].Comparative Biochemistry and Physiology Part A:Molecular&Integrative Physiology,1998,120(3):477-485.
[27]TANG L,WANG G H,ZHOU X Q,et al.Effect of methionine on intestinal enzymes activities,microflora and humoral immune of juvenile Jian carp(Cyprinus carpio var.Jian)[J].Aquaculture Nutrition,2009,15(5):477-480.
