抗血管内皮细胞抗体在大鼠肺气肿中的作用及其与甲强龙干预的关系研究
2014-09-18姚红梅张璐张程叶贤伟张湘燕马丽
姚红梅,张璐,张程,叶贤伟,张湘燕,马丽
(贵州省人民医院 呼吸与危重症医学科,贵州 贵阳 550002)
抗血管内皮细胞抗体在大鼠肺气肿中的作用及其与甲强龙干预的关系研究
姚红梅,张璐,张程,叶贤伟,张湘燕,马丽Δ
(贵州省人民医院 呼吸与危重症医学科,贵州 贵阳 550002)
目的观察抗血管内皮细胞抗体(anti-endothelial cells antibodies,AECA)在吸烟诱导的肺气肿中的作用,以及甲强龙的干预影响。方法39只大鼠随机分为正常组、模型组及甲强龙干预组(n=13)。模型组及干预组进行被动吸烟,烟雾暴露1个月时,对干预组皮下注射甲强龙(10mg/kg,1次/d),每周6 d;烟雾暴露90 d后,抽取下腔静脉血,处死大鼠,同时收集支气管肺泡灌洗液(bronchial alveolar lavage fluid,BALF);检测各组大鼠血清、支气管肺泡灌洗液中的AECA。肺组织切片苏木素伊红染色后观察组织形态学改变,测定肺平均内衬间隔(mean linear intercept,MLI)、平均肺泡数(mean alveolar numbers,MAN)。结果与正常组、干预组比较,模型组血清及支气管肺泡灌洗液中的AECA、MLI升高(P<0.05),但MAN显著降低(P<0.05);肺泡灌洗液AECA与MLI正相关(r=0.821,P<0.05),与MAN负相关(r=-0.894,P<0.05)。结论AECA可能参与吸烟诱导的肺气肿形成,并可能与其严重程度相关;甲强龙可能通过降低AECA含量影响肺气肿形成。
肺气肿;吸烟;抗血管内皮细胞抗体;甲强龙;大鼠
血管内皮细胞抗体(anti-endothelial cells antibodies,AECA)是一组针对血管内皮细胞膜表面结构抗原的异质性抗体[1],它可出现在多种自身免疫疾病,如血管炎等。有学者发现在终末期肺气肿病人血清中检测到抗血管内皮细胞抗体[2],故推测,AECA可能在肺气肿形成中起着重要作用。甲强龙具有强大的抗炎、免疫抑制等作用,因此,本实验通过建立吸烟诱导的肺气肿大鼠模型,验证AECA在肺气肿发病中的作用,并观察与甲强龙干预的关系,为完善肺气肿的发病机制及寻求一可能的治疗途径奠定基础。
1 材料与方法
1.1 主要实验试剂 大鼠AECA ELISA试剂盒(即用型)(武汉博士德生物工程有限公司);注射用甲泼尼龙琥珀酸钠(甲强龙,美国辉瑞制药有限公司,生产批号H20080284);雄狮牌香烟(浙江中烟有限责任公司,焦油量9mg/盒)
1.2 主要实验仪器 烟雾暴露箱(自制);550酶标仪(美国Bio-Rad公司);DL-5低速大容量离心机(上海安亭科学仪器厂);光学显微镜(0LYBUS BX41TF,日本);-80°冰箱(Thermo Fisher Seientific公司,美国)
1.3 实验动物及分组
1.3.1 实验动物:健康雄性SD大鼠39只,清洁级,鼠龄10周,体质量为(150±30)g,由重庆腾鑫比尔实验动物销售有限公司实验动物中心提供,实验动物许可证号:SCXK(渝)2012-0005。
1.3.2 实验动物分组:采用随机数字表法将39只大鼠随机分为正常对照组、吸烟大鼠肺气肿模型组、甲强龙干预组,每组13只。正常对照组大鼠自由饮水、摄食,无任何处理。
1.4 饲养条件 所有大鼠饲养于本科动物实验室,实验室通风、采光良好,并定期消毒。3组大鼠在同样的环境条件下喂养,自由摄取标准饲料,饮用干净自来水,室温控制在15℃~18℃之间,湿度70%左右。
1.5 动物处理及指标检测
1.5.1 肺气肿模型建立:将模型组放入自制的实验性大鼠被动吸烟箱中,同时点燃5支香烟,放入箱内,至香烟燃烧完全,烟雾基本消失,共计15min。然后,掀开箱盖,取出大鼠,此为第1次烟雾暴露。休息5min后重复1次烟雾暴露,清洗烟雾暴露箱。3 h后重复烟雾暴露。每天烟雾暴露共4次,每周6 d[3]。烟雾暴露达1个月时,以甲泼尼龙琥珀酸钠(甲强龙)对干预组进行干预,13只大鼠吸烟同时给予甲强龙,按照文献报道[4]剂量给药,药物经生理盐水溶解,每日上午给予甲强龙(10mg/kg)腹腔内注射,每周6 d。实验过程中,第60天时模型组大鼠死亡1只,第70天时干预组死亡1只,第72天时模型组死亡1只。第90天结束所有处理并进行以下检测。
1.5.2 血清和支气管肺泡灌洗液(bronchial alveolar lavage fluid,BALF)的收集:各组大鼠终止所有处理后,参照文献描述的方法[5],首先将10%水合氯醛麻醉按0.3mL/100g注入大鼠腹腔内麻醉大鼠,从下腔静脉抽取静脉血,在5℃,2 000 r/min离心10min,分离血清,取上清液(血清)转移至EP管中,作标记编号,置于-70℃冰箱中以备指标检测。然后,处死大鼠,暴露双肺与气管,做一气管切口,结扎右主支气管,连接5mL注射器与尖端磨平的12号针头,向左肺注入无菌生理盐水3次,每次3mL,收集BALF(回收率为80%~90%),经过滤、离心后,取上清液置入无菌管内,置于-70℃冰箱中备用。
1.5.3 AECA的检测:采用酶联免疫吸附试验(enzymelinked immunosorbent assay,ELISA)监测血清及肺泡灌洗液中AECA含量,具体操作按试剂盒说明书进行。
1.5.4 定量分析大鼠肺组织病理切片:结扎大鼠右中上肺支气管及左主支气管,恒压注入4%多聚甲醛,直至右下肺膨胀、边缘变锐,约30 min后,取出右下肺,置入4%多聚甲醛,固定24 h。然后行石蜡包埋、切片、脱蜡后进行苏木素伊红(htoxylin eosin,HE)染色,光镜下观察拍照,拍照放大倍数为100倍,每片随机取3个视野,作形态分析,每个视野正中心划十字交叉线,测出十字线总长(L)和每个视野面积(S),计算与交叉线相交的肺泡隔数(number of alveolar septum,NS)和每个视野内肺泡数(number of alveolar,Na),平均内衬间隔(mean linear intercept,MLI)表示肺泡平均内径,MLI=L/NS,平均肺泡数(mean alveolar numbers,MAN)反映肺泡密度,MA n=Na/S。病理读片拍照均由2名不知情的病理医师完成。
1.6 统计学方法 所有实验数据采用SPSS 17.0统计软件进行存储、整理、分析,正态计量数据用“±s”表示,各实验组间差异采用单因素方差分析(one-way ANOVA),方差齐时用SNK q检验进行组间两两比较,方差不齐时用Kruskal-wallis检验法进行组间两两比较;采用直线相关分析分析各组大鼠肺组织肺泡隔数、肺泡数与AECA之间的关系;P<0.05表示差异有统计学意义。
2 结果
2.1 一般情况 3组大鼠在造模前体质量、周龄,活动及对刺激的反应均无显著差异。模型组在造模期间,毛发脱落、毛色萎黄、活动减少、反应迟钝、牙齿偏黄、呼吸增快;干预组在单纯烟雾暴露期间,出现毛发脱落、反应迟钝,但在烟雾暴露30 d后予甲强龙10mg/(kg·d)腹腔内注射,每周6 d。干预后,大鼠毛发、反应及活动度较前好转;造模结束后,正常组大鼠毛发、牙齿、活动等一般指标与造模前相比无显著变化。在实验过程中,模型组大鼠第60天时死亡1只,干预组第70天时死亡1只,模型组第72天时死亡1只,原因均不清,正常组无动物死亡。
2.2 各组大鼠肺组织HE染色切片病理学变化 显微镜下,正常大鼠肺组织结构正常,肺泡间隔完整,气管壁结构清楚,气管内表面纤毛丰富、整齐,未见脱落现象。模型组及甲强龙干预组大鼠支气管肺内见较多炎性细胞浸润,纤毛脱落、倒状,杯状上皮细胞化生,肺泡壁变薄甚至断裂,肺泡腔扩大,部分融合成肺大泡;在上述变化中,干预组较模型组相对较轻(见图1)。与正常组比较,模型组大鼠MLI明显增加,MAN明显减小,表现为明显的肺气肿样改变,差异均有统计学意义(P<0.05)。与模型组比较,干预组大鼠MLI明显减小,MAN明显增加(P<0.05,见表1)。
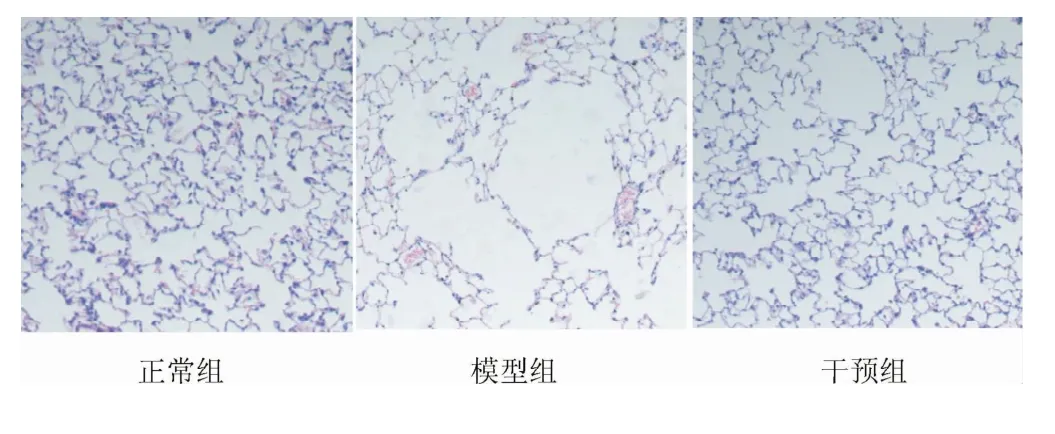
图1 各组大鼠肺组织HE染色结果(×100)Fig.1 Staining Results in different groups(×100)

表1 3组大鼠平均内衬间隔(MLI)及平均肺泡数(MAN)比较Tab.1 The comparison of MLIand MAN among groups
2.3 各组大鼠血清及支气管肺泡灌洗液(BALF)中 AECA含量的比较 模型组BALF及血清中AECA含量高于正常组(P<0.05),与模型组比较,干预组BALF及血清中AECA含量均显著降低(P<0.05,见表2)。模型组及治疗组肺泡灌洗液AECA与 MLI正相关,(r=0.821,P<0.05),与MAN负相关(r=-0.894,P<0.05)。正常组肺泡肺泡灌洗液 AECA与 MLI、MAN均无相关性。
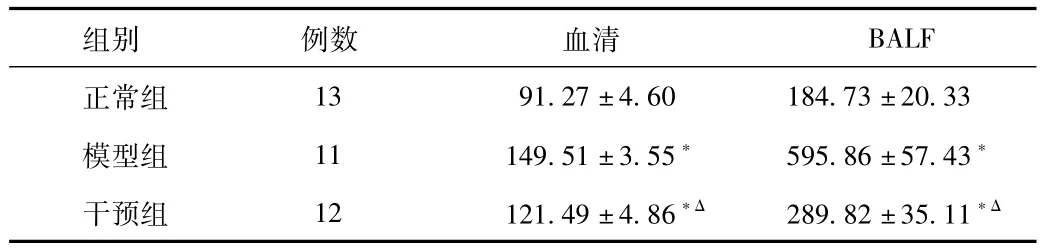
表2 各组大鼠AECA含量的比较(ng/L)Tab.2 The comparison of AECA among groups(ng/L)
3 讨论
慢性阻塞性肺疾病简称慢阻肺,它是临床常见病、多发病,病理改变包括慢性支气管炎、肺气肿等。本实验在建立肺气肿模型过程中,正常组大鼠一般指标正常,无动物死亡。而模型组大鼠在烟雾暴露过程中,出现反应迟钝、毛发脱落,并在烟雾暴露过程中出现大鼠死亡。这与相关文献报道相似[6-7]。本实验中模型组大鼠肺内组织病理检查发现:模型组肺组织出现肺气肿样改变,如肺泡壁破坏、肺泡腔扩大等,与国内张程等[8]研究结果一致,表明吸烟肺气肿模型复制成功。
本实验采用吸烟肺气肿大鼠模型为研究对象,发现模型组血清及肺泡灌洗液中AECA的浓度较正常组明显升高,提示ACEA可能参与吸烟诱导的肺气肿发生。吸烟是导致慢阻肺的最重要因素之一,香烟中含有约4700外源性化合物,而在某种条件下,包含有害物质和潜在免疫原性[8-9],这些外源性化合物可在肺内沉积,并且诱导适应性免疫应答,包括自身抗体产生[10]。
AECA是一组针对血管内皮细胞膜表面结构抗原的异质性抗体[11]。AECA的抗原是一簇位于内皮细胞表面的异质性蛋白,该抗体可出现在多种自身免疫病当中,近几年,自身免疫机制已经被确认为是慢阻肺发病机制之一[3,12-14]。目前国外相关研究[15]对自身免疫性肺气肿动物的研究则进一步提示AECA可能和自身免疫性肺气肿形成相关。但在吸烟肺气肿动物中AECA对肺气肿的发生有无影响尚未见文献报道。
有研究表明[16]慢阻肺患者血清中发现AECA的表达,并发现慢阻肺患者较正常对照人群血清AECA水平显著增高,而在非慢阻肺患者或不吸烟患者中,该水平呈低表达或不表达。因此推测AECA在吸烟导致的肺气肿中可能也有一定的作用,而且可能和疾病严重程度相关。
同时,本研究发现大鼠肺泡灌洗液中ACEA与肺平均内衬间隔成正相关、平均肺泡数成负相关,更进一步支持ACEA参与了肺气肿的发生。本研究未发现血清中AECA与平均内衬间隔及平均肺泡数有明显的相关性,这可能与血清中AECA的影响因素较多有关。
甲强龙具有强大的抗炎、免疫抑制等作用,较多研究表明伴随有AECA升高的自身免疫性疾病对皮质醇类固醇治疗反应良好,而大量的临床事实证明慢阻肺急性加重期患者在标准治疗基础上加糖皮质激素可缓解症状,减慢肺功能下降[17]。本研究发现甲强龙干预组AECA较模型组显著降低,说明甲强龙可能通过干预AECA表达,而对肺气肿起一定治疗作用。
吸烟可引起气道炎症、刺激副交感神经、氧自由基产生增多、诱导自身免疫等等多环节导致肺气肿的发生,本研究结果表明,AECA在吸烟诱导的肺气肿发病中有重要意义,甲强龙可能通过降低AECA而对肺气肿有一定的治疗作用。但本研究仅初步观察了AECA与吸烟肺气肿以及甲强龙干预的影响,尚未对其可能的发生机制进行探讨。
[1] Del Papa N.Antibodies to endothelial cells in primary vasculitides mediate in vitro endothelial cytotoxicity in the presence of normal peripheral blood mononuclear cell[J].Clip Immunol Immunopathol,l992,63(3):267-274.
[2] Taraseviciene-Stewart L,Douglas IS,Nana-Sinkam PS,et al.Is alveolar destruction and emphysema in chronic obstructive pulmonary disease an immune disease?[J].Proc Am Thorac Soc.2006,3(8):687-690.
[3] 张程,陈平,蔡珊等.重组人Ⅱ型肿瘤坏死因子受体一抗体融合蛋白对慢性阻塞性肺疾病大鼠肺功能的影响[J].中华结核和呼吸杂志,2007,30(06):432-436.
[4] 李莉,王向东等.糖皮质激素抑制慢性支气管炎大鼠气道磷酸二酯酶4D和肿瘤坏死因子α的表达[J].中国呼吸与危重监护杂志,2009,8(06):534-538.
[5] 张程,张湘燕,罗溶溶等.预防性使用英夫利西单抗对肺气肿模型大鼠气道炎症的影响研究 [J].中国药房,2011,22(37):3480-3482.
[6] 赵亚丽,孙圣华,刘纯,等.COPD营养不良与细胞因子的关系及消炎痛干预实验研究.医学临床研究[J].2006,23(10):1572-1574.
[7] Rubio ML,Sanchez-Cifiaentes MV,Ortega M,et a1.N—acetylcysteine prevents cigarette smoke induced small airways alterations in rats.Eur Respir J[J].2000,15(3):505~511.
[8] Kasahara Y,Tuder RM,Taraseviciene-Stewart L,et al.Inhibition of VEGF receptors causes lung cell apoptosis and emphysema[J].Clin Invest,2000,106:1311-1319.
[9] Cosio MG,Saetta M,Agusti A.Immunologic aspects of chronic obstructive pulmonary disease[J].N Engl JMed,2009,360(23):2445-2454.
[10] Voelkel NF,Vandivier RW,Tuder RM.Vascular endothelial growth factor in the lung[J].Am JPhysiol Lung Cell Mol Physiol,2006,290(2):L209-L221.
[11] Del Papa N.Antibodies to endothelial cells in primary vasculitides mediate in vitro endothelial cytotoxicity in the presence of normal peripheral blood mononuclear cell[J].Clip Immunol Immunopathol,l992,63(3):267-274.
[12] Cosio MG,Saetta M,Agusti A.Immunologic aspects of chronic obstructive pulmonary disease[J].N Engl JMed,2009,360(23):2445-2454.
[13] Leidinger P, Keller A, Heisel S, et al.Novel autoantigens immunogenic in COPD patients[J].Respir Res.2009,10:20.
[14] Voelkel N, Taraseviciene-Stewart L.Emphysema: an autoimmune vascular disease?[J].Proc Am Thorac Soc,2005,2(1):23-25.
[15] Taraseviciene-Stewart L,Choe KH,Moore M,et al.An animalmodel of autoimmune emphysema[J].Am JRespir Crit Care Med.2005,171(7):734-742.
[16] Masato K,Naoki I,Takafumi S,et.al.Antiendothelial Cell Antibodies in PatientsWith COPD[J].Chest,2010,138,1303-1308.
[17] Keating GM,McCormack PL.Salmeterol/fluticasone propionate: a review of its use in the treatment of chronic obstructive pulmonary disease[J].Drugs,2007,67:2383-2405.
(编校:谭玲)
Effects of anti-endothelial cell antibody(AECA)and intervention of methylprednisolone in emphysema rats
YAO Hong-mei,ZHANG Lu,ZHANG Cheng,YE Xian-wei,ZHANG Xiang-yan,MA LiΔ
(Department of Respiratory and Critical Care Medicine,People's Hospital of Guizhou,Guiyang 550002,China)
ObjectiveTo explore the effects and mechanisms of anti-endothelial cell antibody(AECA)in the alveolar cell apoptosis of the emphysema rats induced by smoking,and to discuss the intervention effects of methylprednisolone.Methods39 male Sprague-Dawley rats were randomly divided into normal controlgroup,modelgroup,and intervention group,with 13 rats in each group.Emphysemamodelswere established in the latter two groups.After exposing to cigarette smoking for onemonth,methylprednisolone injected intraperitoneally in the intervention group(10mg/kg,1 time/d),6d/week.On the 90th day,inferiora vena cave blood sampleswere collected and all ratswere sacrificed.The levels of AECA were detected in bronchial alveolar lavage fluid(BALF)and serum,respectively.Pathological changes were observed in lung tissues stained by hematoxylin eosin,quantitative determination of lung averagemean linear intercept(MLI)and mean alveolar number(MAN)were preformed.ResultsCompared with normal group and intervention group,the levels of AECA in BALF and serum,MLI in themodel group were higher(P<0.05),but the levels ofMAN was lower(P<0.05);There is a positive correlation between AECA in BALF and MLI of rats(r=0.821,P<0.05),a negative correlation between AECA in BALF and MAN(r=-0.894,P<0.05.Conclusions ACEAmay enroll the pathogenesisofemphysema in rats induced by smoking and related with the severity.Methylprednisolonemay inhibit the formation of emphysema by reducing the expression level of AECA in airway.
emphysema;smoke;anti-endothelial cells antibodies;methylprednisolone;rats
R363
A
1005-1678(2014)04-0008-04
慢性阻塞性肺疾病简称慢阻肺,其病理变化主要包括慢支炎、肺气肿等,是一种严重危害人类健康的常见病、多发病,病死率较高,发病机制尚未完全清楚,治疗效果不尽人意,越来越多的研究表明,自身免疫反应在肺气肿甚至慢阻肺的形成过程中具有重要的作用,被认为是慢阻肺发病的新机制。
国家自然科学基金(81060006);贵州省科学技术基金黔科合J字[2011]2251;十二五国家科技支撑计划课题(2013BAI09B09)
姚红梅,女,博士,副主任医师,研究方向:慢性气道疾病,E-mail:yaohmok@126.com;马丽,通信作者,女,硕士,主任医师,研究方向:呼吸系统疾病,E-mail:maligy@126.com。
