激光多普勒血流仪优化大鼠全脑缺血再灌注模型
2014-09-12余丽娟胡馨月纪超男魏玉玲阳群芳蒋青松杨俊卿
杨 彬 余丽娟 王 佳 赵 磊 胡馨月 纪超男 魏玉玲 阳群芳 蒋青松 杨俊卿
(重庆医科大学药理教研室 重庆市生物化学与分子药理学重点实验室,重庆 400016)
缺血性脑损伤可分为局部脑缺血与全脑缺血损伤。局部脑缺血模型,多数学者认为可模拟临床上的中风。而全脑缺血模型除了模拟中风外,更侧重于模拟临床上的窒息、休克、心脏骤停、严重心律失常以及低氧血症的脑损伤〔1〕。局部脑缺血的主要模型为大脑中动脉阻塞(MCAO)模型,而全脑缺血损伤的模型主要有四动脉结扎模型,双动脉结扎合并低血压模型,窒息性心脏骤停模型〔2〕。目前国内外广泛采用Pulsinelli 四血管阻断法制作动物全脑缺血再灌注模型〔3〕,但是其造模过程复杂。由于大鼠脑血管的解剖结构与人类相似,因而认为大鼠是建立脑缺血损伤模型最适宜的动物。激光多普勒血流(LDF)测定法是一种准确反映微循环灌注的测量手段〔4〕,Schmid-Elsaesser等〔5〕发现持续脑血流监测可以用来证明MCAO模型制作是否成功,但LDF在全脑缺血再灌注(I/R)损伤模型中的研究还未见报道。本实验参照国内外常用的二血管阻断加低血压法〔6,7〕,并使用LDF对其进行优化,建立一种手术操作简单、死亡率低、重复性好的大鼠全脑缺血再灌注模型,为进一步深入探讨脑缺血损伤的发病机制、病理特点及其防治打下良好的实验基础。
1 材料与方法
1.1动物及分组 SPF级雄性Sprague Dawley大鼠33只,体重200~250 g,由重庆医科大学实验动物中心提供,合格证书编号SCXK(渝)2007-0001。饲养于SPF环境中,温度25 ℃±1 ℃,相对湿度50%±2%。12 h光照昼夜节律,自由饮水,手术前12 h禁食。动物实验随机分假手术组(n=7);LDF监测I/R组(LDF+I/R组,n=13),无LDF监测I/R组(I/R组,n=13)。每组大鼠取3只用于组织病理学检测,其余大鼠用于SOD活性,MDA含量测定。所有与动物相关的实验操作,均在重庆医科大学道德与伦理委员的许可和指导下进行。
1.2主要仪器与试剂 多普勒激光血流仪(Moor 公司;VMS-LDF1型;英国);Morris 水迷宫(中国医学科学院药物研究所);荧光正置显微镜(Olympus;日本);丙二醛试剂盒,超氧化物歧化酶试剂盒(南京建成试剂有限公司)
1.3模型制作 参照GrØgaard〔6〕,罗维楠〔7〕等的方法并稍作改进,大鼠用4%水合氯醛(1 ml/100 g)腹腔注射麻醉,使大鼠处于仰卧位并固定于鼠解剖板,颈正中剃毛,纵向剪开颈部皮肤约2 cm,钝性分离组织和肌肉,暴露并小心分离出双侧颈总动脉与一侧颈总静脉,下穿约5 cm丝线备用。结扎颈总静脉远心端,在近心端剪一切口。将连接于注射器针头上的聚乙烯导管(预先肝素内浸泡)沿颈总静脉切口处向心脏方向插入,插管后输入2 ml肝素生理盐水(250 U/100 ml)。缓慢抽取大鼠总血量约30%的血液。提起颈总动脉下预先备置的丝线,无创性微动脉夹夹闭双侧颈总动脉20 min,计时松开动脉夹,缓慢回输血液,拔出导管,结扎颈总静脉近心端,缝合伤口,强力碘消毒。假手术组大鼠不阻断血流,不抽血,其余过程与手术组大鼠相同。手术过程中大鼠肛温保持在36.5 ℃~37.2 ℃。
1.4脑血流测定 用LDF监测大鼠整个手术过程中的脑血流(CBF)变化,大鼠腹腔注射4%水合氯醛(1 ml/100 g)麻醉,俯卧,头部剃毛,剪开头部皮肤约2 cm,用浸满过氧化氢的棉签拭去渗出液,暴露出颅骨,将多普勒血流仪的探头用胶水固定于颅骨上,并使大鼠处于仰卧位,进行I/R手术,LDF记录大鼠手术过程中的CBF变化。
1.5水迷宫 考虑到动物手术后伤口愈合,在术后8~12 d进行水迷宫测定大鼠空间学习与记忆能力。整个测试过程分为二个阶段:第一阶段(定向航行),每天晚上8点至10点训练,训练4 d,第一天训练时将大鼠放到隐蔽于水中的平台上让其适应10 s,然后让其自由游泳找到平台,180 s内未找到平台者,实验者协助将其引至平台。从第二天起,每天训练4次,将大鼠分别从A、B、C、D 4个位置,面向池壁放入水中,让大鼠定向航行;第二阶段(空间检测),在第5天时进行测试,并将大鼠从前一天最后一次训练时的位置放入水中,记录大鼠第一次登上平台的时间,即寻台潜伏期(超过180 s记为180 s),水迷宫上方安置摄像机,同步记录大鼠寻台运动轨迹。
1.6组织病理学检查 三组大鼠水迷宫测试完成后,各取3只,4%水合氯醛腹腔注射麻醉,4%多聚甲醛在体脑组织固定。HE染色观察皮层与海马神经元结构形态变化,于连续3个高倍镜视野下,计数核固缩、核坏死神经元数目占总神经元数目的百分率,作为神经元组织形态学改变的相对量〔7〕。
1.7SOD和MDA含量测定 水迷宫完成后,将剩下的大鼠断颈法处死,冰面分离皮层海马组织,液氮速冻,然后保存于-80℃低温冰箱,用时将组织取出,用生理盐水制成10 g/L的匀浆液。以黄嘌呤氧化酶法测定SOD活性,TBA法检测MDA含量,具体操作按说明书进行。
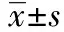
2 结 果
2.1动物存活率 假手术组及有LDF监测组大鼠术后全部存活,无死亡;无LDF监测组1只大鼠手术过程中死亡,2只大鼠术后24 h死亡,存活率76.92%,明显低于其他两组(P<0.01)。
2.2LDF监测大鼠I/R模型的脑血流变化 假手术组大鼠在实验过程中基线血流为(184.25±10.80)PU,手术过程中大鼠采用腹式呼吸,呼吸的深浅、手术时触碰到血管等因素都会影响血流波动。在分离颈总动脉时,牵扯到迷走神经,影响到动物的呼吸,可造成脑血流值小幅降低。分离完成后,动物呼吸恢复正常,血流值也恢复正常。
图1 I/R过程中脑血流动态变化
全脑缺血成功大鼠缺血前,基线脑血流平均值(167.49±10.69)PU,夹闭双侧颈总动脉后,血流值迅速降低,在缺血20 min过程中脑血流平均值为(40.71±6.10)PU,血流降幅75%;夹闭完成,取下动脉夹后,血流迅速回升,在观察期内脑血流平均值为(116.00±6.55)PU,再灌注时,血流恢复至缺血前基线血流的70.46%。见图1。
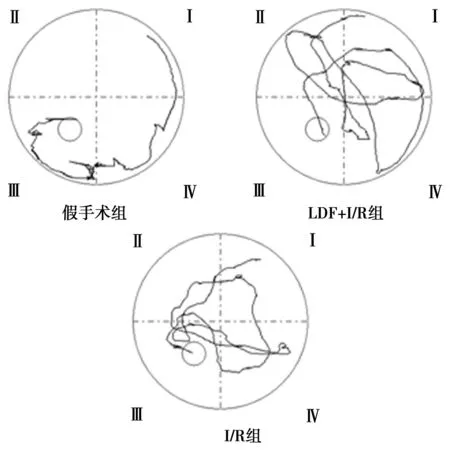
图2 三组大鼠在第5天的寻台路径
2.3I/R对大鼠空间学习记忆能力的影响 三组大鼠寻台潜伏期随着训练天数的增加而逐渐减少。与假手术组比较,两组I/R组大鼠寻台潜伏期显著延长,寻台路径也明显增加;有、无LDF监测两组大鼠寻台潜伏期、寻台路径无显著差异。见图2,表1所示。
2.4I/R损伤对大鼠脑组织病理形态结构的影响 假手术组大鼠皮层神经元细胞形态正常,轮廓清晰。I/R组大鼠皮层神经元细胞排列较紊乱,胞核固缩深染,呈致密浓染块状或颗粒状,有的细胞界限不清,结构消失;而有、无LDF监测两组大鼠之间神经元损伤无显著性差异。见图3,图4,表2。
2.5I/R损伤对大鼠皮层海马组织SOD活性和MDA含量变化的影响 与假手术组比较,另两组I/R组大鼠皮层海马SOD活性显著下降(P<0.01),MDA含量显著升高(P<0.01),而有无LDF监测组大鼠之间SOD活性、MDA含量无显著性差异。见表3。
表1 I/R对大鼠寻台潜伏期及第5天寻台路径的影响
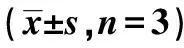
表2 各组大鼠皮层海马神经元计数
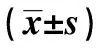
表3 I/R对大鼠皮层海马组织SOD活性、MDA含量变化的影响
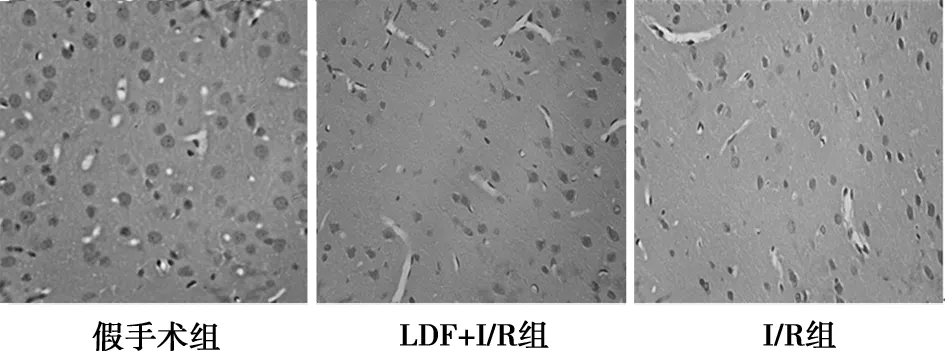
图3 大鼠皮层组织病理学(HE,×400)
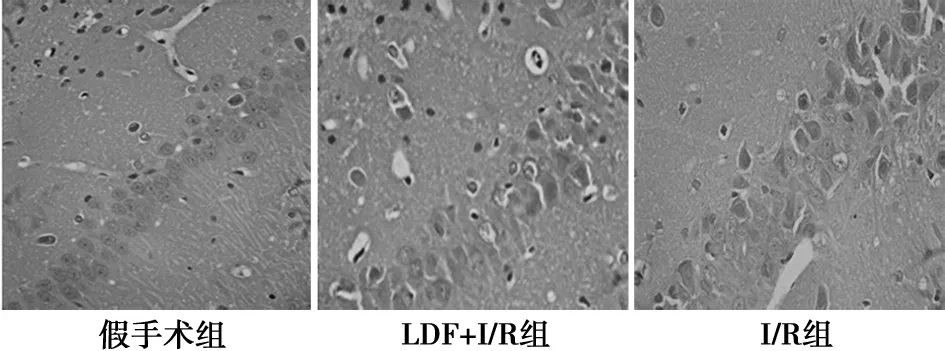
图4 大鼠海马CA1区组织病理学(HE,×400)
3 讨 论
全脑缺血再灌注的原理为夹闭双侧颈总动脉时,两侧颈总动脉的血液供应停止,而两侧椎动脉的血流仍可通过基底动脉流至大脑动脉环,从颈静脉抽取一定量血液可以有效降低缺血期后交通动脉血流量,从而减少后交通动脉的代偿作用,使脑缺血更为明显。缺血完成后解除两侧颈总动脉的阻断,并回输从颈总静脉抽出的血液,使大脑的血流恢复,实现再灌注。
本研究的创新点在于通过LDF监控手术过程中CBF的变化以降低动物死亡率,同时增加造模成功率。LDF测定法是一种准确反映微循环灌注的测量手段〔4〕。刘宇等〔8〕用LDF判断活体大鼠MCAO模型制作成功与否,发现LDF的检测结果与TTC染色证实脑梗死病灶具有很好的一致性,符合率达到88%,Harada等〔9〕用LDF评价MCAO模型,发现持续脑血流监测可以减少脑梗死体积的变异系数,减少制作过程中动物死亡率。本实验在此基础上对前期建立的I/R模型进行进一步的改良与优化。
研究认为脑血流减少至45%就能够影响大脑的能量代谢〔10〕。本实验根据大鼠体重抽取约总血量30%的血液并夹闭双侧颈总动脉实现I/R损伤,但由于个体差异的存在,抽取30%血量并夹闭双侧颈总动脉后,部分大鼠CBF降低却少于55%,对这部分大鼠来说此操作可能只是使其“血量减少”,而不能称为缺血,若将这部分大鼠直接纳入实验结果中,必然会出现假阳性的结果,通过LDF的监测,对这部分大鼠应多抽取血量并使其CBF降低至45%以下,以实现缺血的效果;而部分大鼠夹闭后CBF已经降低至缺血的阈值,但出现心跳急剧增加,呼吸困难等症状,其缺血太多,应部分回输血液再夹闭其双侧颈总动脉并控制其CBF降低的幅度在55%以上。
水迷宫检测表明I/R对大鼠空间学习记忆能力产生明显损伤。HE结果说明I/R对大鼠神经元产生严重损伤。氧化应激在缺血性脑损伤中发挥着重要作用〔11〕。本文说明I/R导致机体氧化应激损伤。
综上所述,I/R大鼠空间学习记忆障碍显著,神经元损伤,氧化应激损伤明显,此模型可用于脑缺血再灌病理生理和形态学等变化及某些药物和治疗手段的基础研究。
4 参考文献
1Krafft PR,Bailey EL,Lekic T,etal.Etiology of stroke and choice of models〔J〕.Int J Stroke,2012;7(5):398-406.
2Harukuni I,Bhardwaj A.Mechanisms of brain injury after global cerebral ischemia〔J〕.Neurol Clin,2006;24(1):1-21.
3Pulsinelli WA,Brierley JB.A new model of bilateral hemispheric ischemia in the unanesthetized rat〔J〕.Stroke,1979;10(3):267-72.
4Basak K,Manjunatha M,Dutta PK.Review of laser speckle-based analysis in medical imaging〔J〕.Med Biol Eng Comput,2012;50(6):547-58.
5Schmid-Elsaesser R,Zausinger S,Hungerhuber E,etal.A critical reevaluation of the intraluminal thread model of focal cerebral ischemia:evidence of inadvertent premature reperfusion and subarachnoid hemorrhage in rats by laser-Doppler flowmetry〔J〕.Stroke,1998;29(10):2162-70.
6GrØgaard B,Gerdin B,Arfors KE.Forebrain ischemia in the rat.Relation between duration of ischemia,use of adjunctive ganglionic blockade and long-term recovery〔J〕.Stroke,1986;17(5):1010-5.
7罗维楠,杨俊卿,姜 蓉,等.美洛昔康对全脑缺血再灌注大鼠脑损伤的作用观察〔J〕.中国药理学通报,2010;26(11):1459-62.
8刘 宇,孟 然,闫 峰,等.激光多普勒血流仪评价活体大鼠大脑中动脉栓塞模型成功的可行性分析〔J〕.中国病理生理杂志,2011;27(3):620-4.
9Harada H,Wang Y,Mishima Y,etal.A novel method of detecting rCBF with laser-Doppler flowmetry without cranial window through the skull for a MCAO rat model〔J〕.Brain Res Brain Res Protoc,2005;14(3):165-70.
10EklÖf B,SiesjÖ BK.The effect of bilateral carotid artery ligation upon the blood flow and the energy state of the rat brain〔J〕.Acta Physiol Scand,1972;86(2):155-65.
11Manzanero S,Santro T,Arumugam TV.Neuronal oxidative stress in acute ischemic stroke:sources and contribution to cell injury〔J〕.Neurochem Int,2013;62(5):712-8.
