黄连解毒汤合定痫丸治疗阳痫大鼠的实验研究
2014-08-28黎兴键吴智兵于征淼张小梅
黎兴键 吴智兵 于征淼 张小梅
(广州中医药大学第一附属医院脑病科,广东 广州 510405)
黄连解毒汤合定痫丸治疗阳痫大鼠的实验研究
黎兴键 吴智兵 于征淼△张小梅
(广州中医药大学第一附属医院脑病科,广东 广州 510405)
目的观察黄连解毒汤合定痫丸(汤剂)对阳痫大鼠的抗痫作用。方法以高脂饲料和制附子煎液预饲养并采用匹罗卡品注射法制成阳痫大鼠模型,以黄连解毒汤合定痫丸(汤剂)灌胃治疗(阳痫中药组),同时设正常组、阳痫组和阳痫中药反治组进行对照,每组各9只观测癫痫发作潜伏期、到达癫痫持续状态(SE)时间等症状学指标,高效液相色谱法检测脑内谷氨酸(Glu)、天门冬氨酸(Asp)、γ-氨基丁酸(GABA)、甘氨酸(Gly)、丙氨酸(Ala)等5种氨基酸类神经递质的含量,伊红-苏木素(HE)切片观察肺、肾、肝、海马、脑皮质的病理变化,免疫组化法测定脑内caspase-3表达。结果阳痫组、阳痫中药反治组、阳痫中药组大鼠均出现4级以上癫痫发作。癫痫发作潜伏期以阳痫组最长,阳痫中药组次之,阳痫中药反治组最短;到达SE时间以阳痫中药组最长,阳痫中药反治组次之,阳痫组最短。各致痫组大鼠脑内5种氨基酸含量较正常组均降低。阳痫组Glu、Asp与正常组比较差异有统计学意义(P<0.05,P<0.01),GABA、Gly、Ala与正常组比较差异无统计学意义(P>0.05);阳痫中药反治组中各种氨基酸与正常组比较差异有统计学意义(P<0.05,P<0.01);阳痫中药组Glu、Asp、GABA、Gly与正常组比较差异有统计学意义(P<0.05,P<0.01),Ala与正常组比较差异无统计学意义(P>0.05)。HE切片显示,正常组大鼠各组织基本正常,其余组大鼠肺、肾、肝、海马、脑皮质等组织均出现明显病理损害。阳痫组和阳痫中药反治组的脑内caspase-3水平高于正常组,其中,阳痫中药反治组升高较明显,而阳痫中药组则略低于正常组,但比较差异均无统计学意义(P>0.05)。结论黄连解毒汤合定痫丸可能能推迟阳痫大鼠SE的到达时间,改变部分脑内氨基酸神经递质水平,并减少神经元凋亡,但作用程度较轻。
癫痫;黄连解毒汤;定痫丸;动物实验
对于发作期癫痫,中医常分为阳痫和阴痫进行辨证论治。治疗阳痫的代表方是黄连解毒汤合定痫丸,治疗阴痫的代表方是五生饮合二陈汤[1]。本研究拟建立阳痫大鼠模型,并以黄连解毒汤合定痫丸(汤剂)干预,从动物症状学、神经递质、主要脏器病理变化、神经元凋亡等角度探讨其抗痫作用。
1 材料与方法
1.1 动物 Wistar大鼠36只,合格证号:SCXK(粤)2006-0015,SPF级,雄性,实验前体质量约(160±20)g,饲养于广州中医药大学第一附属医院SPF动物实验室内[恒温(26±2) ℃]。实验动物环境合格证号:SYXK(粤)2008-0092。实验动物设施使用证明号:0019724。
1.2 试剂 匹罗卡品(PILO,Sigma,批号1001059533)、氯化锂(LiCl,Sigma,批号MFCD00011078)、硫酸阿托品注射液(天津药业集团新郑股份有限公司,国药准字H41021257);氨基酸对照品(amino acid stadard H,PIERCE)、GABA对照品(Sigma)、衍生剂AQC(Waters,批号1383803631)、醋酸钠缓冲液(Waters,批号4082110911);Rabbit anti caspase-3(cell signaling)、EnVision试剂(Dako)。
1.3 仪器 Waters 2695高效液相色谱(HPLC)仪,Waters 2475荧光检测器,Empower色谱工作站(Waters)。
1.4 药物 制附子煎液:制附子15g,加水300mL煮沸1 h,约得溶液220mL。黄连解毒汤合定痫丸(汤剂):丹参、麦门冬各90g,明天麻、浙贝母、法半夏、茯苓、茯神、生姜各45g,天竺黄、甘草、黄连、栀子各27 g,黄芩、黄柏、胆南星、石菖蒲、全蝎、僵蚕、陈皮、远志各15g,琥珀4.5g,朱砂1.5g,以350mL水煎沸除琥珀和朱砂以外的中药40min,后将琥珀和朱砂兑入拌匀,约得150mL药液(含生药约4.5g/mL)。减味五生饮合二陈汤:法半夏、橘红、生姜各45g,茯苓、乌梅各27 g,黑豆衣、生天南星、生半夏、白附子、炙甘草各15g,以300mL水先煎生半夏、生天南星,煮沸40min,加入其余药物再煎30min,约得150mL药液(含生药约1.8 g/mL)。
1.5 分组及造模 随机区组设计,按体质量将动物分成9个区组,4只/区组。然后随机分入4组:正常组、阳痫组、阳痫中药反治组、阳痫中药组,每组9只。以普通饲料及过滤水喂养正常组,以高脂饲料及制附子煎液喂养其它3组。高脂饲料由普通饲料掺入胆固醇、奶粉、白糖、猪油等制成,每1 g提供热量约18.84kJ。每次取制附子煎液45mL,加水稀释至300mL,供1笼大鼠(9只)饮用24h,为惟一水源,各组喂养时间均为10周。然后,正常组予0.9%氯化钠注射液腹腔注射。其余3组予LiCl+PILO腹腔注射:共进行3次注射,第1次用LiCl 127 mg/kg,17.5h后用阿托品1 mg/kg,再30min后用PILO 50mg/kg。实验动物癫痫发作级别评定根据Racine分级[2]。本研究规定出现4级或以上发作或癫痫持续状态(SE)者为造模成功。
1.6 给药 各组均在首次腹腔注射后17 h灌胃给药(20mL/kg):正常组、阳痫组予0.9%氯化钠注射液,阳痫中药反治组予减味五生饮合二陈汤,阳痫中药组予黄连解毒汤合定痫丸(汤剂)。
1.7 观察指标 记录各组大鼠癫痫发作潜伏期(自注射PILO到大鼠首次出现癫痫发作的时间)、发作程度分级及到达SE时间(自注射PILO到大鼠SE的时间)。注射PILO后60min予腹腔注射10%水合氯醛(300mg/kg)终止发作并处死所有大鼠。HPLC法检测脑内谷氨酸(Glu)、天门冬氨酸(Asp)、γ-氨基丁酸(GABA)、甘氨酸(Gly)、丙氨酸(Ala)5种氨基酸类神经递质的含量;伊红-苏木素(HE)切片观察肺、肾、肝、海马、脑皮质等的病理变化;免疫组化法测定脑内caspase-3表达(每张切片随机取3个视野测定阳性面积,取均值作为测定结果)。HE切片及免疫组化实验结果由中山大学达安基因股份有限公司提供。

2 结 果
2.1 各组氨基酸类神经递质比较 见表1。


组 别nGluAspGABAGlyAla正常组90.057±0.0310.029±0.0160.080±0.0250.058±0.0140.023±0.008阳痫组90.034±0.006∗0.013±0.005∗∗0.067±0.0180.050±0.0100.019±0.005阳痫中药反治组90.033±0.005∗∗0.012±0.003∗∗0.056±0.009∗∗0.045±0.007∗∗0.017±0.003∗阳痫中药组90.033±0.005∗0.015±0.004∗∗0.064±0.010∗0.048±0.008∗0.019±0.004
与正常组比较,*P<0.05,**P<0.01
由表1可见,各致痫组大鼠脑内5种氨基酸含量较正常组均降低。阳痫组Glu、Asp与正常组比较差异有统计学意义(P<0.05,P<0.01),GABA、Gly、Ala与正常组比较差异无统计学意义(P>0.05);阳痫中药反治组中各种氨基酸与正常组比较差异有统计学意义(P<0.05,P<0.01);阳痫中药组Glu、Asp、GABA、Gly与正常组比较差异有统计学意义(P<0.05,P<0.01),Ala与正常组比较差异无统计学意义(P>0.05),其中Asp、Ala水平在所有致痫组中降幅最小。
2.2 各组症状学比较 见表2。

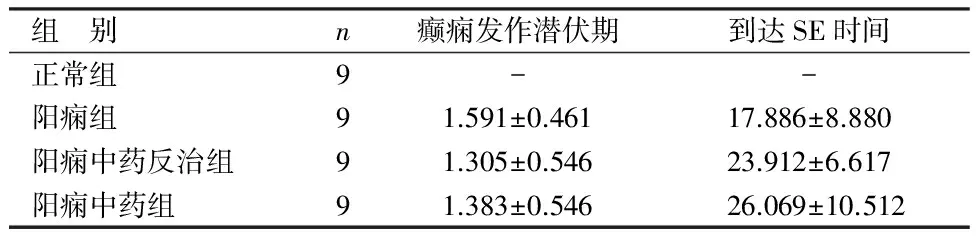
组 别n癫痫发作潜伏期到达SE时间正常组9--阳痫组91.591±0.46117.886±8.880阳痫中药反治组91.305±0.54623.912±6.617阳痫中药组91.383±0.54626.069±10.512
由表2可见,除正常组大鼠未见癫痫发作外,阳痫组、阳痫中药反治组、阳痫中药组大鼠均出现4级以上癫痫发作。癫痫发作潜伏期以阳痫组最长,阳痫中药组次之,阳痫中药反治组最短;到达SE时间以阳痫中药组最长,阳痫中药反治组次之,阳痫组最短。
2.3 各组肺、肾、肝、海马、脑皮质病理变化 HE切片显示,正常组大鼠各组织基本正常。其余组大鼠肺、肾、肝、海马、脑皮质等组织均出现明显病理损害:肺泡壁增厚,炎细胞浸润,部分出血严重,部分损伤严重;肾小球结构轻度破坏,系膜增生,肾小管结构破坏,部分大鼠肾小管结构模糊,重度水肿;肝细胞浊肿,肝索排列混乱,炎细胞浸润;海马结构破坏严重,神经元细胞严重损伤;脑皮质星形细胞和小胶质细胞增多,部分大鼠皮层组织破坏。各致痫组损害严重程度无明显差别。见封3,图1-20。
2.4 各组脑内caspase-3表达比较 见表3。
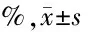

组 别ncaspase-3表达阳性面积正常组98.833±2.758阳痫组98.917±6.156阳痫中药反治组913.500±10.405阳痫中药组98.417±4.379
由表3可见,阳痫组和阳痫中药反治组的脑内caspase-3水平高于正常组,其中阳痫中药反治组升高较明显,而阳痫中药组则略低于正常组,但比较差异均无统计学意义(P>0.05)。
3 讨 论
阴痫和阳痫中的“阴”和“阳”指癫痫频繁发作之时的证候寒热属性,阳痫的病机为痰热蒙蔽心神。本研究使用黄连解毒汤合定痫丸(汤剂)治疗阳痫大鼠模型。
首先观测了发作潜伏期、到达SE时间等症状学指标,结果显示,到达SE时间以阳痫中药组最长,阳痫中药反治组次之,阳痫组最短。
其次,使用HPLC检测脑内5种氨基酸类神经递质。氨基酸类神经递质是中枢神经系统(CNS)内一类重要的递质。Glu、Asp为兴奋性氨基酸,对CNS有兴奋效应。GABA、Gly、Ala为抑制性氨基酸,对CNS有抑制效应[3]。这些递质的失衡参与了癫痫的发病过程[4-7]。关于癫痫动物脑内氨基酸类神经递质的变化,文献报道结果不一。PILO致痫大鼠脑皮质 Glu、Gly,海马区Gly、Asp[8]及其外液中GABA浓度升高[9]。PILO致痫小鼠的小脑内Ala浓度亦显著增高[10]。但戊四唑点燃癫痫大鼠海马、纹状体内 Glu、Ala、Gly浓度则降低,GABA浓度无变化[11]。氯化铁微注射诱导的癫痫大鼠可出现脑皮质内Asp、GABA浓度下降,Ala、Gly浓度上升,而Glu浓度则无变化[12]。本研究结果显示,各致痫组大鼠脑内5种氨基酸浓度均较正常组降低,阳痫中药组的Asp、Ala降幅最小,最接近正常大鼠的水平,其中Asp降幅差异有统计学意义。各文献报道的结果并不一致,提示氨基酸类神经递质在癫痫中虽然具有肯定的病理意义,但其机制却具有复杂性。
再次,HE切片观察肺、肾、肝、海马、脑皮质的病理变化,结果显示,各致痫组大鼠肺、肾、肝、海马、大脑皮质等组织均出现明显病理损害,提示癫痫频繁发作对多个重要脏器均有明显损害作用。
最后,使用免疫组化技术测定了脑内caspase-3表达。天冬氨酸特异性半胱氨酸蛋白酶(caspase)是介导细胞凋亡级联反应的蛋白酶家族,其核心蛋白是caspase-3[13-14]。研究表明,癫痫患者及动物脑内caspase-3较正常水平显著升高,抑制caspase-3的激活对癫痫具有治疗作用[15-16]。本研究结果显示,阳痫组和阳痫中药反治组脑内caspase-3水平高于正常组,而阳痫组则略低于正常组,但均无统计学意义。
上述结果虽然大多缺乏统计学意义,但可发现阳痫中药组的某些指标具有病情减轻的趋势,可以推测,黄连解毒汤合定痫丸可能能够推迟阳痫大鼠SE的到达时间,改变脑内部分氨基酸神经递质的水平,并减少神经元凋亡。
缺乏有统计学意义阳性结果的原因可能有三:①数据标准差大;②指标不够敏感;③黄连解毒汤合定痫丸的药效特点是同时对癫痫的多个环节进行细微的干预。
另外,目前国内癫痫动物实验均使用西医病理模型,尚无具备中医证候特点的癫痫动物模型。本研究使用高脂饲料和制附子煎液预饲养,PILO注射法制作阳痫大鼠模型,并予治疗阳痫的代表方黄连解毒汤合定痫丸进行干预,同时用药性相反的减味五生饮合二陈汤作为反治对照方,以评价模型的证候特点。结果显示,阳痫中药组到达SE时间长于阳痫中药反治组和阳痫组,阳痫中药组的Asp、Ala最接近正常大鼠水平,caspase-3表达量最低。这些结果都提示了该模型可能具有阳痫的中医证候特点。
[1] 田德禄,蔡淦.中医内科学[M].上海:上海科学技术出版社,2006:176-181.
[2] Racine RJ.Modification of seizure activity by electrical stimulation:cortical areas[J].Electroencephalogr Clin Neurophysiol,1975,38(1):1-12.
[3] Tiedje KE,Stevens K,Barnes S,et al.Beta-alanine as a small molecule neurotransmitter[J].Neurochem Int,2010,57(3):177-188.
[4] Ronne-Engström E,Hillered L,Flink R,et al.Intracerebral microdialysis of extracellular amino acids in the human epileptic focus[J].J Cereb Blood Flow Metab,1992,12(5):873-876.
[5] Alvestad S,Hammer J,Qu H,et al.Reduced astrocytic contribution to the turnover of glutamate,glutamine,and GABA characterizes the latent phase in the kainate model of temporal lobe epilepsy[J].J Cereb Blood Flow Metab,2011,31(8):1675-1686.
[6] van der Hel WS,van Eijsden P,Bos IW,et al.In vivo MRS and histochemistry of status epilepticus-induced hippocampal pathology in a juvenile model of temporal lobe epilepsy[J].NMR Biomed,2013,26(2):132-140.
[7] Mayr JA,Zimmermann FA,Fauth C,et al.Lipoic acid synthetase deficiency causes neonatal-onset epilepsy,defective mitochondrial energy metabolism,and glycine elevation[J].Am J Hum Genet,2011,89(6):792-797.
[8] Radwan NM,El Hay Ahmed NA,Ibrahim KM,et al.Effect of infrared laser irradiation on amino acid neurotransmitters in an epileptic animal model induced by pilocarpine[J].Photomed Laser Surg,2009,27(3):401-409.
[9] Smolders I,Bortolotto ZA,Clarke VR,et al.Antagonists of GLU(K5)-containing kainate receptors prevent pilocarpine-induced limbic seizures[J].Nat Neurosci,2002,5(8):796-804.
[10] López-Meraz ML,Rocha LL,Miquel M,et al.Amino acid tissue levels and GABAA receptor binding in the developing rat cerebellum following status epilepticus[J].Brain Res,2012,1439:82-87.
[11] Szyndler J,Piechal A,Blecharz-Klin K,et al.Effect of kindled seizures on rat behavior in water Morris maze test and amino acid concentrations in brain structures[J].Pharmacol Rep,2006,58(1):75-82.
[12] Shiota A,Hiramatsu M,Mori A.Amino acid neurotransmitters in iron-induced epileptic foci of rats[J].Res Commun Chem Pathol Pharmacol,1989,66(1):123-133.
[13] Snigdha S,Smith ED,Prieto GA,et al.Caspase-3activation as a bifurcation point between plasticity and cell death[J].Neurosci Bull,2012,28(1):14-24.
[14] D'Amelio M,Cavallucci V,Cecconi F.Neuronal caspase-3signaling:not only cell death[J].Cell Death Differ,2010,17(7):1104-1114.
[15] Chen X,Bao G,Hua Y,et al.The effects of topiramate on caspase-3expression in hippocampus of basolateral amygdala (BLA)electrical kindled epilepsy rat[J].J Mol Neurosci,2009,38(2):201-206.
[16] Henshall DC,Clark RS,Adelson PD,et al.Alterations in bcl-2and caspase gene family protein expression in human temporal lobe epilepsy[J].Neurology,2000,55(2):250-257.
(本文编辑:李珊珊)
ExperimentalstudyofHuanglianJiedudecoctioncombinedwithDingxianPillonYangxianEpilepticRats
LIXingjian,WUZhibing,YUZhengmiao,etal.
DepartmentofNeurology,FirstAffiliatedHospitalofGuangzhouUniversityofChineseMedicine,Guangdong,Guangzhou510405
ObjectiveTo explore anti-epileptic effects of Huanglian Jiedu decoction combined with Dingxian Pill on pilocarpine-yangxian epileptic rats.MethodsThe yangxian epileptic rat models were established by intraperitoneal injection of pilocarpine after being pretreated with high fat diet and Radix Aconiti Lateralis Preparata decoction. Then, they were treated with Huanglian Jiedu decoction and Dingxian Pill, which were referred as the yangxian Chinese medicine (CM) group. At the same time, the normal group, the yangxian group, and the yangxian CM converse therapy group were established to serve as controls. Symptomatological indexes like time spots of seizure latency period and status epilepticus (SE) were recorded; concentrations of five amino acid neurotransmitters in the brains including glutamic acid (Glu), aspartic acid (Asp), gamma-aminobutyric acid(GABA), glycine (Gly), and alanine (Ala) were detected by high-performance liquid chromatography; pathological changes including the lung, the kidney, the liver, the hippocampus and the cortex were observed by HE staining; the expression of caspase-3in brains were examined by immunohistochemisty.ResultsClass 4-5seizures were observed in all the rats in the yangxian group, the yangxian CM converse therapy group, and the yangxian CM group. The seizure latency period of the yangxian group was the longest, followed by the yangxian CM group, and the yangxian CM converse therapy group was the shortest. The latency time of SE of the yangxian CM group was the longest, and the yangxian group was the shortest, whereas the yangxian CM converse therapy group was in the midst. All the concentrations of the five amino acids in brains of epileptic rats decreased when compared with the normal group. Compared with the normal group, there were significant decrease in the concentrations of Glu and Asp of the yangxian group, all the amino acids of the yangxian CM converse therapy group, and Glu, Asp, GABA and Gly of the yangxian CM group (P<0.05,P<0.01). However, GABA, Gly and Ala of the yangxian group, and Ala of the yangxian CM group were no statistically significant decline (P>0.05). HE stain indicated severe damage in the lung, the kidney, the liver, the hippocampus and the cortex of all the epileptic rats, while all the tissues mentioned above of the normal group were normal. The expression of caspase-3of the yangxian group and the yangxian CM converse therapy group, which had more obvious elevation, ascended, while the yangxian CM group mildly descended as compared with the normal group, but there was no statistical difference among all the groups.ConclusionHuanglian Jiedu decoction combined with Dingxian Pill would delay the occurrence of SE of the yangxian epileptic rats, regulate part of the concentrations of the amino acid neurotransmitters in brains, and prohibit apoptosis of neurons.
Epilepsy; Huanglian Jiedu decoction; Dingxian Pill; Animal experiment
黎兴键(1985—),男,硕士。研究方向:中西医结合神经病学。
R742.1
A
1002-2619(2014)09-1388-04
2013-09-17)
△ 通讯作者:广州中医药大学第一附属医院脑病科,广东 广州 510405
