肾移植术后患者血清他克莫司浓度测定及影响因素分析
2014-08-28周小虎周燕张玉洁
周小虎 周燕 张玉洁
·药物研究·
肾移植术后患者血清他克莫司浓度测定及影响因素分析
周小虎 周燕 张玉洁
目的采用均相酶扩大免疫分析法(EMIT)测定肾移植患者术后不同时间他克莫司(FK506)血药浓度,探讨影响FK506血药浓度监测的相关因素。方法以78例CYP3A5 *3/*3型肾移植患者为研究对象,对术后不同时间FK506血药浓度与用药剂量、性别、年龄等因素的关系进行统计分析。结果术后1个月后,FK506剂量及血药浓度均随着术后时间的延长而逐渐降低。在同时间段内,男、女不同性别组患者FK506血药浓度差异无统计学意义(P<0.05)。肾移植术后的3个月内,女性患者血药浓度较男性患者血药浓度稍高。术后3个月老年组患者FK506血药浓度用药剂量及血药浓度均明显低于青年人组与中年人组(P<0.05)。结论肾移植后,FK506血药浓度随时间延长而变化,性别、年龄等因素对FK506的体内药物动力学具有一定的影响,应引起关注,从而使免疫抑制治疗更加合理。
肾移植;他克莫司;血药浓度;影响因素
他克莫司(FK506)是一种可广泛用于人体器官移植后抗排斥治疗的强有力脂溶性大环内酯类免疫抑制剂[1]。与另一种钙调蛋白抑制剂环孢素A类似,FK506的治疗窗窄且个体差异较大,临床需监测血药浓度并及时调整剂量,使其血药浓度维持在合理的治疗范围内,在不影响免疫抑制作用的前提下,尽量减少各种并发症的发生[2]。已有研究表明FK506血药浓度与机体代谢酶之一的细胞色素P450 3A5(CYP3A5)基因多态性呈显著相关,表达CYP3A5的*1/*1型患者及*1/*3型患者FK506浓度明显低于不表达CYP3A5的*3/*3型患者[3]。除了基因多态性的影响外,同一基因型患者血药浓度与剂量需求也存在差异[4]。为了进一步分析基因多态性之外的其他因素对FK506血药浓度的影响,指导临床更加合理用药,提高移植肾存活率。本研究对78例肾移植术后不同时间患者FK506血药浓度监测资料进行统计分析,以探讨器官移植术后患者年龄、性别、时间、剂量等因素对FK506血药浓度的影响。
1 资料与方法
1.1 一般资料 收集收集2011年6月至2013年5月襄阳市中心医院收治的肾移植患者92例,所有患者行CYP3A5基因型测定,将CYP3A5 *3/*3型患者78例纳入本研究。78例肾移植患者,术后共随访1 248例次,随访时间15 d~13年。其中男48例;平均年龄(44.6±10.2)岁;体重(63.9±9.5)kg,随访751例次,人均15.6次;女30例;平均年龄(45.1±11.7)岁;体重(54.4±8.2)kg,随访497例次,人均16.6次。
1.2 免疫抑制用药方案 肾移植患者术后治疗方案主要是:FK506+麦考酚酸酯(MMF)+泼尼松(Pred)三联免疫抑制治疗。FK506每日服用2次,剂量随术后时间、血药浓度检测结果及患者临床状况进行适当调整。
1.3 样品采集 78例肾移植患者患者服用FK506达稳态后,在服药之前采静脉血1.0 ml,以乙二胺四乙酸二钾(EDTA-K2)抗凝,测FK506谷浓度(C0)。
1.4 血药浓度测定 仪器为美国雅培TDxFLx血药浓度分析仪,并由与之配套的Emit2000他克莫司试剂盒、标准曲线以及质控药盒。FK506血药浓度测定方法采用均相酶扩大免疫分析法(EMIT)。

2 结果
2.1 术后不同时间FK506剂量及血药浓度监测结果比较 肾移植术后1个月内,FK506剂量及血药浓度均较术后1~3个月内低(P<0.05);术后1个月后,FK506剂量及血药浓度均随着术后时间的延长而逐渐降低(P<0.05)。见表1。
2.2 FK506血药浓度与肾移植患者性别及剂量的关系 在同时间段内,男、女不同性别组患者FK506血药浓度比较,差异均无统计学意义(P>0.05)。肾移植术后的3个月内,女性患者血药浓度较男性患者血药浓度稍高。见表2。
表1 术后不同时间FK506剂量及血药浓度监测结果比较
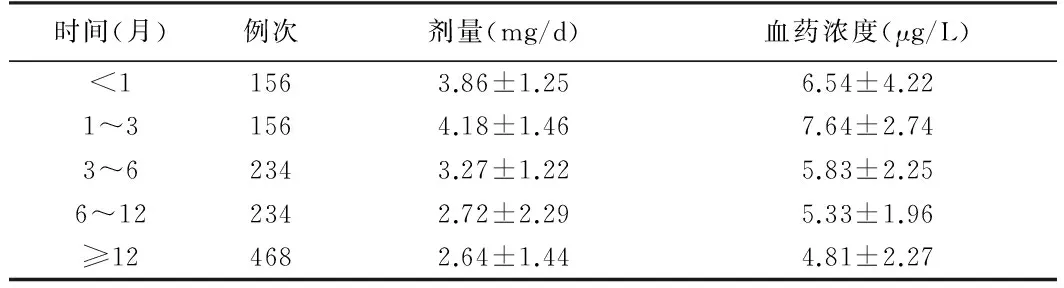
表1 术后不同时间FK506剂量及血药浓度监测结果比较
时间(月)例次剂量(mg/d)血药浓度(μg/L)<11563.86±1.256.54±4.221~31564.18±1.467.64±2.743~62343.27±1.225.83±2.256~122342.72±2.295.33±1.96≥124682.64±1.444.81±2.27
表2 FK506血药浓度与肾移植患者性别及剂量的关系

表2 FK506血药浓度与肾移植患者性别及剂量的关系
时间(月)男例次剂量(mg/d)血药浓度(μg/L)女例次剂量(mg/d)血药浓度(μg/L)<1883.96±1.536.35±4.17683.52±2.017.28±3.621~3914.32±1.367.52±3.28653.90±1.227.70±4.553~61323.45±1.415.99±3.651023.14±1.575.58±4.206~121482.75±1.245.51±2.44862.64±1.405.28±2.19≥122922.68±1.334.97±2.951762.58±1.514.71±1.83
2.3 FK506血药浓度与肾移植患者年龄及剂量的关系 78例患者按年龄分为3个年龄段组,分别为青年人(19~45岁)组,随访855例次;中年人(45~59岁)组,随访280例次;老年人(≥60岁)组,随访113例次。3个不同年龄段患者FK506用药剂量和血药浓度随着年龄的增加呈下降趋势。术后3个月老年组患者FK506血药浓度用药剂量及血药浓度均明显低于青年人组与中年人组,差异均有统计学意义(P<0.05)。见表3。
3 讨论
FK506+MMF+Pred三联免疫抑制治疗方案为肾移植术后经典的抗排斥治疗方案[5]。Bosmüller等[6]报道采用FK506+MMF+Pred三联疗法的肾移植患者FK506血药浓度C0:术后1个月内、1~3、4~6、7~12、≥12个月分别为5~12、7~12、6~11、6~10、7~9μg/L,且存在一定的个体差异,与本研究结果基本一致。由于FK506等钙调神经磷酸酶抑制剂一旦超过治疗窗即会引起肾脏毒性在内的多种严重不良反应,影响了肾移植患者的存活时间[7]。因此,统一FK506的用药剂量或血药浓度对于不同个体而言,并不能解决性别、年龄及种族等差异造成的免疫抑制强度的需求差异。临床肾移植患者服用FK506后,加强血药浓度监测具有重要意义。
表3 FK506血药浓度与肾移植患者年龄及剂量的关系

表3 FK506血药浓度与肾移植患者年龄及剂量的关系
时间(月)19~45岁例次剂量(mg/d)血药浓度(μg/L)45~59岁例次剂量(mg/d)血药浓度(μg/L)≥60岁例次剂量(mg/d)血药浓度(μg/L)<11064.14±1.526.10±1.52373.78±1.166.86±0.51133.56±0.516.58±1.341~31104.36±1.757.88±1.02353.75±1.087.44±1.28113.60±0.287.10±0.563~62123.37±0.58*6.69±0.53*742.97±0.22*5.72±1.26*262.44±0.234.52±0.336~122182.85±0.17*6.01±1.32*722.72±0.54*5.61±1.03*222.40±0.754.08±0.29≥124202.79±0.33*5.12±1.57*1522.46±0.19*4.73±0.94*521.78±0.583.19±0.54
注:与老年组比较,*P<0.05
FK506口服后主要经肝脏和肠道代谢,于回肠、空肠处吸收,代谢产物通过胆汁排出,而原型药物则很少排出,在排泄物中的原型药物尚不足1%[8]。FK506吸收或代谢过程一旦出现异常,很容易造成药物的蓄积性中毒[9],尤其是肾移植术后肝功能不全患者应密切观察其血药浓度变化及肝肾功能[10],并随时对FK506剂量进行调整,尽量减少术后不良反应或并发症的发生。本研究中有1例肾移植患者,术后6个月时出现FK506相关性肝功能不全,此时该患者并未按照医嘱调整FK506口服剂量,而是服用五酯胶囊进行护肝治疗,胆红素及氨基转移酶等肝功能非但没有降低,FK506的血药浓度则由6.2 μg/L升高至9.8 μg/L,及时告知医生后,经FK506血药浓度监测后及时降低口服剂量并换用护肝药物后,病情得以好转。
本研究结果显示,术后1个月内,FK506剂量及血药浓度均较术后1~3月内低,可能与肾移植患者的肾功能尚处于临床恢复阶段有关,术后1个月后,FK506剂量及血药浓度均随着术后时间的延长而逐渐降低。在同时间段内,男、女不同性别组患者FK506血药浓度差异无统计学意义(P>0.05)。肾移植术后的3个月内,女性患者血药浓度较男性患者血药浓度稍高,可能与女性患者的体质、肾功能恢复及代谢消除较慢有关。3个不同年龄段患者FK506用药剂量和血药浓度随着年龄的增加呈下降趋势。术后3个月老年组患者FK506血药浓度用药剂量及血药浓度均明显低于青年人组与中年人组(P<0.05),可能与老年患者体内P糖蛋白及细胞色素P4603A(CYP3A)活性发生变化有关[11]。
总之,重视监测肾移植患者FK506血药浓度并坚持定期随访,对减少不良反应及并发症的发生,具有重要意义。肾移植1个月后,FK506血药浓度随着时间的延长而逐渐降低,使其达到目标血药浓度的所需剂量也随之减少。性别、年龄等因素对FK506的体内药物动力学具有一定的影响,在口服包括FK506在内的治疗方案时,这些因素也应引起关注,从而使免疫抑制治疗更加合理。
1 Kramer BK, Klinger M, Vítko S, et al.Tacrolimus-based, steroid-free regimens in renal transplantation: 3-year follow-up of the ATLAS trial.Transplantation,2012, 4:492-498.
2 张鑫,刘志红,郑敬民,等.肾移植患者他克莫司血药浓度的影响因素.肾脏病及透析肾移植杂志,2005,14:333-338.
3 Connor A, Prowse A, Mac Phee I, et al.Generic tacrolimus in renal transplantation: trough blood concentration as a surrogate for drug exposure.Transplantation,2012, 93:e45-46.
4 Hirsch HH, Vincenti F, Friman S, et al.Polyomavirus BK replication in de novo kidney transplant patients receiving tacrolimus or cyclosporine: a prospective, randomized, multicenter study.Am J Transplant,2013, 13:136-145.
5 邹素兰,蒋艳,陈荣.肾移植患者他克莫司血药浓度监测的临床分析.中国药房,2012,23:3966-3967.
6 Bosmüller C, Ollinger R, Sieb M, et al.Tacrolimus monotherapy following alemtuzumab induction in combined kidney-pancreas transplantation: results of a prospective randomized trial.Ann Transplant,2012,17:45-51.
7 石磊,龚丽娴,姚丽雯,等.肾移植术后他克莫司血药浓度监测.广东医学,2005,26:1272-1273.
8 Gaber AO, Moore LW, Alloway RR, et al.Acute rejection characteristics from a prospective, randomized, double-blind, placebo-controlled multicenter trial of early corticosteroid withdrawal.Transplantation,2013,95:573-579.
9 张燕燕,张晓东,李瑛,等.肾移植术后患者肺部感染及预后因素分析.河北医药,2013,35:1013-1015.
10 闫巍,韩修武,邢晓燕,等.肾移植术后吗替麦考酚酯和硫唑嘌呤导致白细胞减少症的临床分析.河北医药,2010,32:784-786.
11 Balicki I.Clinical study on the application of tacrolimus and DMSO in the treatment of chronic superficial keratitis in dogs.Pol J Vet Sci,2012,15:667-676.
10.3969/j.issn.1002-7386.2014.07.056
44100 湖北省襄阳市中医医院药学部(周小虎);湖北省襄阳市药品检验所(周燕);湖北省襄阳市中心医院(张玉洁)
周燕,44100 湖北省襄阳市药品检验所;
E-mail:1434323793@qq.com
R 617
A
1002-7386(2014)07-1083-03
2013-12-02)
