锌指蛋白ZBTB20基因重组腺病毒表达载体的构建和鉴定*
2014-08-08朱晓彤周露婷章卫平施广霞陈玉霞
朱晓彤, 杨 瑞, 周露婷, 张 晔, 李 玲, 章卫平, 施广霞, 陈玉霞△
(1第二军医大学基础部病理生理学教研室, 上海 200433; 2大连医科大学病理生理学教研室,辽宁 大连 116044)
锌指蛋白是一类含有锌指结构的DNA结合蛋白,可以正向或者负向地调控基因的转录活性,在个体发育、定向分化、细胞增殖、凋亡和功能调节等生命过程中发挥重要作用。含锌指和BTB区蛋白20(zinc finger and BTB domain containing 20, ZBTB20)由741个编码氨基酸组成,N端含有POZ结构域(通常介导蛋白间的相互作用),C端含有5个C2H2锌指结构域(通常介导DNA 的结合),与已知的POZ锌指蛋白B细胞淋巴瘤6(B-cell lymphoma 6,BCL6)和前髓细胞性白血病锌指蛋白(promyelocytic leukaemia zinc finger protein, PLZF) 有30%~40%的同源性[1]。利用ZBTB20基因特异性敲除小鼠模型,本实验室揭示了ZBTB20在个体发育、物质代谢和神经调控等方面有重要的生理功能[2-7]。尽管如此,目前国际上对其生物学功能的认识仍然非常有限。本研究拟构建ZBTB20的重组腺病毒表达载体,并验证该重组腺病毒在原代肝细胞和小鼠肝脏组织中介导的ZBTB20过表达情况及功能活性,为进一步研究ZBTB20在肝脏的生物学功能奠定基础。
材 料 和 方 法
1 材料和试剂
人ZBTB20表达载体pBFN-ZBTB20-FLAG为本实验室所存,pAdEasy-1/BJ5183菌为本实验室自行制备;感受态大肠杆菌DH-5α购自Stratagene;高糖DMEM细胞培养基、胎牛血清、生理盐水购自HyClone;转染试剂Lipofectamine 2000 购自Gibco-BRL;限制性内切酶购自New England Biolabs;T4连接酶购自TaKaRa;小量质粒抽提试剂盒购自Omega;DNA凝胶回收试剂盒购自Axygen;双萤光素酶检测试剂盒购自Promega;ZBTB20抗体为本实验室自行制备;FLAG抗体M2购自Sigma;β-tubulin抗体购自Proteintech;HRP标记的羊抗兔与羊抗小鼠II抗购自Cell Signaling。
2 方法
2.1pAd-ZBTB20重组腺病毒载体的构建与鉴定BglⅡ/NotⅠ双酶切含FLAG标签的人ZBTB20(short isoform)表达质粒pBFN-ZBTB20-FLAG,回收ZBTB20-FLAG的 cDNA片段(约2.2 kb),克隆至穿梭质粒pAdTrack-CMV[约9.2 kb,携带有绿色荧光蛋白(green fluorescent protein,GFP)基因序列],得到重组的穿梭载体pAdTrack-ZBTB20。将重组的穿梭载体经PmeⅠ酶切线性化后,利用电转化法将其转化到预转化有pAdEasy-1的感受态细菌BJ5183中进行同源重组,并在卡那霉素抗性的培养基上进行筛选,挑取单克隆,利用PacⅠ酶切鉴定后,最终得到重组成功的腺病毒载体pAd-ZBTB20;将其转化至DH-5α感受态细菌中,纯化制备质粒DNA。
2.2重组腺病毒Ad-ZBTB20的包装、扩增、纯化及滴度测定 包装和扩增:利用Effectene转染试剂将2 μgPacⅠ酶切线性化的pAd-ZBTB20质粒转染293细胞,转染10~14 d后观察到部分细胞出现细胞病变反应(cytopathic effect, CPE)。待细胞完全被病毒感染后,收集细胞,于干冰和37 ℃水浴反复冻融并剧烈振荡细胞3次,释放出腺病毒。将收集到的病毒液重复感染293细胞3次,最后一次细胞培养规模为3×108,使腺病毒进一步扩增,从而得到更高滴度的腺病毒Ad-ZBTB20。 纯化:将最后收集到的病毒液转移至12 mL离心管中,加入适量的CsCl,调整密度至(1.32~1.35)×103g/L之间,封以液体石蜡,于10 ℃、176 000×g离心20 h。穿刺收集浓缩的病毒条带,转移入透析袋(截留分子量为10 kD),浸入200倍于病毒液体积的透析液中(透析液配方:4%蔗糖,10 mmol/L Tris-HCl pH 8.0,2 mmol/L MgCl2),4 ℃透析过夜去盐后分装保存于-80 ℃。滴度测定:因重组腺病毒载体带有GFP基因,感染细胞后能同时分别表达GFP和ZBTB20,故而我们采用流式细胞术检测病毒滴度:接种细胞于12孔板,密度为4×105。次日加入倍比稀释后的含重组腺病毒Ad-ZBTB20的培养液,孵育24 h后消化收集细胞,调整细胞悬液体积为1 mL,计数板计细胞数,取200 μL上机检测GFP阳性的细胞比例,据如下公式计算病毒滴度[GFU(green fluorescent unit)/mL]=GFP阳性细胞比例×每孔细胞数/培养液体积(mL)×病毒稀释度[8]。
2.3重组腺病毒感染的离体细胞模型与在体小鼠模型的建立 离体细胞模型:采用本室建立的两步原位胶原酶灌注法分离肝脏组织特异性ZBTB20基因敲除小鼠的原代肝细胞[9],接种于6孔板中进行培养。待肝细胞贴壁后,用PBS清洗2遍,分别加入含有腺病毒Ad-ZBTB20和对照腺病毒Ad-GFP的无血清培养基, 病毒感染复数(multiplicity of infection, MOI)=5~10,孵育12 h后更换以含10% FBS的新鲜培养基继续培养48 h,用于后续实验。小鼠在体模型:取肝脏组织特异性ZBTB20基因敲除的同窝小鼠,经尾静脉分别缓慢注射重组腺病毒Ad-ZBTB20和对照病毒Ad-GFP 各5×109(用PBS调整至总体积200 μL),常规饲养3 d后,经4%水合氯醛溶液麻醉放血后取肝脏组织,迅速冻存于液氮。
2.4蛋白表达的检测(Western blotting法) 称量50 mg液氮冻存的肝脏组织,加入0.5 mL RIPA蛋白裂解液,冰上匀浆后常规制备蛋白样品。蛋白样品经Bradford法定量后取20 μg跑8% SDS-PAGE,转移至PVDF膜,5%脱脂牛奶封闭后先后与小鼠抗ZBTB20单克隆抗体9A10[3](1∶1 000)或小鼠抗FLAG抗体M2(1∶1 000)、兔抗小鼠IgG Ⅱ抗(1∶10 000)杂交,ECL法显影检测ZBTB20或FLAG蛋白的含量。再经0.2 mol/L NaOH洗膜去除前述抗体后再先后与兔抗小鼠β-tubulin特异性抗体(1∶10 000,作为内参照)、山羊抗兔IgG Ⅱ抗(1∶10 000)杂交,ECL法显影检测β-tubulin蛋白的含量。
2.5甲胎蛋白-萤光素酶报告基因(alpha fetoprotein-luciferase reporter, AFP-luc)活性的检测 分离ZBTB20肝脏特异性敲除小鼠的原代肝细胞,以每孔1.5×105的密度接种于24孔板。待细胞贴壁后,加入重组腺病毒Ad-ZBTB20或Ad-GFP(MOI=1~100)孵育过夜。更换新鲜培养液4 h后,用脂质体Lipofectamine 2000试剂转染含AFP启动子序列的萤光素酶报告基因质粒(pAFP-luc)[4]200 ng和内参照质粒(pRLSV40-Luc)10 ng,转染12 h后更换以新鲜培养液继续培养48 h,裂解细胞,检测萤光素酶的活性。实验重复3次 。
3 统计学处理
数据用均数±标准差(mean±SD)表示,采用t检验比较各组间萤光素酶活性的差异。以P<0.05为差异有统计学意义。
结 果
1 重组腺病毒载体pAd-ZBTB20的构建和鉴定
BglⅡ/NotⅠ双酶切鉴定得到的重组穿梭质粒pAdTrack-ZBTB20,可见约9.2 kb和2.2 kb片段,提示重组穿梭载体构建成功,见图1A。PmeI线性化的重组穿梭载体pAdTrack-ZBTB20与腺病毒骨架质粒 pAdEasy-1在BJ5183细菌中同源重组,将得到的重组腺病毒质粒pAd-ZBTB20经PacⅠ酶切鉴定,可见约30 kb和3 kb大小的2个片段,提示成功同源重组,见图1B。
2 重组腺病毒载体Ad-ZBTB20的包装及滴度测定
用Effectene转染试剂将线性化后的pAd-ZBTB20转染293细胞,转染48 h时可见散在绿色荧光,至第13天,可见明显的细胞毒效应,大多数细胞变圆漂起(图2A),并且所有细胞均有绿色荧光(图2B)。收集细胞,经干冰和37 ℃水浴反复冻融并剧烈振荡3次,收集含病毒的细胞裂解液上清,流式细胞术检测此病毒滴度为9.1×1010/L。反复感染3次,收获病毒总量为6.87×1011。氯化铯超速离心后可见白垩色病毒条带,穿刺抽吸出病毒条带并透析去盐后,用流式细胞术测得滴度为5.7×1013/L。

Figure 1. Identification of the recombinant vectors by the restrictive endonucleases.A: recombinant shuttle vector digested by Bgl Ⅱ/NotⅠ; 1: pAdTrack-ZBTB20;B: recombinant adenovirus vector digested by PacⅠ; 1:pAd-ZBTB20.
3 重组腺病毒Ad-ZBTB20的表达检测
感染对照腺病毒的细胞未检测到ZBTB20蛋白(这与ZBTB20基因特异性敲除的表型相一致),而感染重组腺病毒Ad-ZBTB20的细胞表达有高丰度的ZBTB20蛋白,其表达水平随着MOI值的增加而增高。我们以ZBTB20基因所携带的FLAG标签蛋白为检测对象,也得到了同样的结果,见图3。这提示我们所构建的重组腺病毒在离体培养的细胞中能成功表达目标蛋白ZBTB20。重组腺病毒Ad-ZBTB20在小鼠肝脏组织也能成功表达ZBTB20蛋白,见图4。

Figure 3. Adenovirus-mediated ZBTB20 protein overexpression in the primary hepatocytes from the liver-specific ZBTB20 knockout mice.
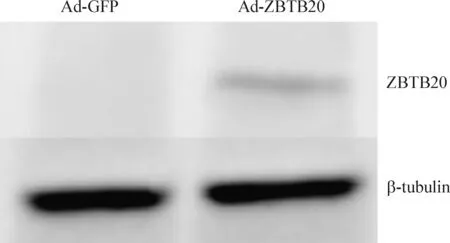
Figure 4. Adenovirus-mediated ZBTB20 protein overexpression in the hepatic tissue of liver-specific ZBTB20 knockout mice.
4 重组腺病毒Ad-ZBTB20介导表达的ZBTB20蛋白功能活性的分析
在原代肝细胞模型,重组腺病毒Ad-ZBTB20显著抑制AFP-luc的活性;当MOI值为1、10和100时,抑制率分别为26.7%、90.9%和79.4%,见图5。
讨 论
新型锌指蛋白ZBTB20是首先从人树突状细胞中克隆并率先报道的含BTB/POZ结构域的锌指蛋白家族新成员。利用ZBTB20全身和组织特异性敲除小鼠模型,我们实验室近年来的研究表明ZBTB20参与了机体多种组织器官的发育、糖脂等物质代谢、学习记忆能力的调节以及肿瘤发生发展等过程的调节[2-7]。

Figure 5. Inhibitory effect of adenovirus-mediated overexpression of ZBTB20 protein on AFP gene transcription in the primary hepatocytes. Mean±SD. n=3. **P<0.01 vs Ad-GFP group at the same MOI.
ZBTB20基因敲除小鼠表现为出生后生长发育迟缓、生殖能力降低、死亡率升高、低血糖、能量贮备能力降低、多种代谢相关激素水平异常(如胰高血糖素水平升高,胰岛素水平降低,抵抗素水平升高等);此外,还存在海马、垂体发育异常等表型[2-3]。利用海马成熟的CA1区特异性ZBTB20敲除小鼠模型,我们发现ZBTB20缺失导致长期学习能力和记忆力降低,N-甲基-D-天冬氨酸(N-methyl-D-aspartate, NMDA)受体介导的兴奋性突触后电流减弱,同时存在细胞外信号调节激酶(extracellular signal-regulated kinase, ERK)和cAMP 反应元件结合蛋白(cAMP response element binding protein, CREB)磷酸化水平降低。这提示ZBTB20参与学习记忆能力的形成[5]。此外,利用ZBTB20肝脏特异性基因敲除小鼠模型,本实验室的研究发现ZBTB20是胚胎出生后关闭肝脏AFP转录表达的关键转录抑制因子[4]。另外,ZBTB20还是肝癌预后的一个独立预警因素:与正常肝脏组织和癌旁组织相比,肝癌组织中ZBTB20 mRNA 和蛋白表达水平明显增加,并且与静脉侵袭、复发、转移的发生率密切相关。高表达ZBTB20蛋白的肝癌患者无瘤生存期和总存活期明显较低表达者为低[10]。而且,ZBTB20近来也被发现是汉族人患非贲门胃癌的易感基因[11]。这些均提示新型转录因子ZBTB20在细胞恶变过程中也发挥着积极的作用。尽管这样,关于ZBTB20的生物学功能、其调控的下游靶基因以及介导的信号转导通路仍有许多未明之处。
AdEasy腺病毒过表达系统是目前应用最为广泛的病毒表达载体,其原理是通过同源臂重组的方式在细菌中获得重组腺病毒基因组质粒,将克隆了外源基因的腺病毒穿梭质粒(pAdTrack-CMV)与携带了腺病毒大部分基因组的质粒(pAdEasy) 共转化RecA+细菌,在细菌RecA重组酶的作用下经抗性筛选获得重组腺病毒基因组质粒,将其线性化后转染293细胞获得重组腺病毒。重组腺病毒是非整合型双链DNA病毒,因而无插入突变,无致癌性。它具有转染分裂期和非分裂期细胞的能力,且易于构建、浓缩和纯化,出毒率较高。重组腺病毒通过腹腔或尾静脉注射后具有肝脏组织聚集性,因而成为研究肝脏生物学的重要病毒载体[12]。我们前期的研究提示ZBTB20在肝脏物质代谢、肝癌的发展中具有重要作用,因此具有肝脏靶向性的腺病毒表达载体无疑是我们进一步研究ZBTB20在肝脏的生物学功能及其作用机制的首选工具。
我们利用AdEasy系统构建了ZBTB20的重组腺病毒表达载体,该重组腺病毒感染离体细胞或在体注射后均能成功过表达ZBTB20蛋白。ZBTB20作为一种转录因子,其功能活性表现在调节下游靶基因的转录。我们前期的研究表明AFP是ZBTB20的靶基因之一,ZBTB20能特异性抑制AFP基因的转录。利用报告基因技术,我们进一步证明重组腺病毒介导过表达的ZBTB20蛋白能够显著抑制AFP基因的转录,提示所构建的重组腺病毒能够成功表达有功能活性的ZBTB20蛋白,为深入研究ZBTB20在肝脏的生理病理学作用及其作用靶点提供了有效的工具。另外,我们还在ZBTB20蛋白C末端连上了FLAG标签,这为将来通过免疫共沉淀方法富集、纯化ZBTB20的共作用蛋白提供了便利。
[参 考 文 献]
[1] Zhang W, Mi J, Li N, et al. Identification and characterization of DPZF, a novel human BTB/POZ zinc finger protein sharing homology to BCL-6 [J]. Biochem Biophys Res Commun, 2001, 282(4):1067-1073.
[2] Sutherland A, Zhang H, Zhang Y, et al. Zinc finger protein Zbtb20 is essential for postnatal survival and glucose homeostasis[J]. Mol Cell Biol, 2009, 29(10): 2804-2815.
[3] Xie Z, Ma X, Ji W, et al. Zbtb20 is essential for the specification of CA1 field identity in the developing hippocampus[J]. Proc Nat Acad Sci U S A, 2010,107(14):6510-6515.
[4] Xie Z, Zhang H, Tsai W, et al. Zinc finger protein ZBTB20 is a key repressor of alpha-fetoprotein gene transcription in liver[J]. Proc Nat Acad Sci U S A, 2008, 105(31):10859-10864.
[5] Ren AJ, Zhang H, Xie ZF, et al. Regulation of hippocampus-dependent memory by the zinc finger protein Zbtb20 in mature CA1 neurons[J]. J Physiol (London), 2012, 590(Pt 19): 4917- 4932.
[6] Zhang Y, Xie Z, Zhou L,et al. The zinc finger protein ZBTB20 regulates transcription of fructose-1,6-bisphosphatase 1 and β cell function in mice[J]. Gastroenterology, 2012, 142(7):1571-1580.e6.
[7] 周光迪, 麻献华, 张 晔, 等. 抗新型锌指蛋白ZBTB20单克隆抗体的制备和鉴定[J]. 中国病理生理杂志, 2010, 26(3):617-619.
[8] Hitt DC, Booth JL, Dandapani V, et al. A flow cytometric protocol for titering recombinant adenoviral vectors containing the green fluorescent protein[J]. Mol Biotechnol, 2000, 14(3):197-203.
[9] 王 燕, 周露婷, 章卫平, 等. 高活力原代小鼠肝细胞的分离与纯化[J]. 医学研究杂志, 2011, 40(3):28-31.
[10] Wang Q, Tan Y, Ren Y, et al. Zinc finger protein ZBTB20 expression is increased in hepatocellular carcinoma and associated with poor prognosis[J]. BMC Cancer, 2011, 11: 271.
[11] Shi Y, Hu Z, Wu C, et al. A genome-wide association study identifies new susceptibility loci for non-cardia gastric cancer at 3q13.31 and 5p13.31[J]. Nat Genet, 2011, 43(12):1215-1218.
[12] Luo J, Deng ZL, Luo X, et al. A protocol for rapid generation of recombinant adenoviruses using the AdEasy system[J]. Nat Protoc, 2007, 2(5):1236-1247.
