热解吸法评价铒氢化物晶体结构的热稳定性
2014-08-07王维笃彭述明梁建华周晓松程贵钧
王维笃,彭述明,梁建华,周晓松,程贵钧
(中国工程物理研究院 核物理与化学研究所,四川 绵阳 621900)
稀土金属作为贮氢薄膜材料在科学和工业仪器中广泛应用,铒氢化物由于其特殊的热力学、磁学和光学性质持续受到关注。热稳定性是评价金属氢化物应用特性的一项重要物理性能指标,热解吸分析是评价金属氢化物热稳定性的理想实验技术之一。Gabis等[1]和Ferrizz[2-3]近年来先后采用这一技术,研究了铒氢化物薄膜的热解吸动力学,初步获得了升温速率及制样参数对铒氢化物热解吸行为的影响规律,探索了铒氢化物中氢的热解吸机理。关于铒氢化物热力学的研究已非常深入。Lundin[4-5]和Pebler等[6]采用压强组成等温线(PCT曲线)测试和X射线衍射分析(XRD)的方法,确认了铒氢化物具有3种物相结构,分别为hcp结构铒氢化物固溶相(α相)、fcc结构铒氢化物相(β相)和hcp结构铒氢化物固溶相(γ相),并发现物相结构对铒氢化物热稳定性有显著影响。研究和认识铒氢化物组织结构与其热解吸动力学特性间的关系具有重要的科学意义。Tewell等[7]采用X射线光电子能谱(XPS)分析技术,揭示了γ相铒氢化物热解吸温度高于热力学预期的主要影响机制是表面氧化层的存在。Mark等[8]采用飞行时间中子衍射原位分析方法,对β相铒氘化物中氘原子占位及其稳定性进行了研究,证实了氘原子占据CaF2型fcc结构八面体间隙位置情况的存在,发现氘原子占据八面体间隙和四面体间隙位置时,铒氘化物中氘的稳定性具有显著差异。本文采用程序升温法测定γ相铒氘化物的热解吸谱(TDS),并对TDS精细结构进行分析,为建立铒氢化物晶体结构与其热稳定性的定量关系提供新的证据。
1 实验
1.1 实验装置
实验装置为基于压强分析原理的金属氢化物热解吸测试系统。该系统由特殊设计的样品室、真空获得设备、压强和温度测量与控制装置等设备组成。样品室体积为3.9 mL,属于积分反应器,温度控制误差为±0.5 ℃;测量与控制装置主要包括0.05级真空压力测量仪(测量范围0~133 kPa,分辨力1 Pa)、KP1000型数字式温控仪(Ⅰ级K型热电偶测温,测量范围-200~1 370 ℃)和ZDF-Ⅳ型复合真空计(测量范围105~10-8Pa);系统管路体积为430 mL;系统工作真空度为10-5Pa,漏率小于5×10-7Pa·L/s。
1.2 实验样品
实验样品为充分活化的β+γ相铒氘化物ErD2.6粉末,其制备方法如下:将99.95%的高纯铒棒料表面用锉刀打磨去除氧化层,使其呈现银灰色金属光泽,用分析纯丙酮擦拭去污后自然风干,装入样品室真空除气至850 ℃后用纯度99%的氘气充分活化,除气过程真空度优于5×10-4Pa,充分活化的样品在每次热解吸分析实验前真空除气至850 ℃、5×10-4Pa,在450 ℃和200 ℃下恒温吸氘至D/Er原子比为2.6,关闭样品室阀门冷却至室温,回收系统和样品室内剩余氘气后备用。
1.3 实验方法
实验采用静态真空程序升温热解吸方法(TPD),热解吸温度范围为室温至900 ℃,升温速率分别为20、30、40 ℃/min。实验步骤为:设定好升温程序,系统抽真空至5×10-4Pa后密封,打开样品室阀门,加热样品并记录压强(p)随温度(T)和时间(t)变化的积分数据,采样时间间隔为1 s,对实验数据进行适当的微积分转换并绘制p-T曲线,即热解吸谱。
2 结果与讨论
2.1 热解吸谱解析
ErD2.6的热解吸谱示于图1。从图1可看出,20、30、40 ℃/min下ErD2.6的热解吸谱均有5个谱峰,与文献[1-3]报道的一致,均发现了与图1第Ⅱ热解吸谱峰(200~300 ℃)及第Ⅴ热解吸谱峰(800~900 ℃)类似的热解吸谱峰,并确认这两个谱峰分别为ErD2和ErD3中D2的大量释放峰,Ferrizz也观测到了与图1第Ⅲ热解吸谱峰(300~360 ℃)类似的极小谱峰,但并未引起足够的注意,也未明确给出合理解释。此外,本实验在600~700 ℃区间也重复观测到另一极小谱峰——第Ⅳ热解吸谱峰。通过解析金属氢化物中氢/氦的热解吸谱精细结构,来识别和预测氢/氦存在状态及其份额的方法已被业内广泛认同和普遍采用。铒氢化物体系的大量基础研究报道为识别氢在铒氢化物中的存在状态提供了必要的依据。
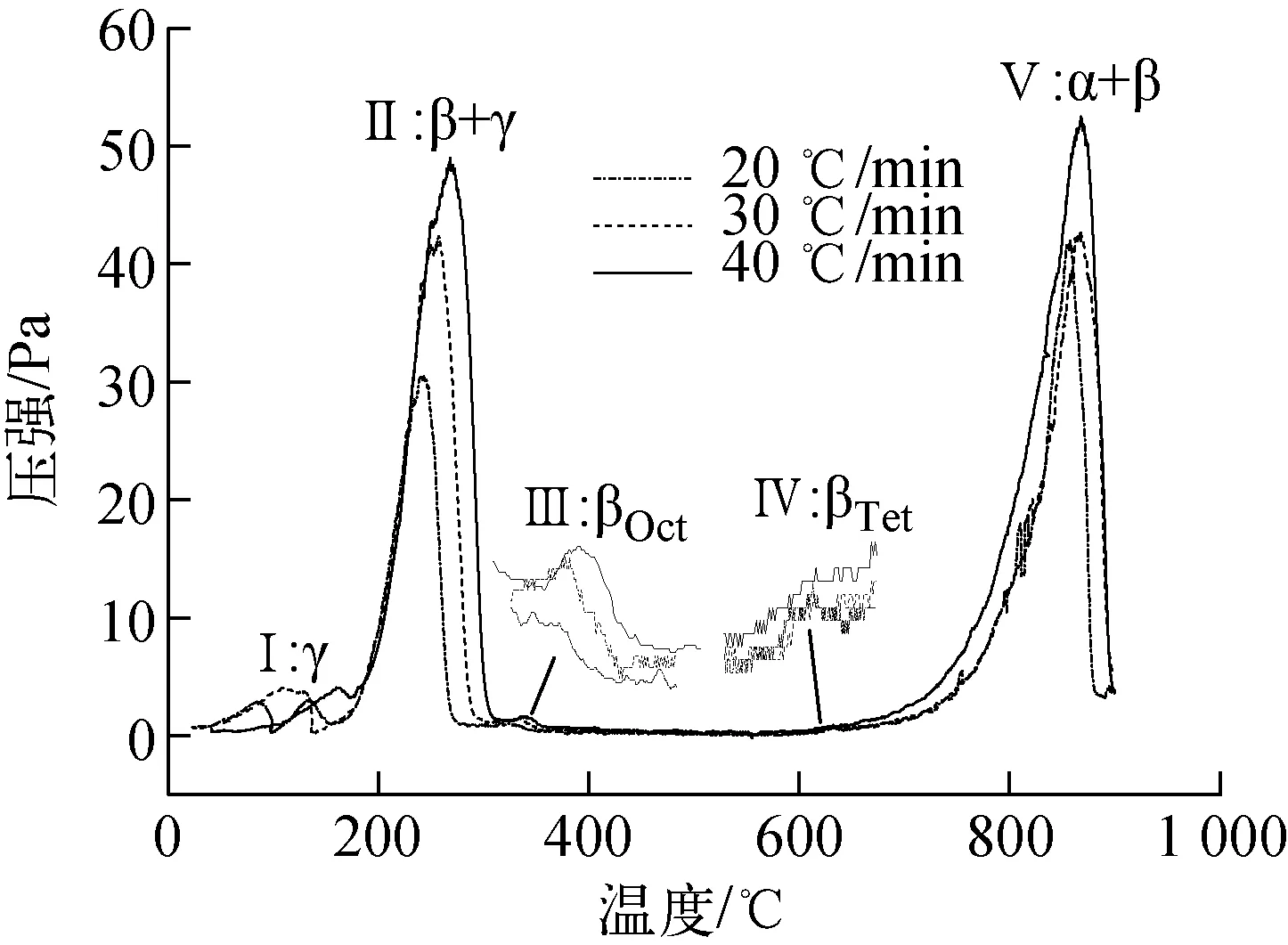
图1 不同升温速率下的ErD2.6热解吸谱
欲解析铒氢化物热解吸谱,需从公认的铒氢化物相与原子比的关系[9]入手:1) D/Er<0.35时为α固溶相,其晶体结构与铒一致,保持hcp结构;2) 0.35
综上所述,按照相变理论及热解吸规律,ErD3的热解吸谱从低温到高温方向依次应出现γ相、β+γ相、βOct相、βTet相、α+β相和α相氘化物中氘的释放峰。首先,根据不同物相的铒氢化物TDS谱峰峰强与氢含量的关系,可判定实验第Ⅱ热解吸峰和第Ⅴ热解吸峰分别为βOct+γ相和α+βTet相氘化物中氘的释放峰,这两个区间氘大量释放引起氘气压强的显著变化。图1中第Ⅰ热解吸谱峰出现在小于200 ℃的位置,该位置应出现γ相氘化物中氘的释放峰,但由于实验系统在200 ℃以下为非线性升温,因此图中的谱峰不能代表γ相的真实分解状态。同理,由于实验系统样品室温度的限制,900 ℃下铒氘化物尚未完全分解,因此第Ⅳ热解吸谱峰也不能完全代表该热解吸速率下铒氘化物α+βTet的真实分解状态,但实验能说明fcc结构的α+βTet相铒氘化物具有良好的热稳定性。依据氘释放量、热解吸温度和Mark关于ErD2形成过程的飞行时间中子衍射原位分析结果,有理由相信图1中第Ⅲ和第Ⅳ两个极小热解吸峰分别代表βOct相和βTet相铒氘化物中氘的释放过程。Mark发现氘气压强低于1 kPa时铒能快速吸氘形成接近ErD2的化学式存在的β相氘化物,此时氘占据fcc结构的四面体间隙位置,当氘气压强超过26.6 kPa和66.5 kPa后,氘在fcc结构的八面体间隙占位分别为5%和9%,而450 ℃下抽真空至10-2Pa后,八面体位置的氘移除而四面体位置未受影响。这说明D/Er在1.8~2.0区间为β相稳定区间,而D/Er 在2.0~2.2区间晶体结构虽未发生改变,但其中八面体间隙位置的氢依旧是不稳定的,这两个区间氢含量变化仅为0.2个D/Er原子比,而且两种占位的稳定性具有显著差异,其热稳定性和氢含量均与图1分析结果恰好吻合,是确立铒氢化物中氢占位与TDS氘释放峰对应关系的直接证据。
2.2 热解吸活化能
采用适当的热解吸动力学模型对TDS进行解析,能获得金属氢化物的热解吸表观活化能等动力学参数,为建立其热解吸动力学定量认识提供依据。Ferrizz[2]对金属氢化物的热解吸动力学模型进行了系统的分析比较,认为Gabis模型[1]的前提条件是假定氢在金属氢化物中的扩散速率极快,即扩散为非控速步骤,因此氢化物相和固溶相中氢浓度梯度几乎为零,ErD3高温下的热解吸反映符合这种假设。考虑到真实的热解吸反应存在吸附与脱附行为的竞争等情况,Ferrizz[2]认为这种情况下采用Redhead[10]模型进行TDS解析更为理想。本文从图1中读取各热解吸谱峰温度,采用Redhead模型(式1)计算得到了铒氘化物各相变过程对应的热解吸活化能(表1),结果显示不同物相氘化物解吸氘的表观活化能具有显著差异,这可用来解释不同物相铒氢化物热稳定性的明显不同,而造成解吸氘的表观活化能不同的根本原因是氢在晶体结构中各种占位状态的结合能差异。由表1还可看出,升温速率对铒氘化物的热解吸活化能无显著影响,间接说明了动力学模型的合理性。基于解吸活化能不受升温速率影响的前提,式(1)可变换为式(2),基于某一升温速率β0下金属氢化物的TDS和Redhead模型,通过模拟计算能获得其他任意升温速率β下的TDS,由此可对其他升温速率下的热稳定性进行评价。这一实验与理论分析方法在其他金属氢化物动力学及热稳定性评价中具有推广应用价值。
(1)
(2)
式中:ED为解吸活化能,J/mol;R为气体常数,取8.314 J/(mol·K);ν为频率因子,取1013s-1;β0为热解吸实验升温速率,K/s;T0为升温速率β0下测定的TDS温度,K;β为任意升温速率,K/s;T为升温速率β下的TDS温度,K。
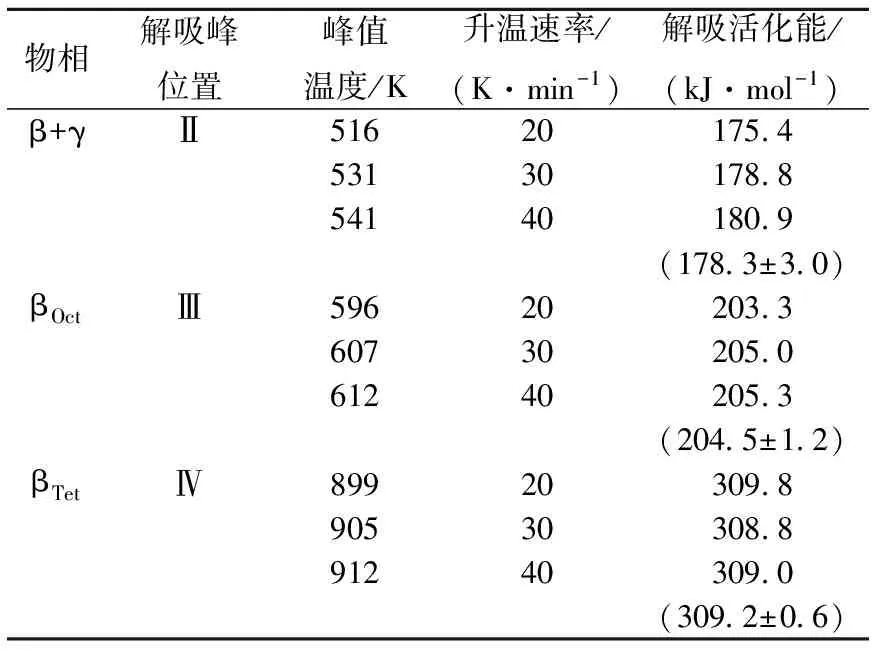
表1 ErD2.6各物相热解吸动力学参数
3 结论
本文建立了铒氘化物实验热解吸谱峰与晶体精细结构的对应关系,确认了面心立方结构β相铒氘化物中八面体间隙占位氘(βOct)和四面体间隙占位氘(βTet)的热解吸谱峰,计算获得了β相和六方结构γ相双相、βOct相和βTet相铒氘化物解吸氘的表观活化能。结果显示,相结构对铒氘化物的热稳定性具有显著影响,βTet相的热稳定性远高于βOct相,而βOct相的热稳定性略高于β+γ双相。提出了由某一升温速率下金属氢化物的实验氢热解吸谱出发,采用Redhead模型变换公式理论模拟任意升温速率下热稳定评价用氢热解吸谱的新方法。该方法无需大量实验就能快速给出升温速率影响金属氢化物热分解温度的量化结果,是一种经济高效的金属氢化物热稳定性评估方法,可在金属氢化物使用温度条件设计中推广应用。
参考文献:
[1] GABIS I, EVARD E, VOYT A, et al. Kinetics of decomposition of erbium hydride[J]. Journal of Alloys and Compounds, 2003, 356-357: 353-357.
[2] FERRIZZ R M. Erbium hydride decomposition kinetics[R]. USA: Sandia National Laboratories, 2006.
[3] FERRIZZ R M. Erbium hydride thermal desorption controlling kinetics[R]. USA: Sandia National Laboratories, 2007.
[4] LUNDIN C E. The erbium-hydrogen system[J]. Transactions of the Metallurgical Society of AIME, 1968, 242(5): 903-907.
[5] LUNDIN C E. Thermodynamics of the erbium-deuterium system[J]. Transactions of the Metallurgical Society of AIME, 1968, 242(6): 1 161-1 165.
[6] PEBLER A, WALLACE W E. Crystal structures of some lanthanide hydrides[J]. J Phys Chem, 1962, 66(1): 148-151.
[7] TEWELL C R, KING S H. Observation of metastable erbium trihydride[J]. Applied Surface Science, 2006, 253(5): 2 597-2 602.
[8] MARK A R, CLARK S S, RYAN R W, et al. In-situ time-of-flight neutron diffraction of ErD2(β phase) formation during D2loading[R]. USA: Sandia National Laboratories, 2008.
[9] TEWELL C R, KING S H. Observations of metastable erbium trihydride[R]. USA: Sandia National Laboratories, 2006.
[10] HIROHATA Y, YAMADA T, YAMAUCHI Y, et al. Deuterium and helium retentions of V-4Cr-4Ti alloy used as first wall of breeding blanket in a fusion reactor[J]. Journal of Nuclear Materials, 2006, 348(1-2): 33-39.
