DGAT和PDAT基因在油菜籽油分积累中的作用
2014-08-07,,,,
, ,,,
(湖南农业大学油料作物研究所/国家油料改良中心湖南分中心,长沙 410128)
油菜是世界上第三大油料作物,中国第一大油料作物。中国的油菜种植面积和总产均位居世界第一,年种植面积近1.1亿亩,总产达1 200多万吨。油菜“双低化”以来,随着育种技术的发展,优质油菜品种不断涌现,菜油品质也相应提高,其中较好的菜油饱和脂肪酸含量7%左右,在所有植物油中含量最低,因而被称为“东方橄榄油”。
我国食用植物油的自给率很低,不到40%,长期依赖大量进口[1]。在耕地减少、扩大种植面积困难的情况下,2012年农业部把提高油菜籽含油量列为油菜育种的主要目标加以研究,以图缓解我国食用植物油供求矛盾。油菜籽含油量对于保障菜油供应具有十分重要的意义,含油量提高1%,相当于增产2.3%~2.5%[2]。但提高含油量育种一度被忽视,在过去的20年中油菜籽平均含油量仅提高了2~3个百分点[3,4]。长江流域是我国油菜主产区,油菜籽含油量为41%~42%,比加拿大低4~6个百分点[5],成为制约我国油菜产业发展的主要因素之一。
油菜籽油分的形成积累是一系列基因调控的结果。二酰甘油酰基转移酶(DGAT)和新发现的磷脂:二酰甘油酰基转移酶(PDAT)的编码基因是催化甘油二酯合成甘油三酯的2个关键酶,通过从不同含油量品种中克隆这些基因的全部拷贝,研究各个拷贝在种子不同发育时期的表达和活性,揭示油菜含油量不同的品种中DGAT和PDAT基因的遗传多样性,研究其表达量、酶活性与含油量的关系,可为选育高含油量油菜品种提供理论依据和基因资源。
1 三酰甘油合成途径
常见的三酰甘油(TAG)合成在内质网进行。在该合成途径中,甘油-3-磷酸酰基转移酶(GPAT)、溶血磷脂酸酰基转移酶(LPAT)、二酰甘油酰基转移酶(DGAT)3个酰基转移酶依次将酰基CoA的脂肪酸转移到甘油,被称为依赖酰基CoA的Kennedy途径[7]。
近年来发现了另一合成途径,区别在于利用磷脂作为酰基供体,二酰甘油(DAG)作为受体,磷脂:二酰甘油酰基转移酶(PDAT)将磷脂酰胆碱(phosphatidylcholine,PC)sn-2位的酰基转移到DAG上,形成TAG和溶血磷脂酰胆碱[8](图1) 。
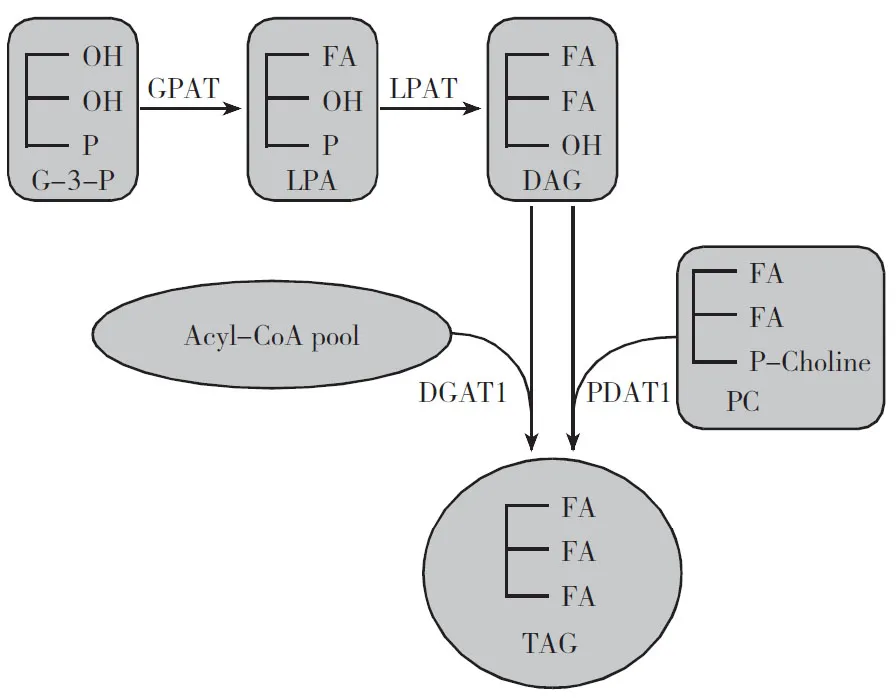
2 合成途径对三酰甘油脂肪酸组成的影响
甘油骨架上3个脂肪酸的种类和特性决定三酰甘油的性质。油中TAGs脂肪酸的立体化学分析显示,饱和脂肪酸通常位于甘油分子的sn-l和sn-3位置,不饱和脂肪酸则大多发生在sn-2位置。调控DGAT1和PDAT1途径能影响sn-3位置的脂肪酸组成。通过DGAT1途径形成的三酰甘油酰基供体为酰基辅酶A。由于新合成的酰基辅酶A中不存在多不饱和脂肪酸,因此,通过酰基辅酶A为供体合成三酰甘油的途径形成的三酰甘油,sn-3位置的多不饱和脂肪酸含量低。而PDAT1以磷脂为酰基供体合成的三酰甘油,磷脂(如磷脂酰胆碱)是脂肪酸脱氢酶(如FAD2和FAD3)的作用底物,在磷脂上的酰基其不饱和性更高,因此,通过该代谢途径形成三酰甘油的多不饱和性更高。在拟南芥dgat1-1突变体种子中,亚麻酸含量由野生型的18%提高到约40%。其中,亚麻酸在sn-3位置上的相对含量也由野生型的12%提高到39%[9]。在dgatl-2突变体中,亚麻酸含量也大幅度提高[10]。
3 DGAT和PDAT基因的功能研究进展
DGAT有DGAT1、DGAT2、WS/DGAT和可溶性的DGAT四类。DGAT1编码一种定位在内质网膜上的蛋白,在不同物种中该基因的生化特性存在差异。DGAT是Kennedy途径中的限速酶。在高油及低油大豆品种中研究发现,DGAT1基因表达的活性与大豆含油量、油脂积累速率呈正比[11]。DGAT1基因首先是Hobbs从拟南芥中克隆得到的,随之,在大豆[12]、向日葵等油料作物中也成功克隆到了DGAT1基因。DGAT1和DGAT2在不同植物及同一植物的不同发育阶段起不同的作用,甚至于产生不同脂肪酸组分的TAG[13]。Kroon JT等研究发现,在油桐树的种子中,DGAT2的表达水平及在油脂合成中的作用均高于DGAT1,且对桐油酸有强烈的底物选择性[14]。Shockey JM等在蓖麻种子中也发现,DGAT2表达水平更高、在油脂合成中作用更大[15]。
DGAT基因过量表达可明显提高植物的含油量及种子的大小[16,17]。在野生型拟南芥种子中过量表达DGAT基因可以提高种子的含油量和重量[18]。在玉米[19]、拟南芥和油菜[20]和野生型拟南芥、高芥酸油菜和低芥酸油菜中[21]都能显著提高种子的含油量。超量表达DGAT基因能够提高作物种子的含油量,DGAT基因是否与油菜含油量有关或者说哪个基因有关等问题很值得研究。PDAT1合成途径直到2009年才在拟南芥中被阐明[19]。拟南芥DGAT1-1基因突变体,尽管缺乏DGAT1功能,含油量只比野生型降低30%,表明在DGAT1基因缺失的情况下,PDAT1是正常种子发育必不可少的,是拟南芥TAG生物合成的一个主要决定因素。但在dgat1背景下干扰PDAT1表达,或在相反情况下,拟南芥种子含油量均减少70%~80%,且胚发育受阻。pdat1/dgat1双突变纯合体,出现雄性不育现象[22]。进一步研究表明,DGAT1-1基因突变体主要是LPCAT2上调增大了DAG池库容,保持了PC的供应,造成PDAT1催化的TAG合成增加[23]。拟南芥DGAT1或PDAT1过表达的种子TAG含量与野生型相比无明显变化[24,25]。以上研究均表明二者可能在功能上交叠。
4 油菜DGAT和PDAT基因研究进展
油菜三酰甘油的两条合成代谢途径的研究较为缓慢。Nykiforuk等(2002)最早在油菜悬浮细胞中克隆获得两条DGAT的cDNA序列,其中BnDGAT1在悬浮细胞中表达水平的升高能够提高TAG的合成量,BnDGAT2缺失了BnDGAT1中所含有的N端亲水结构域,可能为悬浮系所特有[26]。Weselake等发现BnDGAT1通过N端结构域接受酰基-CoA的调控[27]。Lock等沉默油菜中的DGAT1基因,导致种子的含油量降低,脂肪酸组成改变,以及一系列种子发育异常,说明DGAT1在油菜的油脂合成代谢中扮演重要角色[28]。Siloto等[29]通过对油菜BnDGATl基因易错PCR进行突变,得到了BnDGATl基因的突变库,将突变体库转入酵母中,发现一些活性提高的DGAT突变体。但不同油菜品种中DGAT基因的拷贝数、遗传多态性、表达量等与含油量的关系尚不清楚。在油菜中是否存在PDAT1合成途径、有多少个PDAT1基因、遗传变异如何等等问题尚未研究,DGAT1和PDAT1两条途径对TAG合成积累的贡献大小、相互关系则更是未知。
植物油脂代谢是一个由多基因参与的复杂的生物学过程。拟南芥基因组中600多个基因形成了油脂代谢网络[6]。我国主要种植的甘蓝型油菜是异源四倍体,油菜籽油分形成积累可能更为复杂。在这个复杂的网络中,选择由甘油二酯最终合成甘油三酯步骤的2个酶即二酰甘油酰基转移酶基因(DGAT)和磷脂:二酰甘油酰基转移酶基因(PDAT)的编码基因进行克隆、表达分析和活性测定,探讨这2个基因在油菜中的遗传多态性、表达与含油量的关系,可以为选育高含油量油菜品种提供理论依据和基因资源。
[1] 王汉中.发展油菜生物柴油的潜力、问题与对策[J].中国油料作物学报,2005,27:74-76.
[2] 王汉中.中国油菜品种改良的中长期发展战略[J].中国油料作物学报,2004,26: 98-101.
[3] 俞琦英,刘凤兰,张冬青.2000~2009 年中国冬油菜区试品种品质及产量性状的演变[J].中国农学通报,2010,26:119-123.
[4] 徐一兰,官春云,谭太龙.油菜种子油分形成的生理生化基础研究进展[J].中国农学通报,2006,22(4):225-229.
[5] 王汉中.我国油菜产业发展的历史回顾与展望[J].中国油料作物学报,2010,32: 300-302.
[6] Li-Beisson Y, Shorrosh B, Beisson F,et al. Acyl-Lipid Metabolism. In: The Arabidopsis Book, Rockville, MD: American Society of Plant Biologists[EB/OL]. http://www.bioone.org/doi/full/10.1199/tab.0161.
[7] Chapmann KD,Ohlrogge JB.Compartmentation of triacylglycerol accumulation in plants[J]. J Biol Chem, 2012, 287:2288-2294.
[8] Dahlqvist A, Stahl U, Lenman M, et al. Phospholipid:diacylglycerol acyltransferase: an enzyme that catalyzes the acyl-CoA-independent formation of triacylglycerol in yeast and plants[J]. Proc Natl Acad Sci USA, 2000, 97: 6487-6492.
[9] Katavic V, Reed DW, Taylor DC, et al. Alteration of seed fatty acid composition by an ethyl methanesulfonate-induced mutation inArabidopsisthalianaaffecting diacyl-glycerol acyltransferase activity[J]. Plant Physiol, 1995, 108:399-409.
[10]Routaboul JM, Benning C, Bechtold N, et al. The TAGl locus ofArabidopsisencodes for a diacylglycerol acyltransferase[J]. Plant Physiol Biochem, 1999, 37:831-840.
[11]Lung SC, Weselake RJ. Diacylglycerol acyltransferase: a key mediator of plant triacylglycerol synthesis[J]. Lipids, 2006, 41:1073-1088.
[12]Wang HW, Zhang JS, Gai JY, et al. Cloning and comparative analysis of the gene encoding diacylglycerol acyltransferase from wild type and cultivated soybean[J]. Theor Appl Genet, 2006, 112:1086-1097.
[13]Oakes J,Brackenridge D,Colletti R,et al.Expression of fungal diacylglycerol acyltransferase 2 genes to increase kernel oil in maize[J].Plant Physiology,2011,155: 1146-1157.
[14]Kroon JT,Wei W,Simon WJ,et al.Identification and functional expression of a type 2 acyl-CoA: diacylglycerol acyltransferase(DGAT2) in developing castor bean seeds which has high homology to the major triglyceride biosynthetic enzyme of fungi and animals[J].Phytochemistry,2006,212: 38-59.
[15]Shockey JM,Gidda SK,Chapital DC,et al.Tung tree DGAT1 and DGAT2 have nonredundant functions in triacylglycerol biosynthesis and are localized to different subdomains of the endoplasmic reticulum[J].Plant Cell,2006,18: 2294-2313.
[16]Burgal J, Shockey J, Lu C,et al. Metabolic engineering of hydroxy fatty acidproduction in plants:RcDGAT2 drives dramatic increases in ricinoleate levels in seed oil[J]. Plant Biotechnol J, 2008, 6:819-831.
[17]Weselake RJ, Shah S, Tang M, et al. Metabolic control analysis is helpful for informed genetic manipulation of oilseed rape (Brassicanapus) to increase seed oil content[J]. J Exp Bot, 2008, 59:3543-3549.
[18]Jako C, Kumar A, Wei Y, et al. Seed-specific over-expression of anArabidopsiscDNA encoding a diacylglycerol acyltransferase enhances seed oil content and seed weight[J]. Plant Physio1, 2001,126:861-874.
[19]Zheng P, Allen WB, Roesler K, et al. Phenylalanine in DGAT is a key determinant of oil content and composition in maize[J]. Nat Genet, 2008, 40:367-372.
[20]Zou J, Katavic V, Giblin EM, et al. Modification of seed oilcontent and acyl composition in theBrassicaceaeby expression of a yeast sn-2 acyltransferase gene[J]. Plant Cell, 1997, 9:909-923.
[21]Xu J, Francis T, Mietkiewska E, et al. Cloning and characterization of an acyl-CoA-dependent diacylglycerol acyltransferase 1(DGAT1)gene fromTropaeolummajus, and a study of functional motifs of the DGAT protein using site-directed mutagenesis to modify enzyme activity and oil content[J]. Plant Biotechnol J, 2008, 6:799-818.
[22]Zhang M, Fan J,Taylor DC, et al. DAGT1 and PDAT1 acyltransferases have overlapping functions inArabidopsistriacylglycerol biosynthesis and are essential for normal pollen and seed development[J]. Plant Cell, 2009, 21: 3885-3901.
[23]Xu J, Carlsson AS, Francis T, et al. Triacylglycerol synthesis by PDAT1 in the absence of DGAT1 activity is dependent on re-acylation of LPC by LPCAT2[J]. BMC Plant Biol, 2012, 12:4.
[24]Stahl U, Carlsson AS, Lenman M, Det al. Cloning and functional characterization of a phospholipid: diacylglycerol acyltransferase fromArabidopsis[J].Plant Physiol,2004, 135:1324-1335.
[25]Mhaske V,Beldjilali K,Ohlrogge J,et al. Isolation and characterization of anArabidopsisthalianaknockout line for phospholipid: diacylglycerol transacylase gene(At5g13640) [J]. Plant Physiol Biochem, 2005, 43:413-417.
[26]Nykiforuk CL, Furukawa-stoffer TL, Huff PW, et al. Characterization of cDNAs encoding diacylglycerol acyltransferase from cultures ofBrassicanapusand sucrose-mediated induction of enzyme biosynthesis[J]. Biochim Biophys Acta, 2002, 1580(2-3):95-109.
[27]Weselake RJ, Madhavji M, Szarka SJ, et al. Acyl-CoA-binding and self-associating properties of a recombinant 13.3 kDa N-terminal fragment of diacylglycerol acyltransferase-1 from oilseed rape[J]. BMC Biochemistry,2006, 7:24.
[28]Lock YY, Snyder CL, Zhu W, et al. Antisense suppression of type 1 diacylglycerol acyltransferase adversely affects plant development inBrassicanapus[J]. Physiol Plant,2009, 137:61-71.
[29]Siloto RM, Truksa M, Brownfield D, et al. Directed evolution of acyl-CoA:diacylglycerol acyltransferase: development and characterization ofBrassicanapusDGAT1 mutagenized libraries[J]. Plant Physiol Biochem, 2009, 47:456-61.
