聚丙烯酰胺凝胶电泳检测大豆SRAP标记
2014-08-07李晓静周延清
王 芳,李晓静,周延清
(1.中州大学 a.实验管理中心 b.化工食品学院,郑州450044;2.河南师范大学 生命科学学院,河南 新乡453007)
随着生物工程及基因工程技术的发展,基于PCR(聚合酶链式反应)的分子标记技术也得到了迅速发展。目前在大豆种质资源研究方面应用的PCR分子标记主要有RAPD、ISSR、AFLP、RFLP等。这些标记虽然各有特点,但是效果[1]均不理想。2001年由美国加州大学蔬菜作物系Li和Quiros[2]博士提出相关序列扩增多态性(Sequence-Related Amplified Polymorphism,SRAP)分子标记,该标记是一种新型的分子标记技术,因其具有简便、中等产量、高共显性、重复性、易于分离条带及测序等优点,目前在很多植物中都得到了广泛的应用[3-4],但在大豆研究[5]中未见报道。
聚丙烯酰胺凝胶电泳(PAGE)技术是一种检测灵敏度和分辨率都很高的电泳技术,从聚丙烯酰胺凝胶中得到的DNA 纯度很高,特别适合于像SRAP这样的小DNA 片段的分析(5~500bp),是分子生物学、生物工程及基因工程研究方面不可缺少的实验技术。因其具有设备相对简单,操作比较方便,时间短,样品量少等特点[6],近年来被广泛应用于DNA的分析实验中。本文以大豆为实验材料,进行了大豆的SRAP-PCR扩增,并对产物进行聚丙烯酰胺凝胶电泳和银染,建立了一种简便快捷的适合于大豆SRAP标记的PAGE银染检测方法。
1 材料与方法
1.1 试验材料
实验材料为豆科大豆属的133种大豆,品种由河南农业科学院梁凤珍、王树峰和周口农业科学院苑宝军研究员提供(见表1)。SRAP引物由上海生物工程技术服务有限公司合成(见表2)。
1.2 DNA提取及检测
将大豆下胚轴研磨成粉末,每个品种取3 g大豆粉末用CTAB法[7]提取总DNA。用紫外分光光度计测定所提DNA的浓度,并稀释为10 ng/μL的工作液,保存在4 ℃冰箱中备用。
1.3 SRAP-PCR反应体系
参考Li和Quiros的SRAP扩增程序[2]稍加修改,反应体系总体积为25 μL,每管中还含有1×PCR buffer和灭菌水。进行优化实验,建立反应体系。PCR反应程序为:94 ℃预变性3 min,然后前5个循环为94 ℃变性l min,35 ℃ 退火l min,72 ℃延伸1 min,后35个循环仅将退火温度升为50 ℃,最后72 ℃延伸7 min[8]。
1.4 非变性聚丙烯酰胺凝胶电泳[9-10]
1.4.1 聚丙烯胺凝胶的配制
10 %过硫酸胺(APS):1 g过硫酸胺溶于10 mL双蒸水,4 ℃保存。6%丙烯酰胺凝胶母液:29 g丙烯酰胺,5.8 g甲叉双丙烯酰胺,加双蒸水至500 mL,溶解后过滤,4 ℃保存。10 TBE(pH8.0):108 gTris碱,55 g硼酸,40 mL 0.5 mol/L EDTA。

表1 用于SRAP分析的大豆品种名称

表2 用于大豆研究中SRAP引物
1.4.2 非变性聚丙烯酰胺凝胶电泳步骤
首先用洗涤剂将两块玻璃彻底清洗干净,晾干。用2 mL左右的95 %乙醇涂于玻璃板上,擦拭干净,可处理1~2次。装配好垂直电泳板,两块玻璃板的两侧及底部用1%的琼脂糖封边。将装好的玻璃电泳板倾斜45~60°。其次,在70 mL丙烯酰胺凝胶母液中加入400 μL APS和40 μL TEMED,配制成凝胶液混匀,缓慢将凝胶液注入两玻璃板空隙中,直至灌满至模具的顶部。将梳子小心地插入,以免梳齿下或梳齿旁产生气泡,梳顶部应该比短玻璃板顶部稍高些。室温聚合1 h后,将玻璃板插入电泳槽中,固定,倒入0.1×TBE缓冲液。小心取出梳子,加样,上样量为6 μL PCR产物。最后,撕取胶带小心拔出梳子。在下槽加入400 mL左右1倍TBE后,将凝胶模具装上电泳装置。上槽加入500 mL 1倍TBE。上样过程尽可能迅速,争取在30 min内完成。上样完毕继续在140 V恒压下电泳约4 h,当二甲苯青距底部约1/3处终止电泳[5]。
1.5 染色
1.5.1 染液的配制
固定液:加100 mL无水乙醇和5 mL冰醋酸至1790 mL双蒸水中。染色液:加入100 mL无水乙醇和5 mL冰醋酸至1790 mL双蒸水中,再加入2 g AgNO3。显色液:将30 g NaOH溶于1L双蒸水中,在4~10 ℃下冷却。在使用前几分钟,加入3 mL甲醛。停显液:加200 mL的冰醋酸至1800 mL的双蒸水中[5]。
1.5.2 染色的操作步骤
固定和染色:将凝胶放入准备好的装有固定液的塑料盒中,静置10 min以上。将显色液放于冰浴中进行冷却,染色将要结束时,在清洗塑料盒中加入双蒸水。将6 mL 37%甲醛加入冷却好的显色液中,混匀,将2 L配好的显色液倒入显影塑料盒中。
漂洗和显色:将凝胶从染色液中取出,在清洗盒中迅速漂洗一遍,时间严格控制在5~10s。将凝胶放入显色液中,轻轻摇动至第一条带出现,倒掉已上色的显色液,更换另一半显色液,继续轻轻摇动。一般上部显色,应对带弱的部分尤其是下部着重进行显色,至直条带清晰可见。轻轻摇动2 min后,再将玻璃板用双蒸水漂洗3 min。
停显和晾干:将凝胶从显色液中取出,在清洗盒中迅速漂洗一遍,放入10 %的停显液中,然后拍照或扫描保存[5]。
2 结果
2.1 引物筛选结果
对大豆品种进行引物筛选(见图1),结果从288对随机引物组合中筛选出条带较多、信号强、背景清晰的12对引物组合(见表3)用于进一步分析研究。

图1 SRAP部分引物的筛选(编号为引物序号)
2.2 大豆的SRAP-PCR扩增
用筛选出来的引物组合me16em17和me12em5对大豆SRAP的产物进行了扩增,扩增产物进行聚丙烯酰胺凝胶电泳技术检测,并用银染法进行染色(见图2、图3)。实验结果表明,对于大豆SRAP分子标记来说,采用聚丙烯凝胶电泳及银染法染色,取得了比较理想的电泳条带及染色效果。由此可见,此种方法检测大豆SRAP标记,具有检测灵敏度高、凝胶背景浅、操作简便、条带清晰等特点,是适合大豆SRAP研究的检测方法。

表3 用于SRAP研究的引物组合及扩增结果
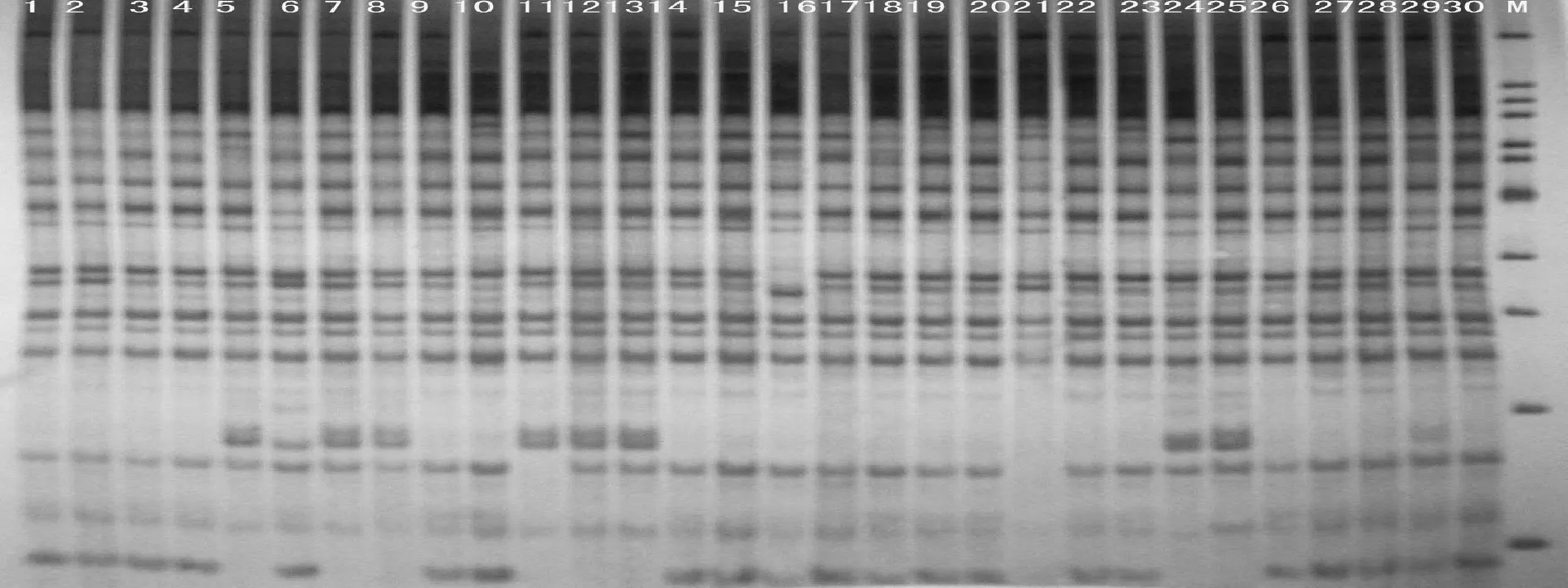
图2 引物me16em17 SRAP的PAGE扩增图谱

图3 引物me12em5 SRAP的PAGE扩增图谱
3 结论与讨论
SRAP分子标记因其具有操作简便、稳定、产率高、便于克隆目标片段的优点,已经被广泛应用于水稻、莴苣、马铃薯、白菜、大蒜、油菜、苹果、生菜、樱桃、柑橘、芹菜等作物的种质资源的鉴定评价、遗传图谱的构建、重要性状基因标记、基因组DNA与cDNA指纹分析、比较基因组学遗传多样性分析和图位克隆等[11]方面。聚丙烯酰胺凝胶电泳分辨率很高,长度仅相差0.2 %的DNA分子片段即可分开,所能装载的DNA量远远超过了琼脂糖凝胶电泳。多达10 g的DNA可以加样聚丙烯酰胺凝胶的一个标准样品槽而不会显著影响其分辨力。从聚丙烯酰胺凝胶中回收的DNA纯度非常高,以至于可以用于要求最高的实验中。聚丙烯酰胺凝胶电泳的很多优点也多用于同工酶的酶谱分析[12]。但是对聚丙烯凝胶电泳结果影响的因素很多,不同的试验处理对结果有不同的影响,影响大的甚至不能进行试验结果的分析。因此,需要对聚丙烯酰胺凝胶电泳各个参数进行不断优化。例如聚丙烯酰胺凝胶的浓度、染色过程及电泳时间等[13]都是其中重要的参数。
在用聚丙烯酰胺检测SRAP-PCR产物时,前人多采用4%~10%之间的浓度进行检测。张素勤[14]在检测辣椒SRAP产物时应用10 %的凝胶浓度,许晓燕[15]等利用AFLP和SRAP标记分析毛木耳的遗传多样性时用8 %的聚丙烯凝胶,何凤发[16]用9 %的凝胶浓度对马铃薯进行了遗传资源多样性的分析,王华忠[10]用6 %的变性凝胶电泳检测。本文通过一系列实验建立了适合大豆SRAP聚丙烯酰胺凝胶电泳及染色方法,即聚丙烯酰胺凝胶的浓度为6%、电泳电压为140 V, SRAP标记产物多态性条带清晰、明亮、稳定,为大豆SRAP进一步的研究工作提供了理论依据和技术支持。
参考文献:
[1]李严,张春庆. 新型分子标记:SRAP技术体系优化及应用前景分析[J]. 中国农学通报,2005, 21(5): 108-112.
[2]Li G, Quiros C F. Sequence-related amplified polymorphism (SRAP), a new marker system based on a simple PCR reaction its application to mapping and gene tagging in Brassica [J]. Theor Appl Genet, 2001,103:455-461.
[3]Zhou Anqing,Gu Fengping,Zhou Chun,et al.Genetic diversity of Rehmannia glutinosa cultivars based on sequence-related amplified polymorphism markers[J]. Scientia Horticulturae, 2010,125:789-794.
[4]周延清,杨清香,张改娜.生物遗传标记与应用[M].北京:化学工业出版社,2008.
[5]王芳,徐翔,李领川,等.大豆种质资源SRAP分子标记中的引物筛选[J].生物技术通报, 2012(7):73-78.
[6]宋显军,张伟,曹萍,等.大豆SSR标记PAGE银染方法的改进[J].安徽农业科学,2006,34(16) :3922-3923.
[7]王关林,方宏筠.植物基因工程原理和技术[M].北京:科学出版社,1998.
[8]应正河,吴小平,谢宝贵,等.香菇SRAP反应体系的优化[J].食用菌学报,2006,13(4):10-15.
[9]肖理慧.芦笋和葎草性别连锁的AFLP分子标记[D].河南师范大学, 2008.
[10]王华忠,吴则东,王晓武,等.利用SRAP与SSR标记分析不同类型甜菜的遗传多样性[J].作物学报,2008,34(1):37-46.
[11]Li G, Gao M, Yang B, et al. Gene for gene alignment between the Brassica and Arobidopsis genomes by direct transcriptome mapping[J]. Theor Appl Genet, 2003, 107: 168-180.
[12]宫纪娟,金喜军,龚振平,等.春大豆荚果发育过程中酯酶同工酶酶谱分析[J].作物杂志,2010(4):39-42.
[13]吴娟,方慧玲,蔡兵.聚丙烯酰胺凝胶电泳检测水稻SSR标记[J].安庆师范学院学报:自然科学版,2010,16(3):91-93.
[14]张素勤,耿广东,周贤婷,等.辣椒种质资源的表型和SRAP分析[J].山地农业生物学报,2008,27(3):228-232.
[15]许晓燕,余梦瑶,罗霞,等.利用AFLP和SRAP标记分析19株毛木耳的遗传多样性[J].西南农业学报,2008,2l(1):121-124.
[16]何凤发,杨志平,张正圣,等.马铃薯遗传资源多样性的SRAP分析[J].农业生物技术学报,2007,15(6):1001-1005.
