MTT法检测金黄色萄萄球菌活菌数的研究
2014-08-06唐曦阳
袁 琳,宁 丹,唐曦阳,李 晶
(中南民族大学 药学院,武汉 430074)
常见的细菌计数方法有比浊法、平板菌落计数法、血球板计数法等.比浊法和血球计数法均能较快的反应细菌数,但不能判断细菌的活性,易受培养基成分和代谢产物性质等的影响[1-3].平板菌落计数法操作复杂、重复性差、耗时长,不适于大批量实验.
MTT 法简单、快速、灵敏、稳定[4],能准确的反应活细胞相对数目,目前已广泛用于一些生物活性因子的活性检测、抗肿瘤药物筛选、细胞毒性试验和肿瘤放射敏感性测定等[3, 5-7].MTT 比色法其检测原理为利用活细胞线粒体中的琥珀酸脱氢酶将外源性MTT还原为水不溶性的蓝紫色结晶甲瓒(Formazan),并沉积在细胞中,而死细胞无此功能,二甲基亚砜(DMSO)能溶解细胞中的甲瓒,以甲臜生成量与活细胞数量的关系来判断活细胞数量,OD 值越大,细胞活性越强[2,8,9].三羧酸循环中的琥珀酸脱氢酶在真核细胞中主要存在线粒体中,而在原核细胞中主要存在膜间,故MTT 法也可用来检测活细菌数量[10].
金黄色葡萄球菌(Staphyloccocusaureus)是重要的微生物研究材料,也是重要的食品污染指示菌.本实验以金黄色葡萄球菌为对象,探讨MTT 法应用于活细菌细胞数定量分析的可行性和检测条件.
1 材料与方法
1.1 材料和仪器
金黄色葡萄球菌(ACTT 25923),由本室保存.胰蛋白胨、酵母提取物、琼脂粉、红霉素、MTT 等(Ameresco,美国).MH肉汤(青岛高科园海博生物技术有限公司),氯化钠、二甲亚砜、无水乙醇为国产分析纯.
酶标仪(Multiskan ascent,Thermo Electron Corporation),台式恒温振荡器(THZ-B,江苏太仓市实验设备厂),洁净工作台(SW-CJ-2FD,苏净集团苏州安泰空气技术有限公司),电热恒温培养箱(DH3600B,天津市泰斯特仪器有限公司).
1.2 菌种的活化
将保存在固体培养基上的金黄色葡萄球菌株接种于MH液体培养基中,于37℃,180 r/min过夜培养进行初级活化.将活化好的初级菌种按2.5%的接种量进行二级活化,于37℃,180 r/min继续培养 6~8 h,使其达到对数生长期,用于后续实验.
1.3 吸光度范围的确定
将菌悬液用培养基倍比稀释,于595 nm下直接测定各孔的吸光度,或加入MTT 溶液于37℃作用3 h后以DMSO溶解,于570 nm 波长下测定各孔的吸光度.设6个复孔,重复3次,下同.
1.4 DMSO 用量的对吸光度值的影响
将制备好的菌悬液加入96孔培养板中,MTT溶液作用3h 后,分别加入1~3倍菌液体积的DMSO,于570 nm下检测不同用量DMSO 对吸光度值的影响.分别以培养基、菌悬液、菌悬液+ MTT、菌悬液+不同剂量的DMSO 为对照,于570 nm下测定各孔的吸光度.
1.5 MTT 作用浓度对吸光度值的影响
将制备好的菌悬液加入96 孔培养板中,分别加入浓度为0.05~1.0 mg/mL的MTT 溶液于 37 ℃下恒温培养3 h后加入DMSO 200 μL,于570 nm下测定各孔的吸光度.
1.6 MTT 作用时间对吸光度值的影响
将制备好的菌悬液加入96 孔培养板中,加入MTT 溶液于37 ℃恒温培养0.5~4 h后加入DMSO 200 μL,于570 nm 波长下测定各孔的吸光度.
1.7 MTT吸光度法与平板计数法的相关性
把培养好的金黄色葡萄球菌悬液进行倍比稀释为11个浓度梯度.以0.1 mL/孔均匀涂布接种于96 孔板中,以上述MTT法最适反应条件测各孔吸光度值.同时以0.1 mL/皿均匀涂布于MH固体培养基平板,37 ℃培养24 h,计数各皿菌落数,建立菌液吸光度值与活菌数目的关系曲线.
1.8 统计学处理
2 结果
2.1 吸光度范围的确定
将培养好的金黄色葡萄球菌悬液接种于96 孔板,进行倍比稀释后,测定OD595,结果见图1a.将与其平行的另一块板加入MTT作用3 h后测定OD值(λ=570 nm,下同),结果见图1b. 由图1可知,金黄色葡萄球菌悬液吸光度值随着稀释倍数的增加而逐渐下降.以浊度初步估计细菌的数量是可行的,但由于浊度值之间的差异很少,很容易受到其它因素的影响而干扰其结果准确性(图1a).用MTT 法检测细菌数量或活力时,当OD570在0.3~1.7时,随着稀释倍数的增加而呈线性下降趋势(图1b),在此范围内OD570值与细菌数量呈正比. 为确保各次实验结果的稳定性,实验中所用菌液均调整浊度至OD595值在0.27±0.03范围内.
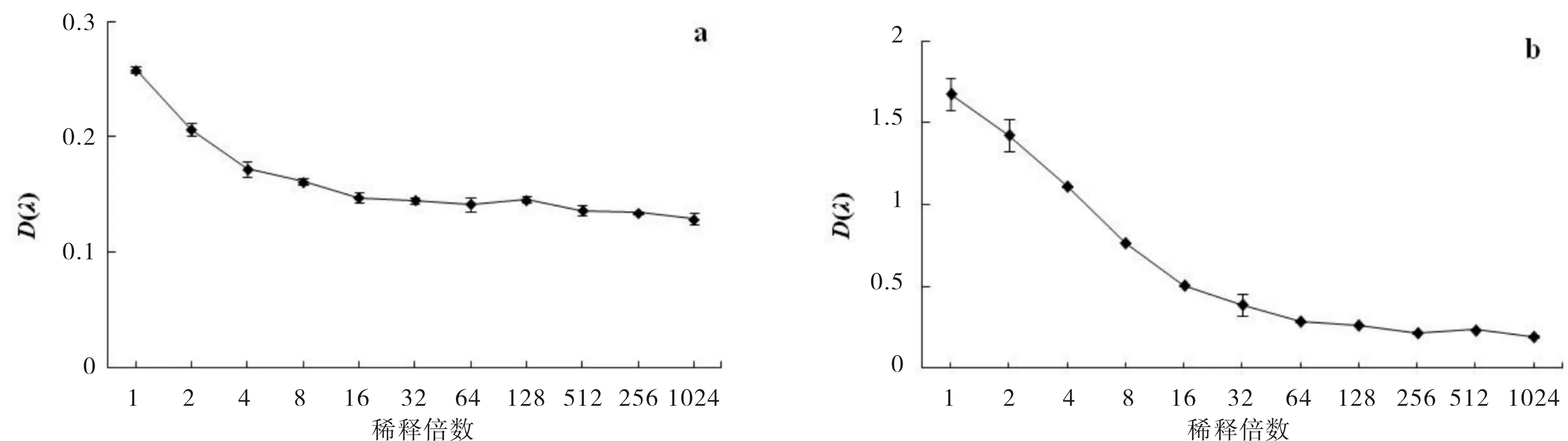
图1 不同稀释倍数对吸光度值的影响Fig.1 The effect of different dilution ratio on the absorbance value
2.2 DMSO用量对吸光度值的影响
将菌悬液接种于96 孔板中并加入MTT 作用3 h后,加入不同量的DMSO 溶解,测得的吸光度值呈现出一定的变化趋势,结果见图2.如图2所示,随DMSO用量的增加,吸光度值呈上升趋势,当DMSO用量达菌液体积的2~2.5倍时基本达到峰值.考虑到96孔板每孔的容积,故本实验条件下确定DMSO 的最佳剂量为200 μL,即菌液体积的2倍.在此范围内,培养基、菌悬液、菌悬液+MTT、菌悬液+不同剂量的DMSO 所测吸光度值均约为0.2,对MTT法实验基本无影响.故后续实验均以菌悬液+ DMSO为对照.

V/μL图2 不同体积的DMSO 对吸光度值的影响Fig.2 The effect of volumn of DMSO to the absorbance value
2.3 MTT 作用时间对吸光度值的影响
将菌悬液接种于96孔板中,加入MTT 溶液作用0.5~4 h后加入2倍体积的DMSO,于570 nm下测其吸光度.测得的吸光度呈现出一定的变化趋势,结果如图3所示.当作用时间达2 h时吸光度值可达到峰值,故MTT最适作用时间为2 h.
t/h图3 MTT 作用时间对吸光度的影响Fig.3 The effect of MTT reaction time to the absorbance value
2.4 MTT 浓度对吸光度值的影响
将菌悬液接种于96 孔培养板中,加入不同浓度的MTT 溶液,作用2 h 后加入2倍体积的DMSO,其吸光度值呈现典型的“钟型”变化趋势,结果见图4.由图4可见,当MTT作用浓度为0.15~0.25 mg/mL时吸光度值达到峰值.为保证MTT的量足够与菌液中琥珀酸脱氢酶反应,且在MTT 量充足的情况
下尽量降低MTT 毒性,在本实验条件中MTT的最适终浓度为0.25 mg/mL.

ρ/(mg·mL-1)图4 MTT浓度量对吸光度值的影响Fig.4 Effects of the MTT concentration to the absorbance value
2.5 MTT吸光度法与平板菌落计数法的相关性
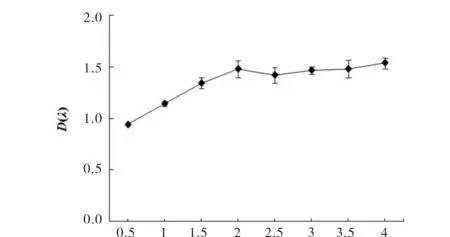
将MTT法所测的吸光度值与相对应的活菌数目之间建立线性关系曲线,结果如图5所示,活菌数目(菌落数)在一定范围内与菌悬液的MTT吸光度值成线性相关,R2=0.9966,y=1008.9x-22.327.

D(λ) 图5 吸光度值与平板菌落数目的关系Fig.5 The relationship between the absorbance value and the tablet colony numbers
3 讨论
MTT能被活细胞线粒体中脱氢酶还原成蓝细胞活性状态色Formazan 颗粒,颗粒形成量与活细胞数量成正比.细菌个体很小,通常在培养基中呈混悬状生长,低速离心很难将其从培养基中完全分离.而Formazan颗粒需要有机溶剂溶解,这可能是MTT法在细菌中很少使用的原因之一.
本文首先探讨了在不去除上清的情况下,DMSO 对金黄色葡萄球菌细菌中Formazan颗粒的溶解情况,当DMSO用量低于2倍菌液体积时,Formazan颗粒不能完全溶解,吸光度值随DMSO用量的增加而升高;而当DMSO用量高于2.5倍菌液体积时,吸光度值则不再升高,说明Formazan颗粒
已完全溶解.因此,2~2.5倍菌液体积的DMSO为最适的溶解Formazan颗粒的实验条件.当MTT作用时间达到并超过2 h后,其吸光度值即可达到峰值,这与细胞需要作用3~4 h不同,可能与两者脱氢酶存在的部位不同及代谢活性有关.
MTT对活的细菌具有毒性,当MTT的终浓度小于0.15 mg/mL时,随着MTT用量的增加吸光度值不断增大;在0.15~0.25 mg/mL时,吸光度值维持在较高水平;但MTT浓度继续增大则吸光度值呈持续下降,说明高浓度的MTT导致细菌活力下降甚至死亡.这可能是因为大量形成的Formazan颗粒结晶对细菌形成机械损伤甚至破裂死亡.以有足量甚至过量的MTT与菌液中琥珀酸脱氢酶反应,本实验确定最适MTT浓度为0.25 mg/mL.
当细菌数在105~107个/mL时,MTT法所测的吸光度值与平板法所测的细菌活菌数量呈线性相关,R2>0.99,说明MTT法在一定范围内可准确反映活菌数量.
参 考 文 献
[1] 王 栩, 邬于川, 夏世平, 等. MTT法进行活菌计数的方法学探讨[J]. 泸州医学院学报, 2002, 25(4): 291-292.
[2] 汪志荣, 高 琼, 马传鑫, 等. MTT法测定大肠杆菌活菌数实验研究[J]. 环境科学学报, 2011, 31(12): 2642-2650.
[3] 吴窈画, 谈书华, 范超超, 等. MTT法检测细菌细胞数的主要影响因素分析[J]. 微生物学杂志, 2011, 31(3): 67-72.
[4] Sladowski D, Steer S J, Clothier R H, et al. An improved MTT assay[J]. J Immunol Methods, 1993, 157(1/2): 203-207.
[5] 向 丽, 朱 江, 曾 静. 细菌药敏试验MTT法与常量稀释法比较性研究[J]. 泸州医学院学报, 2006, 29(1): 45-46.
[6] 杨翠云, 刘永定. MTT方法评价微生物细胞活性的探讨[J]. 水生生物学报, 2009, 33(4): 577-580.
[7] Nuryastuti T, van der Mei H C, Busscher H J, et al. Eeffect of Cinnamon oil on icaA expression and biofilm formation by staphylococcus epidermidis[J]. Appl Environ Microbiol, 2009, 75(21): 6850-6855.
[8] 陈胜杰, 陈 欢, 胡凌俊, 等. MTT法在木醋杆菌活力检测中的应用[J]. 安徽农业科学, 2012, 40(16): 8828-8829.
[9] Mosmann T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays[J]. J Immunol Methods, 1983, 65(1/2): 55-63.
[10] 高 伟, 唐益雄. 一种快速检测细菌、真菌生长及繁殖的方法[J]. 解剖学报, 2002, 33(6): 656-658.
