高锰酸钾及植物激素对君迁子种子萌发的影响1)
2014-08-02周道顺畅凌冰梁玉琴张嘉嘉
孙 鹏 周道顺 梁 臣 畅凌冰 李 畅 梁玉琴 张嘉嘉
(中国林业科学研究院经济林研究开发中心,郑州,450003) (洛阳农林科学院) (中南林业科技大学林学院) (中国林业科学研究院经济林研究开发中心)
高锰酸钾及植物激素对君迁子种子萌发的影响1)
孙 鹏 周道顺 梁 臣 畅凌冰 李 畅 梁玉琴 张嘉嘉
(中国林业科学研究院经济林研究开发中心,郑州,450003) (洛阳农林科学院) (中南林业科技大学林学院) (中国林业科学研究院经济林研究开发中心)
为了研究高锰酸钾、赤霉素(GA3)、细胞分裂素(6-BA)和生长素(2,4-D)对君迁子(DiospyroslotusL.)种子萌发及实生苗生长的调控作用,利用正交试验设计原则,用不同质量分数梯度高锰酸钾和植物激素对君迁子种子进行处理,然后定期观察其发芽情况及实生苗长势,以期找到最佳处理组合。极差分析结果表明:对于提高发芽率而言,最佳处理组合为高锰酸钾质量分数0.2%,处理时间4 h,然后用1 000 mg/L GA3处理15 h,再用40 mg/L的6-BA处理3 h,最后用100 mg/L的2,4-D处理30 min。方差分析结果表明:GA3质量浓度对种子的发芽率、实生苗苗高和实生苗叶片数量均有显著影响(P<0.05),说明GA3质量浓度是对种子萌发和实生苗生长影响最大的因素。发芽率与实生苗苗高和真叶数量分别呈极显著呈正相关(P<0.01),说明发芽率越高的种子其实生苗苗高越高,真叶数量越多。结果可以用于提高君迁子的实生繁殖效率,进而有利于柿的嫁接繁育工作的高效开展。
君迁子种子;高锰酸钾;植物激素;发芽率
君迁子(DiospyroslotusL.)属于柿树科(Ebenaceae)柿属(Diospyros)植物,又名黑枣、软枣,其果实药食兼用,具有很高的营养价值[1]。君迁子生长快,抗逆性强,十分适合被用作柿(Diospyroskaki)嫁接时的砧木[2]。君迁子的繁育方式主要是实生繁育,种子的萌发情况则直接决定了君迁子的实生繁育效果。目前,有关君迁子种子促萌方面的研究还未见报道,因此有必要对这方面展开研究。这一研究对于君迁子资源保存以及柿砧木培育具有重要的意义。
种子萌发过程中有以下一些问题需要特别关注。首先,种子在萌发过程中的霉变问题严重制约着实生繁殖的效率,因此播种前对种子进行消毒处理是十分必要的。种子消毒剂有多种,常见的有高锰酸钾、次氯酸盐、过氧化氢、溴水、氯化汞、酒精等。由于高锰酸钾具有药肥兼用、无毒、无刺激性、无残留的特点,且目前在花卉、蔬菜上作为杀菌剂普遍使用[3],所以本研究以高锰酸钾为消毒剂,研究了其对君迁子种子霉变的抑制作用。
除了霉变的影响,种子萌发还受到外部环境和内部生理物质影响,其中植物激素(特别是赤霉素、细胞分裂素、生长素)对打破种子休眠和促进种子萌发有重要的调控作用[4]。例如:Karssen and Lacka[5]提出的激素平衡假说认为:脱落酸(ABA)会诱导种子在成熟过程中进入休眠状态,而赤霉素(GA)则能够打破休眠并促进种子萌发。在种子发育的早期阶段,GA能够促进受精作用、胚胎发育、同化物吸收、果实生长等生理过程的顺利完成,并且还能够防止种子败育。GA的这些生理调控作用已在豌豆[6-7]、油菜[8]、拟南芥[9]中得到证实。另外,细胞分裂素对于种子的萌发也具有促进作用。在一些植物中发现仅细胞分裂素一种激素就足以打破种子休眠[10]。细胞分裂素在打破种子休眠之后可以通过诱导乙烯合成来促进种子萌发[11-13]。生长素在胚胎发育过程中也能够调控细胞的正常发育[14-15]。
从前人的研究中可以看出,消毒剂和植物激素处理对于种子萌发有重要的促进作用。本研究首次利用不同质量分数梯度的高锰酸钾、GA3(为赤霉素的一种)、6-BA(全名为6-苄氨基腺嘌呤,是细胞分裂素的一种)和2,4-D(全名为2,4-二氯苯氧基乙酸,是一种植物生长调节物质,其功能与生长素类似)对君迁子种子进行浸种处理,然后定期观察种子萌发及实生苗生长情况,从而找到促进君迁子种子萌发和实生苗生长的最佳处理方法。
1 材料与方法
1.1 材料
试验中所用的君迁子种子分别于2011年和2012年采自洛阳农林科学院。两个年份的种子分别单独进行萌发试验。
1.2 方法
选种:从两个不同年份的种子中分别选取饱满且有光泽的种子作为试验样品。根据取样时间和处理方式的不同将这些种子分为4组:第1组为先用高锰酸钾和激素处理后(此处的处理指表1中的正交处理,第2—第4组的处理同此),再用自来水浸泡3 d的2011年的种子;第2组为先处理,再用自来水浸泡3 d的2012年的种子;第3组为先用自来水浸泡3 d再处理的2011年的种子;第4组为先用自来水浸泡3 d,然后进行处理的2012年的种子。
浸种:以上每组种子都要经过高锰酸钾和激素浸种处理。处理时,以高锰酸钾质量分数、高猛酸钾处理时间、GA3质量浓度、6-BA质量浓度、2,4-D质量浓度为5个因素,每个因素参照前人文献设置合理的5个水平,按照L25(55)做正交试验(表1)。其中GA3的处理时间固定为15 h,6-BA的处理时间固定为3 h,2,4-D的处理时间固定为30 min。GA3、6-BA、2,4-D首先分别溶解在少量的95%酒精、1 mol/L氢氧化钠和乙酸中,然后再用蒸馏水配成所需质量浓度,试验所用激素均购自Sigma公司。

表1 种子促萌处理的因素水平
注:因素C处理时间固定15 h;因素D处理时间固定为3 h;因素E处理时间固定为30 min。
沙藏:将经过处理并用自来水浸泡过的种子与湿砂按照V(种子)∶V(砂)=1∶4混合均匀,砂子湿度以手握成团,松开后能散开为宜。将混合后的湿砂和种子置于避风向阳处,用湿布覆盖后,再覆盖塑料薄膜进行保温催芽。该过程共持续30 d,期间向湿布上补充必要水分,以防种子过于干燥。沙藏后每天统计种子发芽数量及霉变数量,然后计算发芽势、发芽率和霉变率。其中,发芽率=(正常发芽粒数量/供测种子数量)×100%[16]。参照孙永玉的标准,将发芽势定义为种子发芽达到高峰时正常发芽种子数量与供试种子数量的百分比。发芽势是衡量种子品质的重要指标,发芽率相同的种子,发芽势高的说明处理效果好[16]。本试验发芽势的计算时间确定为沙藏的最后9 d。霉变率=(霉变的种子数量/供测种子数量)×100%。出苗率=(出苗数量/供测种子数量)×100%。
播种:将催芽后的种子移至中国林业科学研究院经济林研究开发中心院内苗圃地进行育苗试验,播种前整地、作畦并灌溉,采用条播法以8 cm的种间距播种。于播种后30 d测定实生苗的苗高、基径和真叶数量。
数据分析:采用SPSS 17.0软件进行数据分析。利用极差分析和单因素方差分析分别评定各因素对所测定的各指标的影响程度,然后选出最佳的处理组合。利用t检验分别分析年份因素和浸水先后因素对种子萌发和实生苗生长的影响。
2 结果与分析
2.1 种子采后保存时间对种子发芽率的影响
利用独立样本t检验法对比2011年和2012年采集的种子的发芽率后发现,两者不存在显著差异(P>0.05),说明种子采后保存1年或2年其发芽率基本一致。
2.2 温水浸泡对种子发芽率的影响
利用独立样本t检验法对比温水浸泡与药剂处理的先后顺序这一因素对种子发芽率的影响,结果表明先用温水浸泡的种子的发芽率为(37.4±2.5)%,而后用温水浸泡的种子的发芽率为(18.1±2.7)%,两者存在极显著差异(P<0.01)。这说明在用消毒剂和植物激素处理前,先用温水浸泡更有利于种子萌发。原因可能是,用温水浸泡后种皮已经软化,这样高猛酸钾和激素更容易渗透到种子中,从而对种子萌发产生更大的促进作用。
2.3 各种处理组合对不同指标的影响
以2012年采集的,且先用温水浸泡然后再进行处理的种子为例,其发芽势、发芽率、霉变率、出苗率、基径、苗高、叶片数的测定数据见表2。

表2 种子处理后各指标的测定值
2.3.1 不同处理对君迁子种子发芽势影响
君迁子种子发芽势的极差分析结果表明,高猛酸钾质量分数(R=0.14)和高锰酸钾处理时间(R=0.14)这两个因素对发芽势的影响最大。以各因素每个水平的均值最大值为依据,可以得出最有利于君迁子种子发芽势提高的处理组合为不用高锰酸钾处理,用600或1 000 mg/L GA3处理15 h,再用40 mg/L的6-BA处理3 h,最后再用100 mg/L的2,4-D处理30 min(表3)。

表3 君迁子种子发芽势的极差分析
注:K值为某个因素在相同水平下测定值的和;x值为某个因素在相同水平下测定值的均值;R值为最大平均值与最小平均值的差。
2.3.2 不同处理对君迁子种子发芽率的影响
君迁子种子发芽率的极差分析结果表明,GA3质量浓度(R=0.23)对种子发芽率的影响最大。以各因素每个水平的均值最大值为依据,可以得出最有利于君迁子种子发芽率提高的处理组合为高锰酸钾质量分数0.2%,处理时间4 h,然后用1 000 mg/L GA3处理15 h,再用40 mg/L的6-BA处理3 h,最后再用100 mg/L的2,4-D处理30 min(表4)。

表4 君迁子种子发芽率的极差分析
注:K值为某个因素在相同水平下测定值的和;x值为某个因素在相同水平下测定值的均值;R值为最大平均值与最小平均值的差。
2.3.3 不同处理对君迁子种子霉变率的影响
君迁子种子霉变率的极差分析结果表明,高锰酸钾质量分数(R=0.02)和高锰酸钾处理时间(R=0.02)以及GA3质量浓度(R=0.02)这3个因素对霉变率的影响最大。以各因素每个水平的均值最小值为依据,可以得出最有利于防止君迁子种子霉变的处理组合为高锰酸钾质量分数1%,处理时间12 h,然后用10 mg/L GA3处理15 h。统计结果表明6-BA和2,4-D对霉变率的影响很小(表5)。
2.3.4 不同处理对君迁子种子出苗率的影响
君迁子种子出苗率的极差分析结果表明,GA3质量浓度(R=0.192)对出苗率的影响最大。以各因素每个水平的均值最大值为依据,可以得出最有利于君迁子种子出苗率提高的处理组合为高锰酸钾质量分数1%,处理时间4 h,然后用200 mg/L GA3处理15 h,再用40 mg/L的6-BA处理3 h,最后再用0.1 mg/L或1 mg/L的2,4-D处理30 min(表6)。

表5 君迁子种子霉变率的极差分析
注:K值为某个因素在相同水平下测定值的和;x值为某个因素在相同水平下测定值的均值;R值为最大平均值与最小平均值的差。

表6 君迁子种子出苗率的极差分析
注:K值为某个因素在相同水平下测定值的和;x值为某个因素在相同水平下测定值的均值;R值为最大平均值与最小平均值的差。
2.3.5 不同处理对君迁子实生苗基径的影响
君迁子实生苗基径的极差分析结果表明,高锰酸钾质量分数(R=0.36)对实生苗基径的影响最大。以各因素每个水平的均值最大值为依据,可以得出最有利于君迁子实生苗基径提高的处理组合为高锰酸钾质量分数0.05%,处理时间5 min,然后用10 mg/L GA3处理15 h,再用0.1 mg/L的6-BA处理3 h,最后再用10 mg/L的2,4-D处理30 min(表7)。
2.3.6 不同处理对君迁子实生苗苗高的影响
君迁子实生苗苗高的极差分析结果表明,GA3质量浓度(R=1.09)对实生苗苗高的影响最大。以各因素每个水平的均值最大值为依据,可以得出最有利于君迁子实生苗苗高提高的处理组合为不用高锰酸钾处理,用1 000 mg/L GA3处理15 h,再用800 mg/L的6-BA处理3 h,最后再用100 mg/L的2,4-D处理30 min(表8)。

表7 君迁子实生苗基径的极差分析
注:K值为某个因素在相同水平下测定值的和;x值为某个因素在相同水平下测定值的均值;R值为最大平均值与最小平均值的差。

表8 君迁子实生苗苗高的极差分析
注:K值为某个因素在相同水平下测定值的和;x值为某个因素在相同水平下测定值的均值;R值为最大平均值与最小平均值的差。
2.3.7 不同处理对君迁子种子苗真叶数量的影响
君迁子种子苗真叶数量的极差分析结果表明,GA3质量浓度(R=1.196)对实生苗苗高的影响最大。以各因素每个水平的均值最大值为依据,可以得出最有利于君迁子实生苗苗高提高的处理组合为不用高锰酸钾处理,用1 000 mg/L GA3处理15 h,再用800 mg/L的6-BA处理3 h,最后再用100 mg/L的2,4-D处理30 min(如表9)。
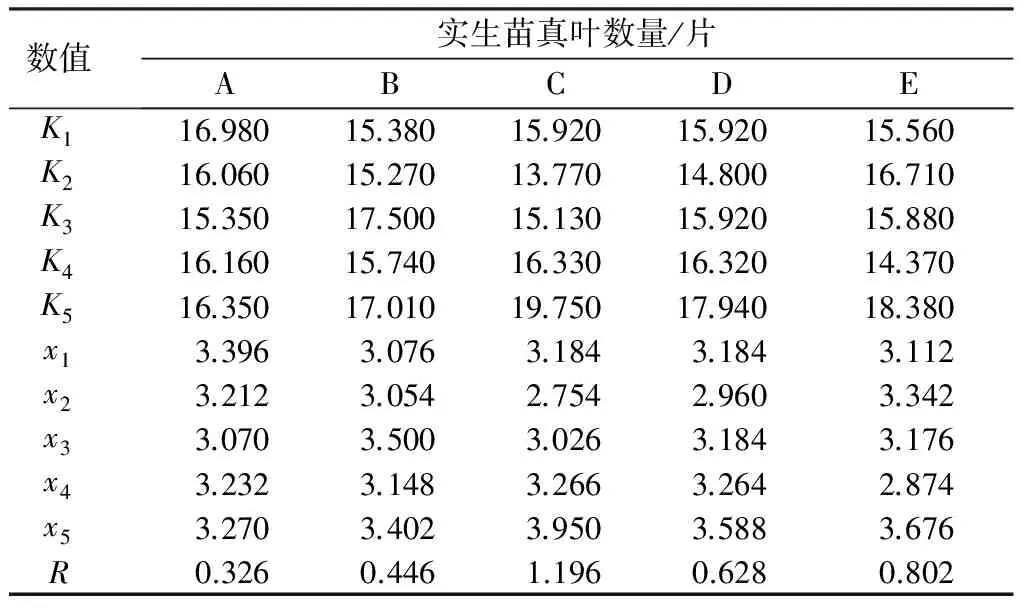
表9 君迁子实生苗真叶数量的极差分析
注:K值为某个因素在相同水平下测定值的和;x值为某个因素在相同水平下测定值的均值;R值为最大平均值与最小平均值的差。
方差分析结果(表10)表明,高锰酸钾质量分数对发芽势和实生苗基径有显著影响(P<0.05);GA3质量浓度对发芽率、实生苗苗高和真叶数量有显著影响(P<0.05)。
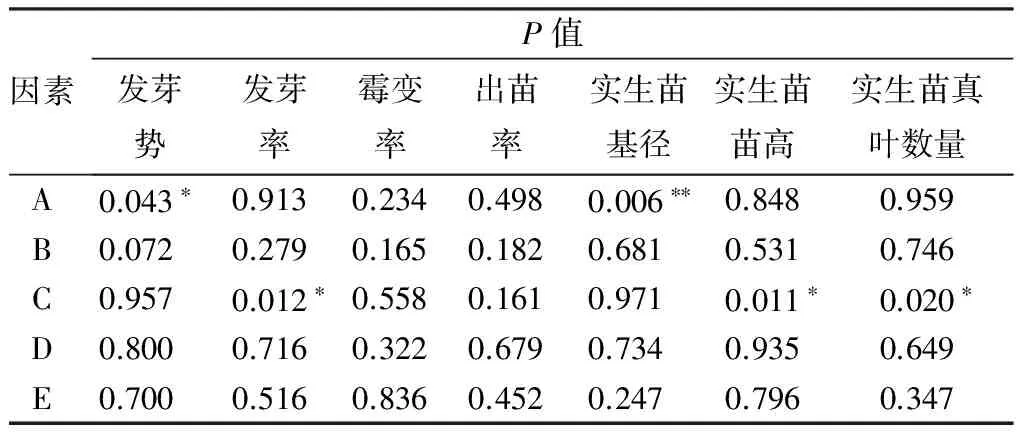
表10 各因素不同水平间方差分析P值
注:*表示差异显著(P<0.05);** 表示差异极显著(P<0.01)。
2.4 相关性分析
相关性分析结果表明(表11),发芽率与发芽势呈显著正相关(P<0.05),实生苗基径与发芽势呈极显著负相关(P<0.01),实生苗苗高与发芽率呈极显著正相关(P<0.01),实生苗真叶数量与发芽率呈极显著正相关(P<0.01),实生苗真叶数量与实生苗基径呈显著负相关(P<0.05),实生苗真叶数量与实生苗苗高呈极显著正相关(P<0.01)。
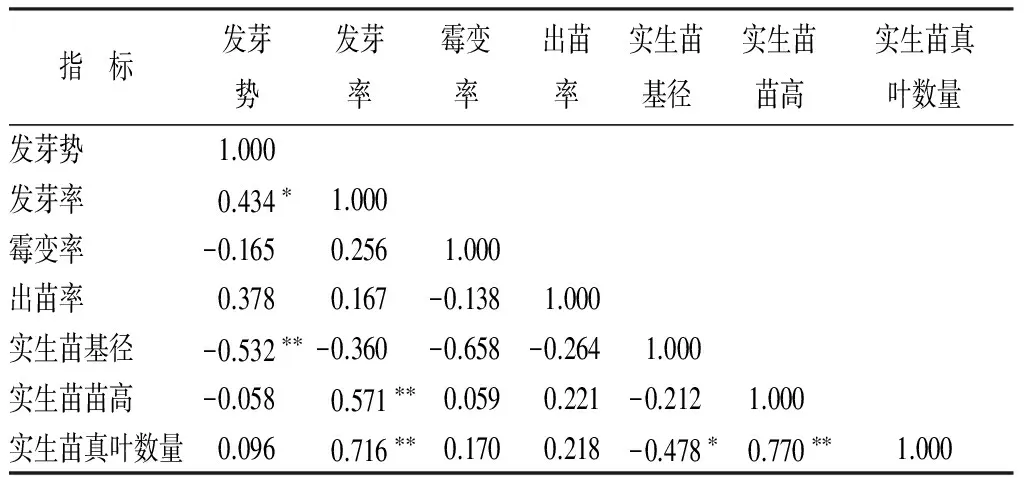
表11 所测定各指标间的相关性分析
注:*表示差异显著(P<0.05);** 表示差异极显著(P<0.01)。
3 结论与讨论
君迁子种子在用消毒剂和激素处理前先用温水浸泡比处理后再用温水浸泡更有利于种子萌发。原因可能是君迁子种子经温水浸泡后,种皮会变软,从而使得消毒剂和激素更容易渗透到种子中,并更好地发挥生理作用。
高锰酸钾是一种常用的消毒剂,在本试验所设定的梯度范围内,高锰酸钾质量分数越高,处理时间越长,则种子的霉变率越低。这一结果表明高锰酸钾作为消毒剂是有效的。此外,高锰酸钾具有药肥兼用的特点,除用作消毒剂外,还能够提高水稻[3]、大豆[17]、东南景天[18]种子的发芽率和实生苗生长能力。本研究结果与以上报道类似,高锰酸钾质量分数对君迁子实生苗基径有极显著的影响(P<0.01),当高锰酸钾质量分数为0.05%时,最有利于实生苗基径增粗。高锰酸钾促进实生苗生长的原因有可能是其溶于水后会增加水中氧气浓度,且锰离子可以活化种子酶系统,钾离子可以作为营养元素被利用[3]。
GA对种子萌发有非常重要的促进作用[4]。GA不但可以促进玉米种子的胎萌(未脱离母体以前发芽)[19-20],而且适宜质量浓度的GA还能促进拟南芥种子萌发[21]。另外,许多研究结果表明GA还可以促进已发芽种子种胚对胚乳的吸收利用[22-23]。GA3缺陷型番茄种子在纯水中可以吸水,种胚也会伸长,但不能生长[24],且种子不能最终发芽[22]。在本试验中,GA3质量浓度分别对君迁子种子发芽率、实生苗苗高和实生苗真叶数量有显著性影响(P<0.05)。用1 000 mg/L GA3处理15 h后,种子的发芽率、实生苗苗高、真叶数量都达到最大值。这说明GA3对种子萌发和实生苗生长有重要的促进作用,这一点和很多其他植物的研究结果一致[6-9]。1 000 mg/L是本试验所设定的GA3的最高质量浓度,当GA3的质量浓度高于1 000 mg/L时,它是否还能够促进发芽率、实生苗苗高和真叶数量的增加,是值得进一步研究的问题。
细胞分裂素对种子萌发也有重要的促进作用,例如适宜质量浓度的6-BA能够明显促进驱蚊香草种子萌发及种子生根[25]。生长素是另外一种促进种子萌发的植物激素,例如在豆类植物中,伴随着种子萌发,吲哚乙酸(简称IAA,为生长素的一种)的含量逐渐上升[26],再例如适宜质量浓度的2,4-D能促进小麦种子的萌发和根尖细胞的分裂[27]。本研究方差分析结果显示,6-BA和2,4-D质量浓度对所测定的指标均没有显著性影响。这一方面可能由于6-BA和2,4-D对君迁子种子萌发和实生苗生长的调控作用小,另一方面可能由于本试验所设定的这两个激素的质量浓度梯度不够合理。关于6-BA和2,4-D对君迁子种子萌发和实生苗生长的诱导能力,今后还需进一步研究。
相关性分析发现,发芽势和发芽率呈显著正相关(P<0.05),而发芽势和实生苗基径呈极显著负相关(P<0.01)。这说明在一定时间段内发芽率高的种子,其最终发芽率也高。但是发芽率高的种子其实生苗基径却较小,造成这一现象的原因目前还不清楚。另外,发芽率与实生苗苗高和真叶数量分别呈极显著呈正相关(P<0.01),这说明发芽率高的种子其实生苗苗高较高,真叶数量较多。实生苗真叶数量与苗高呈极显著正相关(P<0.01),但是与实生苗基径呈显著负相关(P<0.05),这一点表明幼苗期叶片的生长有利于苗高的增加,但是可能会减缓其茎干的增粗。
综合极差分析和方差分析结果表明,本研究所得出的提高君迁子种子发芽率的最佳处理组合为:高锰酸钾质量分数0.2%,处理时间4 h,然后用1 000 mg/L GA3处理15 h,再用40 mg/L的6-BA处理3 h,最后再用100 mg/L的2,4-D处理30 min。
[1] 逸菲.药食兼用之“黑枣”[J].食品与健康,2009(9):33.
[2] 周瑞金.柿树优良砧木介绍[J].河北果树,2009(1):53-54.
[3] 郭群利,胡晋,洪中川.高锰酸钾浸种对杂交水稻种子发芽率、成秧率的影响[J].种子,2007,26(6):87-88.
[4] Kucera B, Cohn M A, Leubnermetzger G. Plant hormone interactions during seed dormancy release and germination[J]. Seed Science Research,2005,15(4):281-307.
[5] Karssen C M, Lacka E. A revision of the hormone balance theory of seed dormancy: Studies on gibberellin and/or abscisic acid-deficient mutants of Arabidopsis thaliana[M]//Bopp M. Plant growth substances. Berlin: Springer-Verlag,1986:315-323.
[6] Swain S M, Reid J B, Kamiya Y. Gibberellins are required for embryo growth and seed development in pea[J]. Plant Journal,1997,12(6):1329-1338.
[7] Batge S L, Ross J J, Reid J B. Abscisic acid levels in seeds of the gibberellin-deficient mutant lh-2 of pea (Pisumsativum)[J]. Physiologia Plantarum,1999,105(3):485-490.
[8] Hays D B, Yeung E C, Pharis R P. The role of gibberellins in embryo axis development[J]. Journal of Experimental Botany,2002,53(375):1747-1751.
[9] Singh D P, Jermakow A M, Swain S M. Gibberellins are required for seed development and pollen tube growth in Arabidopsis[J]. Plant Cell,2002,14(12):3133-3147.
[10] Cohn M A, Butera D L. Seed dormancy in red rice (Oryzasativa): II Response to cytokinins[J]. Weed Science,1982,30(2):200-205.
[11] Saini H S, Consolacion E D, Bassi P K, et al. Control processes in the induction and relief of thermoinhibition of lettuce seed germination: actions of phytochrome and endogenous ethylene[J]. Plant Physiology,1989,90(1):311-315.
[12] Babiker A T, Ma Y Q, Sugimoto Y, et al. Conditioning period, CO2and GR24 influence ethylene biosynthesis and germination of Striga hermonthica[J]. Physiologia Plantarum,2000,109(1):75-80.
[13] Matilla A J. Ethylene in seed formation and germination[J]. Seed Science Research,2000,10(2):111-126.
[14] Fischer-Iglesias C, Neuhaus G. Zygotic embryogenesis-hormonal control of embryo development[M]//Kluwer Academic Publishes. Current trends in the embryology of angiosperms. Dordrecht: Kluwer,2001:223-247.
[15] Teale W D, Paponov I A, Ditengou F, et al. Auxin and the developing root of Arabidopsis thaliana[J]. Physiologia Plantarum,2005,123(2):130-138.
[16] 孙永玉,李昆,罗长维,等.不同处理措施对构树种子萌发的影响[J].种子,2007,26(2):22-25.
[17] 陈申宽,陈树梅.高锰酸钾浸种大豆增产显著[J].内蒙古农业科技,1989(2):25-26,16.
[18] 谢兰曼,胡建新,马忆君.东南景天种子形态特征及发芽、繁殖试验[J].江苏农业科学,2012,40(4):201-203.
[19] White C N, Rivin C J. Gibberellins and seed development in maize: II Gibberellin synthesis inhibition enhances abscisic acid signaling in culturedembryos[J]. Plant Physiology,2000,122(4):1089-1097.
[20] White C N, Proebsting W M, Hedden P, et al. Gibberellins and seed development in maize: I Evidence that gibberellin/abscisic acid balance governs germination versus maturation pathways[J]. Plant Physiology,2000,122(4):1081-1088.
[21] 陆玉建,高春明,张婷婷,等.不同激素处理对拟南芥种子萌发和幼苗生长的影响[J].江苏农业科学,2012,40(9):192-194.
[22] Bewley J D, Black M. Hormonal regulation of seed development and germination in tomato: studies on sbscisic acid-and gibbeellin-deficient mutants[D]. Wageningen: Wageningen university and research centers,1987.
[23] Kermode A R. Regulatory mechnisms involved in the transition from seed development to germination[J]. Critical Reviews in Plant Sciences,1990,9(2):155-195.
[24] 刘永庆.van der Burg W J, Bino R J.预浸对番茄种胚形态结构及发芽的影响[J].园艺学报,1994,21(4):344-350.
[25] 张福平,邝洁蓬.6-BA等对驱蚊香草种子发芽与幼苗生长的影响[J].种子,2005,24(12):74-76.
[26] Bialek K, Michalczuk L, Cohen J D. Auxin biosynthesis during Seed germination in phaseolus vulgaris[J]. Plant Physiology,1992,100(1):509-517.
[27] 韩玉波,张飞雄.2,4-D对小麦种子萌发和根尖细胞分裂的影响[J].首都师范大学学报:自然科学版,2003,24(1):64-66.
Effect of Potassium Permanganate and Phytohormone on Seed Germination ofDiospyroslotusL./
Sun Peng, Zhou Daoshun(Non-timber Forest Research and Development Center of Chinese Academy of Forestry, Zhengzhou 450003, P. R. China); Liang Chen, Chang Lingbing(Luoyang Academy of Agriculture and Forestry Science); Li Chang(Central South University of Forestry and Technology); Liang Yuqin, Zhang Jiajia(Non-timber Forest Research and Development Center of Chinese Academy of Forestry)//
Journal of Northeast Forestry University.-2014,42(6).-19~23,82
In order to investigate the regulatory effect of potassium permanganate, gibberellin (GA3), cytokinin (6-BA) and auxin (2,4-D) treatments on seed germination and seedling growth of dateplum persimmon (DiospyroslotusL.), the seeds of dateplum persimmon were treated with different gradient concentrations of potassium permanganate and phytohormone solutions according to orthogonal design. By range analysis, the seeds soaked in turn in 0.2% potassium permanganate solution for 4 h, 1 000 mg/L GA3for 15 h, 40 mg/L 6-BA for 3 h, and 100 mg/L 2,4-D for 30 min could make the best performance of germination rate among all the treatments used in our experiment. Significant differences (P<0.05) were found in the seed germination rate, the height of seedling and the number of seedling leaves among different contents of GA3, which indicated that the content of GA3was the most important factor that regulates seed germination and seedling growth. The seed germination rate was significantly (P<0.01) correlated with the seedling height and the number of leaves, which indicated that when the seed germination rate was higher, the seedling height and the number of leaves would be higher. These results are useful for improving seedling breeding of the dateplum persimmon, and may be relevant for improving the grafting of persimmon (D.kaki).
DiospyroslotusL. seeds; Potassium permanganate; Phytohormones; Germination rate
1) 国家林业局“948”项目(2013-4-24)、“十二五”国家科技支撑项目(2013BAD14B05)。
孙鹏,男,1984年10月生,中国林业科学研究院经济林研究开发中心,博士研究生。
周道顺,中国林业科学研究院经济林研究开发中心,高级工程师。E-mail:daoshun@yeah.net。
2013年8月29日。
S663
责任编辑:戴芳天。
