裂蹄木层孔菌总黄酮含量的测定及其抗氧化活性研究
2014-08-02李承范
李承范
(延边大学 分析测试中心,吉林 延吉 133002)
裂蹄木层孔菌[Phellinuslinteus(Berk.et Cart.) Teng]属木层孔菌属的药用真菌,又名针裂蹄、裂蹄针层孔菌等,其子实体多年生,硬木质、无柄,其形状呈扁半球形至马蹄形或不规则形.研究[1-3]表明,裂蹄木层孔菌的主要化学成分是子实体、菌丝体以及发酵液中的胞外多糖,此外还有黄酮及其衍生物、香豆素类、甾醇类等化合物.裂蹄木层孔菌具有化症散结药、止血止带、健脾止泻的作用[4],在抗肿瘤、降血糖、抗过敏等方面也有显著的作用[5].赵子高、回晶和Jesús Fernando Ayala-Zavala等[6-8]分别对桑黄液体发酵菌丝体和桑黄子实体的黄酮含量和抗氧化活性进行了研究,结果表明桑黄液体发酵菌丝体和桑黄子实体中的黄酮物质具有明显的抗氧化活性.本文以裂蹄木层孔菌总黄酮提取物为研究对象,探讨该提取物对DPPH自由基、羟基自由基,以及超氧阴离子自由基的清除作用.
1 实验材料和仪器
1.1 实验材料
裂蹄木层孔菌购于延吉市长白山特产品经营部,由吉林省延边特产研究所鉴定为多孔菌科裂蹄木层孔菌子实体.将裂蹄木层孔菌子实体置于烘箱,于60 ℃烘24 h后粉碎过60目筛,备用.三氯化铁、过氧化氢、亚硝酸钠、盐酸、锌粒、硝酸铝、邻二氮菲、硫酸亚铁、邻苯三酚、乙醇、甲醇、三氯甲烷、丙酮、乙酸乙酯、环己烷均为分析纯;芦丁为中国生物制品检定所生产;DPPH(1,1-二苯基-2-三硝基苯肼)由Sigma生产.
1.2 主要仪器与设备
主要仪器有:U-3400型紫外可见分光光度计(日立公司),DFT-50型手提式高速万能粉碎机(浙江温岭石林大机械有限公司),SP210S型电子天平(北京赛多利天平有限公司),SHBⅢ型循环水式真空抽滤泵(上海豫康科教仪器设备有限公司公司),Q/BKYY31-200型电热恒温鼓风干燥箱(上海跃进医疗器械厂),RE-52D旋转蒸发器(上海青浦泸西仪器厂).
2 实验方法
2.1 裂蹄木层孔菌总黄酮提取液的制备
准确称取1.006 1 g裂蹄木层孔菌子实体干粉,加入20倍体积浓度为70%的乙醇,于80 ℃水浴回流3 h,过滤,残渣重复上述操作一次;合并两次提取液,转移至100 mL容量瓶中,用70%乙醇溶液定容至刻度,备用.
2.2 裂蹄木层孔菌总黄酮含量的测定
2.2.1对照品溶液的制备 精密称取芦丁样品0.001 0 g(准确至0.000 1 g),置50 mL容量瓶中,用适量70%乙醇置水浴上加热溶解,放冷,再用30%乙醇稀释至刻度,得浓度为0.2 mg/mL对照品溶液.
2.2.2标准曲线和回归方程的建立 量取0.2 mg/mL对照品溶液0、0.25、0.5、1.0、2.0、3.0、4.0、5.0 mL分别置于25 mL容量瓶中,各加入70%乙醇至10.0 mL,然后加入5%亚硝酸钠溶液1.0 mL摇匀,放置6 min后加入10%硝酸铝溶液1.0 mL摇匀,放置6 min后再加入4%氢氧化钠溶液4.0 mL,用70%乙醇稀释至25 mL;放置15 min后,置比色皿中,以试剂空白调节零点,在波长510 nm处测定吸光度.以吸光度为纵坐标,芦丁浓度为横坐标,绘制标准曲线(见图1),得线性回归方程Y=0.095 3X+0.077 1,R2=0.998 5,线性范围为0.002~0.040 mg/mL.
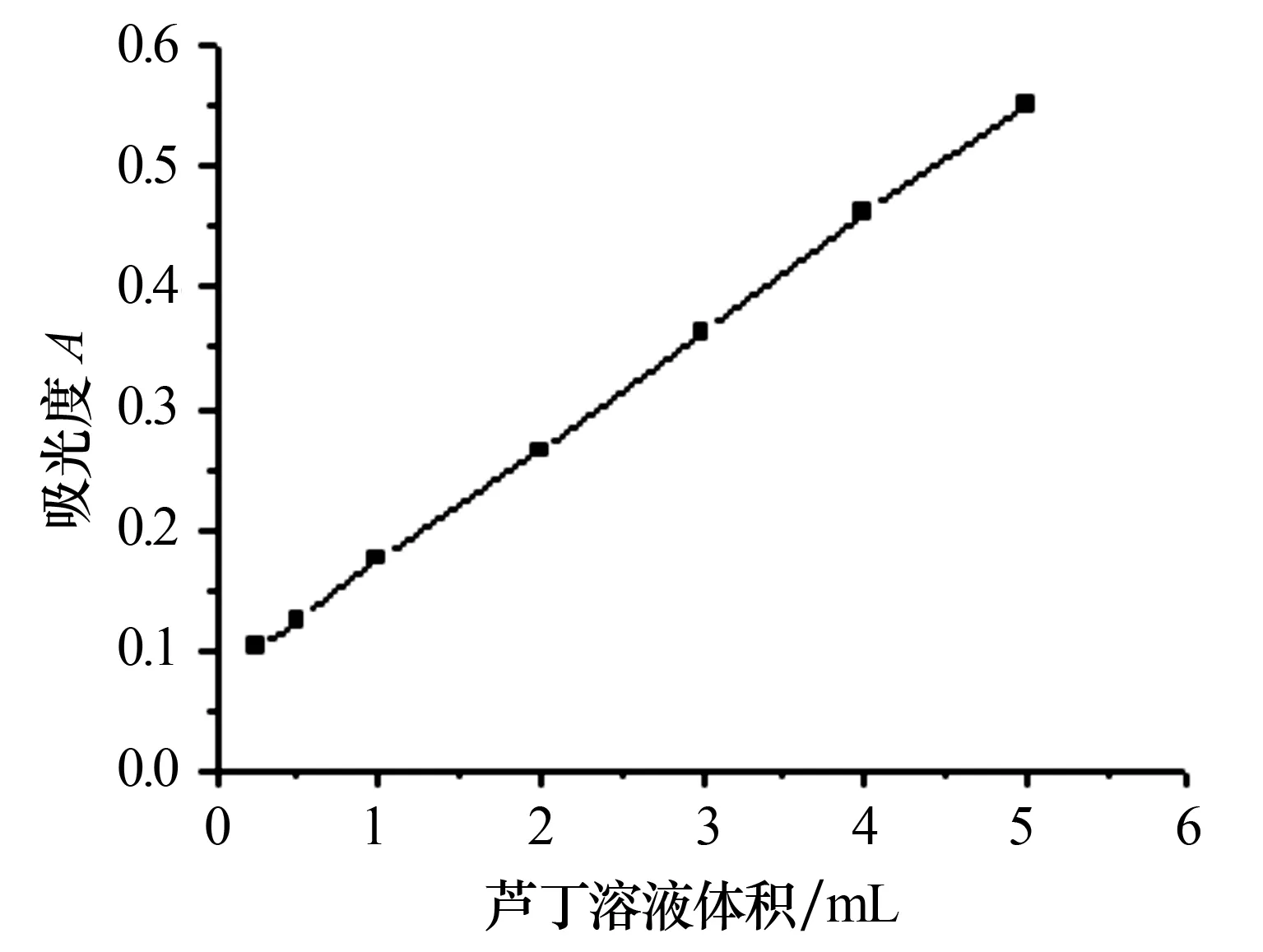
图1 芦丁对照品溶液的标准曲线
2.2.3加标回收率实验 取5份裂蹄木层孔菌总黄酮提取液1.0 mL,分别加入一定量的对照品溶液后按照2.2.2方法测定总黄酮含量,并计算其回收率.
2.2.4总黄酮含量的测定 分别精密量取待测液1.0 mL,加入9.0 mL的70%乙醇,置于25 mL容量瓶中,其余按照2.2.2方法处理.通过回归方程计算溶液浓度(C),然后再计算样品中总黄酮含量:
式中M表示称取的裂蹄木层孔菌粉末的质量(g),C表示待测液中的黄酮浓度(g/mL).
2.3 总黄酮提取液对DPPH自由基清除活性的测定
测定按照文献[9-10]中的方法进行,并根据以下公式计算溶液的抑制率:
式中Ai为样品吸光度,Ac为DPPH+70%乙醇混合液吸光度,Aj为样品+70%乙醇混合液吸光度.
2.4 总黄酮提取液对羟基自由基清除活性的测定
邻二氮菲-Fe2+是一种氧化还原指示剂,其呈色变化可反映出溶液中的氧化还原状态的变化.通过Fenton反应(H2O2+Fe2+=HO-+·OH+Fe3+)产生的羟基自由基(·OH)可使邻二氮菲-Fe2+水溶液氧化成邻二氮菲-Fe3+,从而使邻二氮菲-Fe2+在536 nm处的最大吸收峰消失,并引起吸光度的变化.利用文献[11-12]中的方法进行测定,并根据以下公式计算羟自由基的清除率:
式中A2为未损伤管吸光度,A1为损伤管吸光度,A0为样品的吸光度.
2.5 总黄酮提取液对超氧阴离子自由基清除活性的测定
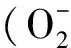
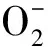
式中Ai为样品吸光度,Aj为空白吸光度.
3 结果与讨论
3.1 裂蹄木层孔菌黄酮提取液中总黄酮含量的测定
3.1.1加标回收率实验 加标回收率实验结果如表1所示.从表1可知,黄酮含量的平均回收率为100.60%,RSD为1.96%,说明本文方法可用于裂蹄木层孔菌总黄酮含量的测定.
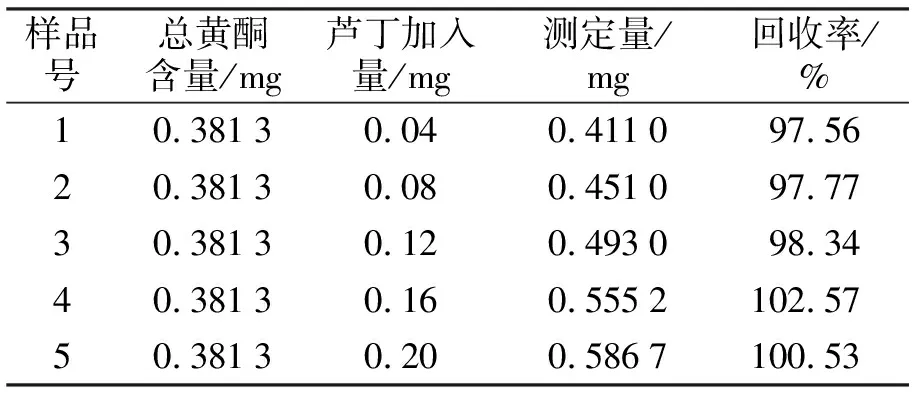
表1 加样回收率实验结果(n=5)
3.1.2总黄酮含量的测定 按照2.2.4的方法测定裂蹄木层孔菌总黄酮提取液中黄酮含量的结果如表2所示.文献[6]中桑黄液体发酵不同阶段菌丝体乙醇提取物中黄酮含量从4.4 mg/g增加到159 mg/g;文献[7]中用超声波提取桑黄子实体黄酮含量为16.14 mg/g;文献[8]中不同桑黄子实体中黄酮含量为26.48~30.58 mg/g.表2结果说明裂蹄木层孔菌总黄酮含量高于桑黄中的总黄酮含量.
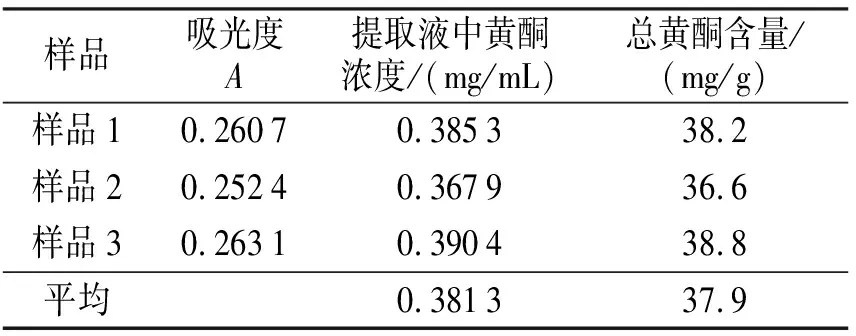
表2 裂蹄木层孔菌样品中总黄酮含量
3.2 裂蹄木层孔菌总黄酮的抗氧化性研究
3.2.1对DPPH自由基的清除活性 裂蹄木层孔菌总黄酮对DPPH·的清除能力如图2所示:当总黄酮的浓度为76.4 μg/mL时,其对DPPH·的清除率最高,为92.57%;之后,随着总黄酮浓度的增加,清除率逐步下降.
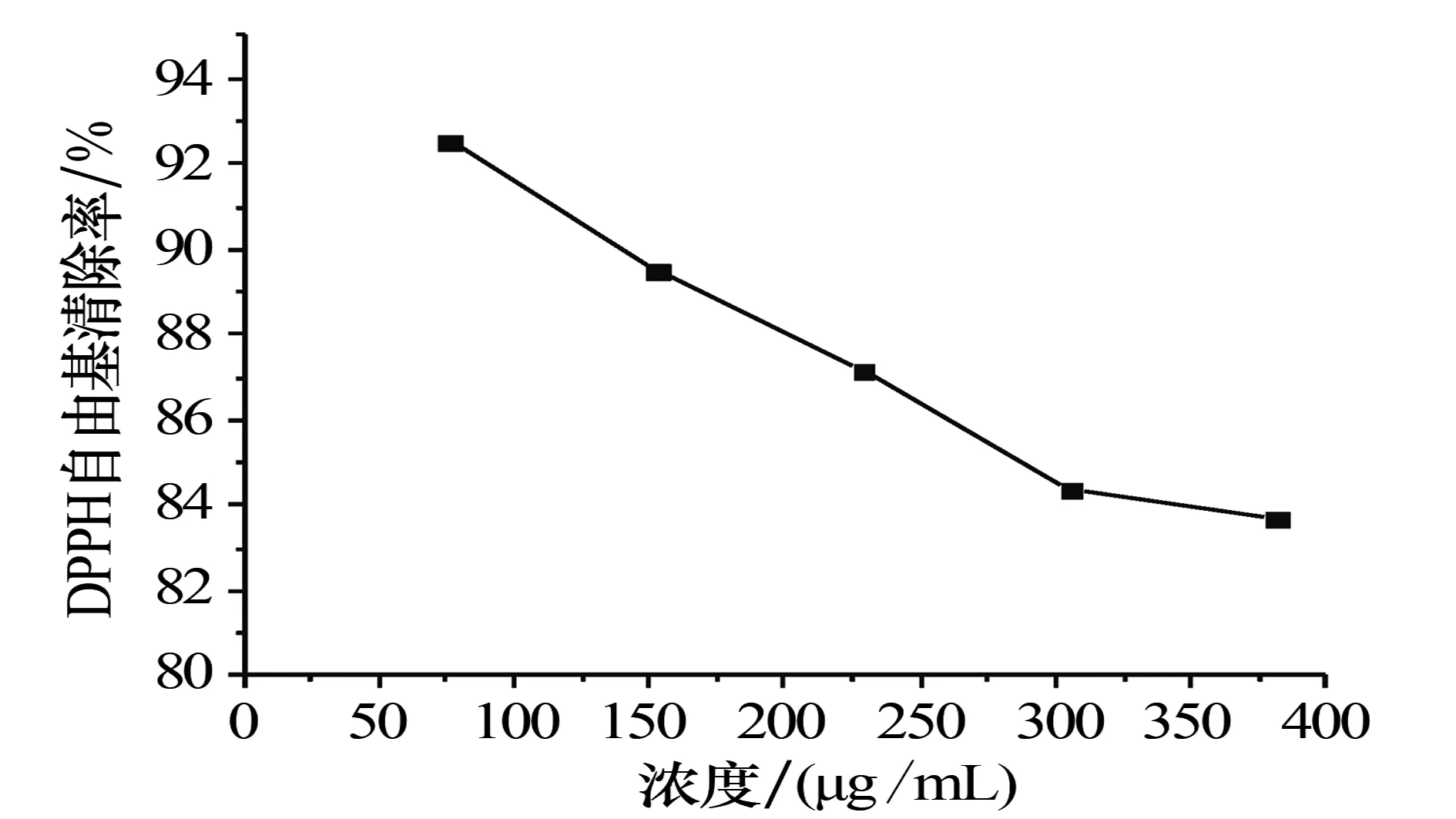
图2 不同浓度总黄酮溶液对DPPH自由基的清除率
3.2.2对羟基自由基的清除活性 裂蹄木层孔菌总黄酮对羟基自由基的清除能力如图3所示:初始时,对羟基自由基的清除率随总黄酮浓度的增加而增加;当浓度达到153 μg/mL时,清除率显著提高;当浓度达到382 μg/mL后,随着总黄酮浓度的增加,清除率增速很慢.
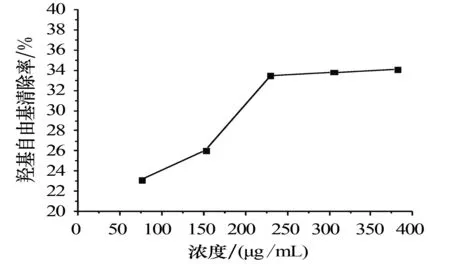
图3 不同浓度总黄酮溶液对羟基自由基的清除率
3.2.3对超氧阴离子自由基的清除活性 裂蹄木层孔菌总黄酮对超氧阴离子自由基的清除能力如图4所示:初始时,对超氧阴离子自由基的清除率随浓度的增加而增加;当浓度达到153 μg/mL时,清除率达到最高,为70.92%;之后,随着总黄酮浓度的增加,清除率出现缓慢下降.
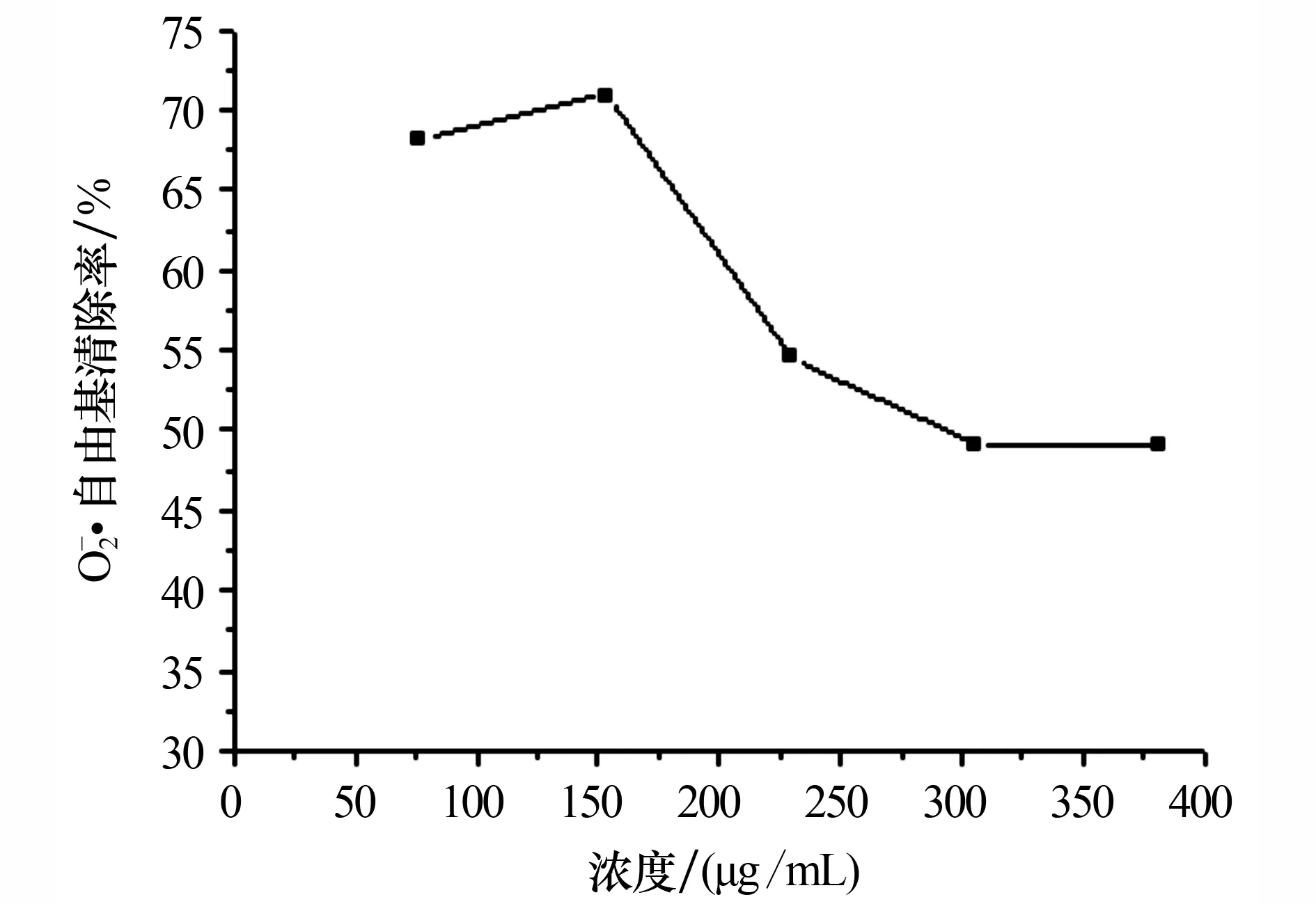
图4 不同浓度总黄酮溶液对超氧阴离子自由基的清除率
4 结论
本文用70%乙醇提取裂蹄木层孔菌总黄酮,以芦丁为对照品,建立了用紫外分光光度法测定裂蹄木层孔菌中总黄酮含量的方法,并测得裂蹄木层孔菌中总黄酮的含量为37.9 mg/g.本文方法的平均加标回收率为100.60%,因此可作为裂蹄木层孔菌中总黄酮含量测定的一种方法.研究结果表明,裂蹄木层孔菌中的总黄酮对DPPH自由基、羟基自由基、超氧阴离子自由基均有一定的清除能力,其清除作用随着黄酮浓度的增加而表现出明显的量效关系.当裂蹄木层孔菌总黄酮浓度为76.2 μg/mL时,对DPPH自由基的清除率最高,为92.57%;当总黄酮浓度为382 μg/mL时,对羟基自由基的清除率最高,为34.05%;当总黄酮浓度为153 μg/mL时,对超氧阴离子自由基的清除率最高,为70.92%.
参考文献:
[1] 薛梅,王秋颖.木层孔菌属真菌的化学成分与生物活性[J].国外医药·植物药分册,2004,19(3):103-105.
[2] 孟庆龙.桑黄发酵产物的抑菌作用[J].食品科学,2011,32(3):56-59.
[3] 池玉杰,潘学仁.七种木层菌属真菌的培养特性[J].菌物系统,2001,20(3):378-380.
[4] 中华本草编委会.中华本草[M].上海:上海科学技术出版社,1999:562.
[5] 汪开治.从裂蹄木层孔菌深层培养生产有降血糖活性的细胞外多糖[J].生物技术通报,2002(3):51.
[6] 赵子高.桑黄深层发酵生产生物活性物质的研究[D].南京:南京农业大学,2007:49-54.
[7] Jesús Fernando Ayala-Zavala, Brenda Adriana Silva-Espinoza, Manuel Reynaldo Cruz-Valenzuela, et al. Antioxidant and antifungal potential of methanol extracts of Phellinus spp. from Sonora, Mexico[J]. Rev Iberoame Micol, 2012,29(3):132-138.
[8] 回晶,李其久,边媛媛,等.桑黄总黄酮超声提取工艺及其生物活性研究[J].食品科学,2010,31(24):195-198.
[9] 张儒,张变玲,赵勇,等.人参根中黄酮类化合物提取及其抗氧化性研究[J].中成药,2012,34(10):1896-1900.
[10] Amarowicz R, Naczk M, Shahidi F. Antioxidant activity of various Fractions of non-tannin phenolics of canola hulls[J]. J Agri Food Chem, 2000,48:2755-2759.
[11] 史礼貌,解成喜.新疆大蓟总黄酮的超声提取及抗氧化性研究[J].食品科学,2011,32(6):120-123.
[12] 王文英,于文广,王郝.野生防风不同部位总黄酮类物质的提取及抗氧化性研究[J].天然产物研究与开发,2009(21):182-184.
[13] 汪海波,刘大川,畲珠化,等.大豆异黄酮类物质的提取、抗氧化性及稳定性研究[J].食品科学,2004,25(1):111-114.
[14] Concepcion S M, Jose A L. Free radical scavenging capacity and inhibition of lipid oxidation of wines, grape juices and related polyphenolic constituents[J]. Food Res Int, 1999,32:407-412.
[15] 李明静,庆伟霞,杨玉霞,等.七种天然黄酮类化合物对超氧阴离子自由基的清除活性[J].化学研究,2006,17(4):73-75.
[16] 张琳,陆维敏.黄酮类化合物抗氧化性能与其结构的关系[J].浙江大学学报:理学版,2006,33(2):187-191.
[17] 李利华.香菇中总黄酮含量的测定及抗氧化活性研究[J].光谱实验室,2009,26(3):680-684.
