酶法动态动力学拆分制备R-(-)-乙酰基邻氯扁桃酸
2014-07-05沈萨萨姜灵陆杰于洪巍
沈萨萨,姜灵,陆杰,于洪巍
(1江南大学化学与材料工程学院,江苏 无锡 214122;2浙江大学化学工程与生物工程学系,浙江 杭州 310028)
酶法动态动力学拆分制备R-(-)-乙酰基邻氯扁桃酸
沈萨萨1,姜灵2,陆杰1,于洪巍2
(1江南大学化学与材料工程学院,江苏 无锡 214122;2浙江大学化学工程与生物工程学系,浙江 杭州 310028)
采用假单胞菌脂肪酶Pseudomonassp. ECU1011催化乙酰基邻氯扁桃酸进行不对称水解,利用突变后的扁桃酸消旋酶(V29I)对拆分后的产物S-(-)-邻氯扁桃酸进行消旋,消旋后的邻氯扁桃酸经过酰化重新被利用到水解反应中,实现了酶法动态动力学拆分制备R-(-)-乙酰基邻氯扁桃酸。通过对拆分反应、拆分混合物的分离回收以及消旋反应的工艺优化,最终获得光学纯度ee>99.9%的R-(-)-乙酰基邻氯扁桃酸,其收率达80%。本研究建立的R-(-)-乙酰基邻氯扁桃酸的动态动力学拆分工艺,对其工业化应用具有重要的指导意义。
酶法动态动力学拆分;脂肪酶Pseudomonassp. ECU1011;扁桃酸消旋酶;乙酰基邻氯扁桃酸;邻氯扁桃酸
邻氯扁桃酸是一种重要的精细化学品,在医药化学品领域具有广泛应用。其中,R-(-)-邻氯扁桃酸是合成新型血小板聚集抑制剂氯吡格雷的重要中间体[1-3]。随着氯吡格雷、邻氯扁桃酸及其衍生物用途的进一步开发,R-(-)-邻氯扁桃酸的需求量日益增加,但由于受到传统工艺的限制,市场需求难以得到满足。
目前,R-(-)-邻氯扁桃酸的制备主要有以下几种方法。①直接利用不对称合成或还原的方法制备光学活性的R-(-)-邻氯扁桃酸。2009年,Yin等[4]利用金属钌(Ru)作为催化剂催化不对称氢化法合成R-(-)-邻氯扁桃酸甲酯,产物的ee值为92%。但反应条件较苛刻,且有毒的重金属易污染底物。②非对映体盐结晶法是目前工业上应用最广泛的一种拆分技术。它是利用手性试剂将外消旋体混合物中的两个对映异构体转化成非对映异构体,然后利用其物理性质的差异将非对映异构体分开,从而得到单一异构体。但其面临的共同问题是拆分剂价格昂贵,且有一定的毒性,因此在一定的程度上造成了资源的浪费和环境的污染。③酶催化拆分方法是利用具有立体选择性的酶作为催化剂,在此催化剂的作用下,底物的其中一种异构体优先反应,从而达到把两种对映异构体转化成非对映异构体,实现拆分的目的。如报道的商品酶CAL-A(Novozym 735)可以水解拆分邻氯扁桃酸甲酯,产物ee值高达99%以上[5]。但这种方法的理论收率最多50%,造成了资源的浪费。然而动态动力学拆分技术的出现为解决这个问题提出了新的思路。动态动力学拆分在动力学拆分的基础上添加了反应活性较弱的对映体的原位消旋,拆分过程与反应活性较弱的对映体原位消旋相继或同时进行,即某一对映体不断转化为产品,而另一对映体则不断地消旋化补充原料,最终得到理论产率100%的光学纯化合物[6-11]。
目前利用动态动力学拆分制备R-(-)-乙酰基邻氯扁桃酸的研究尚未见报道。如图1所示,本研究采用假单胞菌脂肪酶Pseudomonassp. ECU1011催化乙酰基邻氯扁桃酸进行不对称水解,获得未反应的R-(-)-乙酰基邻氯扁桃酸和产物S-(-)-邻氯扁桃酸[12-13]。R-(-)-乙酰基邻氯扁桃酸经过水解就可获得R-(-)-邻氯扁桃酸。同时,利用扁桃酸消旋酶使邻氯扁桃酸产物消旋化,形成邻氯扁桃酸消旋体,经过乙酰化合成拆分底物乙酰基邻氯扁桃酸,重新作为原料进入反应体系。因此,通过对乙酰基邻氯扁桃酸进行动态动力学拆分获得R-(-)-邻氯扁桃酸前体物是R-(-)-乙酰基邻氯扁桃酸制备的一种有前景的新工艺。
1 材料与方法
1.1 试剂
Pseudomonassp. ECU1011脂肪酶、乙酰基邻氯扁桃酸(纯度为99.9%)和扁桃酸消旋酶(突变体V29I)由实验室制备。R-(-)-乙酰基邻氯扁桃酸和邻氯扁桃酸(质量分数为99%),由上海精纯试剂有限公司购得。氯仿,分析纯,购自上海精纯试剂有限公司。乙酸乙酯,分析纯,购自杭州化工有限公司。其他试剂均为分析纯。

图1 乙酰基邻氯扁桃酸的动态动力学拆分
1.2 实验方法
1.2.1 乙酰基邻氯扁桃酸的拆分反应
配制磷酸缓冲液(200mmol/L,pH=6.2),取10mL置于25mL的锥形瓶中,加入50g/L的脂肪酶Pseudomonassp. ECU1011冻干粉和20mmol/L的底物乙酰基邻氯扁桃酸,反应体系为密闭体系,将反应体系置于45℃,200r/min的恒温摇床中,反应5h,获得R-(-)-乙酰基邻氯扁桃酸底物和邻氯扁桃酸产物。
1.2.2S-(-)-邻氯扁桃酸的消旋反应
配制磷酸缓冲液(200mmol/L,pH=7.5)和浓度10mmol/L的S-(-)-邻氯扁桃酸。加入10%的邻氯扁桃酸消旋酶的酶液,封闭反应体系,将反应体系置于30℃,200r/min的恒温摇床中,反应3.5h,获得邻氯扁桃酸的消旋体。
1.2.3 拆分反应后的混合物分离实验
首先,向拆分反应液中加入不同体积的氯仿萃取溶剂,将该密闭体系置30℃,200r/min的恒温摇床中,萃取30min。通过萃取收率的大小来确定萃取剂的使用量。然后,根据确定的萃取剂的使用量,分别研究了在20℃、30℃、40℃下,10min、20min、30min、40min、50min时的萃取收率,筛选出最佳萃取温度和时间。在以上优化条件下,本实验还研究了萃取次数对萃取效果的影响。每个实验均设置3个平行样,取平均值。
1.2.4 乙酰基邻氯扁桃酸的DKR反应
配制磷酸缓冲液(200mmol/L,pH=6.2),取100mL置于250mL的锥形瓶中,加入50g/L的脂肪酶Pseudomonassp. ECU1011冻干粉和20mmol/L的底物乙酰基邻氯扁桃酸,将反应体系置于45℃、200r/min的恒温摇床中,反应5h,获得R-(-)-乙酰基邻氯扁桃酸底物和邻氯扁桃酸产物。拆分反应结束后,将体系中的酶离心去除,调节pH值至7.5,加入10%的邻氯扁桃酸消旋酶的酶液,将反应体系置于30℃、200r/min的恒温摇床中,反应3.5h,获得邻氯扁桃酸的消旋体。采用溶剂萃取法将未反应的R-(-)-乙酰基邻氯扁桃酸和邻氯扁桃酸消旋体分离。将邻氯扁桃酸的消旋体酰化后得到的乙酰基邻氯扁桃酸重新用于拆分反应。最终实现动态动力学拆分的整个过程。
1.3 分析方法
分析方法为液相分析法。液相色谱仪为Agilent 1100 series(美国),AD-H柱(4.6nm×250mm),柱温保持在25℃,流动相为正己烷和异丙醇,流动相配比为90∶10,流速1mL/min,检测波长λ=254nm,进样量保持在20~50μL。在此液相条件下,测得S-(+)-乙酰基邻氯扁桃酸和R-(-)-乙酰基邻氯扁桃酸、S-(+)-邻氯扁桃酸和R-(-)-邻氯扁桃酸的保留时间分别为7.847min、8.450min、13.234min、14.378min。
底物对映体过量值eeS=(CSR-CSS)/(CSR+CSS)× 100%,产物的对映体过量值eeP=(CPS-CPR)/(CPR+CPS)× 100%,转化率由根据底物的减少计算而得,式中CSS、CSR、CPR和CPS分别为S-(+)-乙酰基邻氯扁桃酸、R-(-)-乙酰基邻氯扁桃酸、R-(-)-邻氯扁桃酸和S-(+)-邻氯扁桃酸的含量。
2 结果与讨论
2.1 乙酰基邻氯扁桃酸的拆分反应
徐建和课题组[11-12]研究发现假单胞菌脂肪酶Pseudomonassp. ECU1011可以催化乙酰基邻氯扁桃酸的不对称水解,得到R-(-)-乙酰基邻氯扁桃酸和产物邻氯扁桃酸。此脂肪酶可以优先水解S-(-)-乙酰基邻氯扁桃酸,并且产物邻氯扁桃酸的对映体过量值最高可达99%。此反应也可同时得到对映体过量值较高的R-(-)-乙酰基邻氯扁桃酸。在徐建和课题组研究的基础上,为了获得高产率的光学高纯度R-(-)-乙酰基邻氯扁桃酸,对脂肪酶催化拆分反应的条件进行了进一步的优化。
2.1.1 拆分反应的温度
为了提高R-(-)-乙酰基邻氯扁桃酸的产率,对拆分反应的温度进行了进一步的优化研究。如图2所示,在相同反应时间内,在40℃和45℃反应时R-(-)-乙酰基邻氯扁桃酸的ee值较高,消旋效果较好。而反应温度在30℃或55℃时酶活受到温度的影响,导致R-(-)-乙酰基邻氯扁桃酸的对映体过量值明显偏低。因此进一步对40℃和45℃下的R-(-)-乙酰基邻氯扁桃酸的产率进行了分析。发现由于底物自水解的发生,R-(-)-乙酰基邻氯扁桃酸的产率随着反应时间的延长而降低,而在45℃的反应条件下,反应3.5h内(R)-乙酰基邻氯扁桃酸的产率已经开始降低,此时R-(-)-乙酰基邻氯扁桃酸对映体过量值还没有达到理想值。而在温度为40℃时,自水解比较缓慢,当R-(-)-乙酰基邻氯扁桃酸的ee>99%时,R-(-)-乙酰基邻氯扁桃酸的水解量还很少,见图3。综合考虑拆分反应后R-(-)-乙酰基邻氯扁桃酸的对映体过量和产率的最优值,确定了最佳反应温度为40℃。
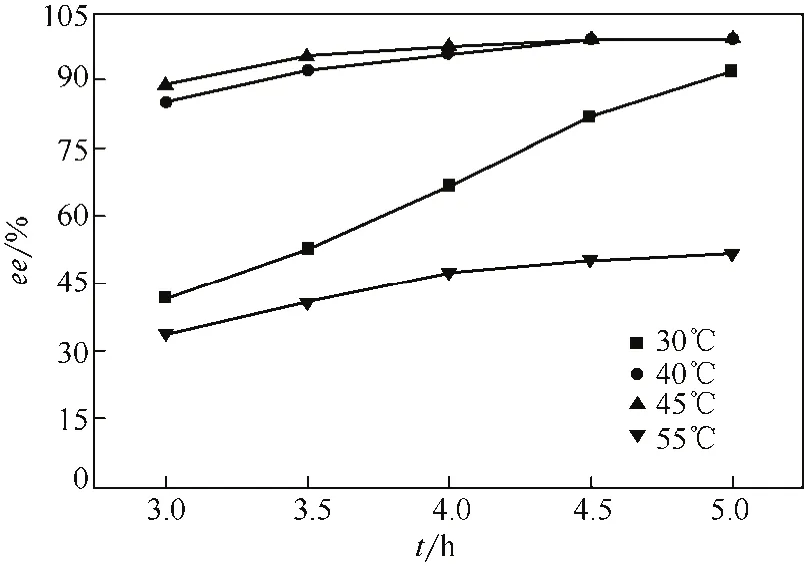
图2 温度对R-(-)-乙酰基邻氯扁桃酸的对映体过量值的影响
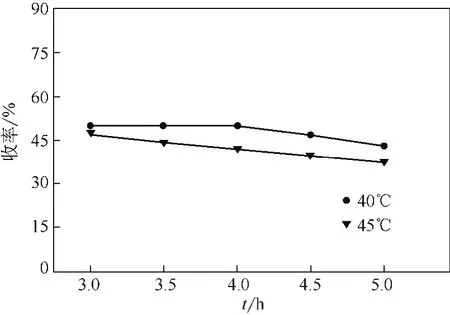
图3 温度对R-(-)-乙酰基邻氯扁桃酸产率的影响

表1R-(-)-乙酰基邻氯扁桃酸的对映体过量值和产率随时间的变化
2.1.2 拆分反应时间
拆分反应时间对R-(-)-乙酰基邻氯扁桃酸的对映体过量值和产率的影响如表1所示。随着反应时间的增加,(R)-乙酰基邻氯扁桃酸的对映体过量值也随之增大,当底物转化率超过50%时,eeS>99%。但是随着反应的继续进行,底物转化率继续升高的同时还伴随着R-(-)-乙酰基邻氯扁桃酸的量逐渐减少。当反应时间少于4.25h时,未反应的(R)-乙酰基邻氯扁桃酸的收率基本保持最大收率,但是对映体过量值不高。当反应时间大于4.25h时,未反应的R-(-)-乙酰基邻氯扁桃酸的收率开始下降,但其对映体过量值稳定在eeS>99.9%。综合考虑拆分反应后R-(-)-乙酰基邻氯扁桃酸的对映体过量和收率的最优值,确定最佳反应时间为4.25h。
综合考虑以上影响拆分效果的因素,从拆分反应中R-(-)-乙酰基邻氯扁桃酸的对映体过量和收率值的角度,确定了拆分反应的最佳条件:以20mmol/L乙酰基邻氯扁桃酸作为拆分底物,将反应体系置于40℃、200r/min的恒温摇床中,反应4.25h。
2.2 邻氯扁桃酸的消旋反应
消旋酶是一种催化底物产生消旋化的酶,它可以将单一的对映体转化为消旋体。本实验中邻氯扁桃酸的消旋反应就是通过扁桃酸消旋酶催化的。将拆分后产生的邻氯扁桃酸单一对映体经过扁桃酸消旋酶催化产生消旋体邻氯扁桃酸。得到的消旋体又可经过乙酰化反应转化为拆分底物继续进行拆分反应。从而在理论上可以使R-(-)-乙酰基邻氯扁桃酸的转化率提高至100%。因此消旋反应是动态动力学拆分过程中的重要反应。为此本实验对消旋反应的条件进行了优化,研究了pH值、温度和邻氯扁桃酸浓度对消旋反应的影响,确定了消旋反应的最佳反应条件。
2.2.1 温度对消旋反应的影响
推力杆由推力杆头、柱管、橡胶衬套总成、弹性挡圈组成,其中橡胶衬套总成由橡胶、销轴构成。平衡悬架中的推力杆结构如图2所示。
一般情况下,温度的变化会使酶的结构发生变化,从而导致选择性和反应活性发生变化,因此必须考察反应温度对消旋反应的影响。实验采用相同反应体系,分别在20℃、25℃、30℃、35℃、40℃的摇床内反应2h。结果如图4所示:邻氯扁桃酸的转化率随温度的升高而逐渐增加,当温度在25℃~30℃时,消旋反应的转化率达到最高,而随着温度的进一步升高,酶活随着温度的升高而降低,导致消旋效果进降低,使得消旋反应的转化率减少。因此消旋反应的最佳温度范围为25~30℃。以下实验温度均采用30℃。

图4 温度对消旋反应的影响
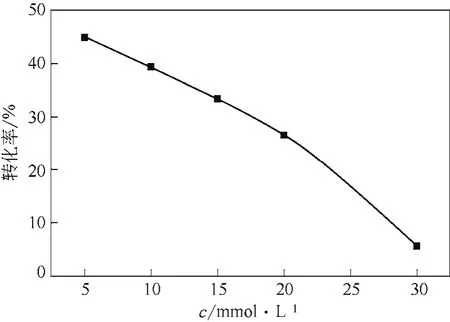
图5 底物浓度对消旋反应的影响
2.2.2 底物浓度对消旋反应的影响
配制不同浓度的底物S-邻氯扁桃酸,在相同的反应条件下反应2h。结果如图5所示:随着底物浓度的增加,消旋反应的转化率逐渐减少,消旋效果逐渐降低。原因可能是当底物浓度过高时产生底物抑制效应,对酶促反应的活性产生了消极影响。虽然当底物浓度为5mmol/L时消旋效果最好,可实际得到的产物太少,不利于实验检测和回收纯化,因此确定10mmol/L为适宜的底物浓度。
2.2.3 pH值对消旋反应的影响
配制不同pH值(6.0~8.0)的缓冲液,在相同反应条件下反应2h,结果如图6所示:随着反应体系pH值的增大,消旋反应的转化率逐渐增加,而当pH=7.5时,反应的转化率最大,达到39.4%。但随着pH值的进一步增加,反应的转化率反而下降。当继续增加消旋反应的时间(从2h延长到8h),使反应完全进行,结果显示:当pH值在6~7范围或大于7.5时,都有一定的消旋效果。在pH=7.5时,消旋反应的转化率可达50%,底物几乎完全消旋。因此,消旋反应的最佳pH值为7.5。
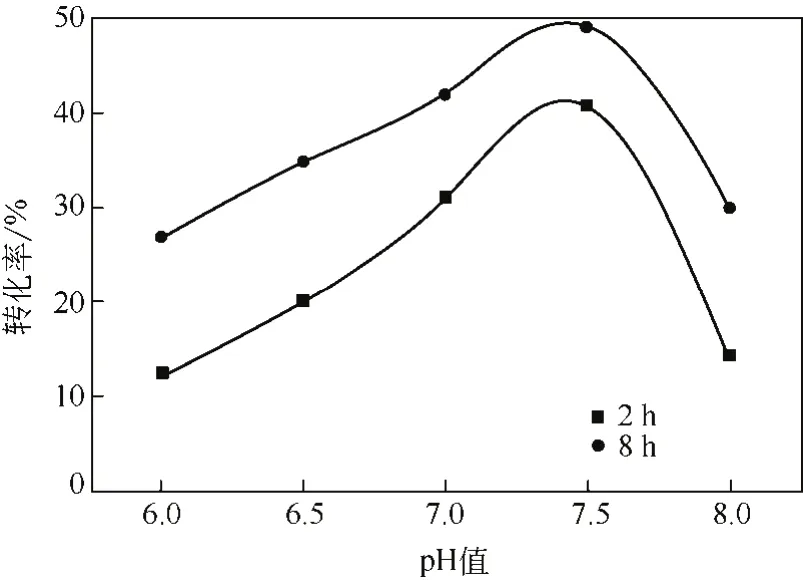
图6 pH值对消旋反应的影响
2.2.4 反应时间对转化率的影响
综合以上的各项因素,采用优化后的条件进行消旋反应,考察了完全反应所需要的时间。结果如图7所示:随着反应的进行,消旋反应的转化率逐渐增加,当反应时间超过3h后,反应的转化率接近50%,并且趋于平衡状态。因此反应3h时,消旋反应已经进行完全。
2.3 拆分产物的溶剂萃取分离过程

图7 pH值7.5时,转化率随反应时间的变化
目前对于拆分反应后的混合物主要采用柱层析的方法进行分离。但是此方法分离过程繁琐,分离量较少,经济费用较高,不适合工业化应用。工业上较常用结晶和萃取的方法进行分离。从节约成本和降低耗能的角度,采用溶剂萃取法对乙酰基邻氯扁桃酸拆分后的混合物进行分离。实验对萃取剂进行了筛选,然后对R-(-)-乙酰基邻氯扁桃酸萃取剂的使用量、萃取时的温度和时间、萃取的次数进行了研究。
2.3.1 萃取剂的选择
本研究从几种实验室较常用的有机溶剂中选择合适的萃取剂,采用乙醚、石油醚、正己烷、氯仿、乙酸乙酯作为萃取剂,分别考察了他们的萃取效果。取相同的酶法制备液,在室温下,分别加入等体积的上述5种有机溶剂进行1次萃取。萃取结果见表2。结果表明:石油醚和正己烷对R-(-)-乙酰基邻氯扁桃酸和邻氯扁桃酸均没有萃取作用,乙醚和乙酸乙酯对两种物质都有较高的萃取效果,但这两种有机溶剂无法达到让两者分离的效果。只有氯仿能够有选择性的萃取R-(-)-乙酰基邻氯扁桃酸,而对邻氯扁桃酸无萃取效果,因此可以实现前者的有效分离。而乙酸乙酯对两种物质的萃取收率都达到96%以上,因此后续制备余液中的产物邻氯扁桃酸可直接用乙酸乙酯萃取回收。为达到两者的有效分离,首先采用氯仿对酶制备液中的R-(-)-乙酰基邻氯扁桃酸进行萃取分离,再对剩余的余液直接用乙酸乙酯进行萃取,分离回收余液中的邻氯扁桃酸。
2.3.2 萃取剂用量

表2 不同有机溶剂对R(-)-乙酰基邻氯扁桃酸和邻氯扁桃酸的萃取效果
工业中采用有机溶剂进行萃取时,为了减少有机溶剂的用量,减少环境污染,降低成本,会采用最优的萃取剂量进行萃取,以期获得最大的经济效益和环境效益。因此对萃取剂氯仿在萃取过程中的使用量进行了研究。实验考察了氯仿/制备液体积比在(1∶4) ~(2∶1)(即氯仿量为2.5~20mL)时对R-(-)-乙酰基邻氯扁桃酸萃取效果的影响,见图8。结果表明,当萃取剂氯仿的体积为10~20mL时,对制备液中R-(-)-乙酰基邻氯扁桃酸的萃取效果基本保持不变,萃取收率大约在65%。随着萃取剂体积的增加,萃取收率也不再提高;但萃取剂的体积低于10mL时,由于萃取剂体积比的减小,影响了物质在两相中的分配,导致萃取收率下降。综合考虑氯仿对R-(-)-乙酰基邻氯扁桃酸的萃取回收效果以及过程中的能耗,宜选用等体积的氯仿(10mL)进行萃取,在此条件下的萃取收率为65%。
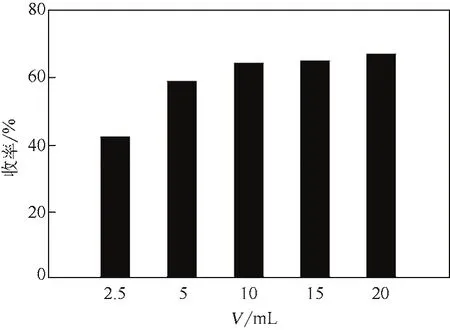
图8 氯仿用量对R-(-)-乙酰基邻氯扁桃酸萃取收率的影响
2.3.3 萃取温度和时间
萃取过程中温度的改变会导致萃取物的扩散速度以及在两相分配系数的改变,从而使萃取效果受到较大影响;萃取物在两相中达到一个分配平衡的状态需要一定的时间。因此,萃取时需考虑温度和时间对萃取效果的影响,期望节约成本和能耗,并获得最好的萃取收率。由于萃取的制备液中有Pseudomonassp. ECU1011脂肪酶的存在,考虑到在萃取过程中水解仍在缓慢进行,为避免R-(-)-乙酰基邻氯扁桃酸的进一步损失,实验应避开酶催化反应的最佳温度(50℃),因此选取20~40℃的温度范围进行萃取实验。温度以及时间对萃取效果的影响结果见图9。结果表明:随着萃取温度的升高,萃取收率也在提高,而40℃时的萃取收率明显高于其他两个温度下的萃取收率。同时随着时间的延长,同温度下的萃取收率逐渐提高。当萃取时间超过40min时,萃取效果趋于稳定。因此在后续的实验中选择的萃取条件为:温度40℃,时间40min。

图9 萃取温度和时间对R-(-)-乙酰基邻氯扁桃酸萃取收率的影响
2.3.4 萃取次数
根据前面确定的萃取条件,氯仿对制备液单次萃取时,R-(-)-乙酰基邻氯扁桃酸底物的萃取收率仅为75%,为了进一步提高萃取收率,研究考察了萃取次数对底物萃取效果的影响。在40℃的实验温度下,采用等体积的氯仿进行萃取,每次萃取时间均为40min。萃取次数对萃取效果的影响结果见图10。结果表明:在相同的条件下,对酶制备液萃取不同次数后,底物R-(-)-乙酰基邻氯扁桃酸的萃取收率最高可达到94%。在第2次萃取后,萃取收率明显升高;而当萃取次数大于2次时,萃取收率变化不大。因此,在后续的实验中确定适宜的萃取次数为2次。
综合考虑以上影响萃取效果的各因素,从节约成本和降低耗能的角度,确定R-(-)-乙酰基邻氯扁桃酸的最优萃取条件为:等体积的氯仿进行萃取,萃取温度为40℃,萃取次数2次,每次萃取时间均为40min。最终获得的R-(-)-乙酰基邻氯扁桃酸的萃取收率为96%。
2.4 产物邻氯扁桃酸的萃取
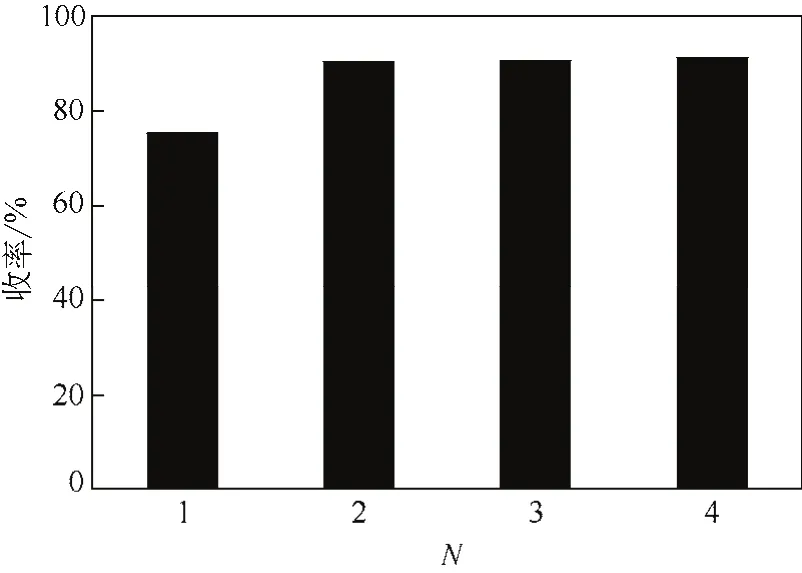
图10 萃取次数对R-(-)-乙酰基邻氯扁桃酸萃取收率的影响
萃取剂筛选实验证明乙酸乙酯对邻氯扁桃酸具有很好的分离效果(室温萃取收率达到96%以上),因此采用等体积的乙酸乙酯直接对剩余液进行萃取。考虑一次萃取可能无法达到完美的萃取效果,为了进一步提高产物的萃取收率,将萃取次数提高到2次。最终获得邻氯扁桃酸产物的萃取收率为98%。
对溶剂萃取各条件进行优化后,进一步考察了萃取过程对酶反应混合物的实际分离效果。采用乙酸乙酯直接萃取酶法制备液得到的R-(-)-乙酰基邻氯扁桃酸和邻氯扁桃酸的混合物[图11(a)]作为对照,在实验研究的最优萃取条件下,通过氯仿萃取得到高纯度的R-(-)-乙酰基邻氯扁桃酸底物[图11(b)],萃取收率为96%。并通过乙酸乙酯萃取剩余液得到高纯度的邻氯扁桃酸产物[图11(c)],萃取收率为98%。用液相色谱分别对3种萃取物进行检测。结果表明:采用氯仿和乙酸乙酯依次萃取后,可有效地分离R-(-)-乙酰基邻氯扁桃酸和邻氯扁桃酸的混合物,两者的纯度均达到99.9%。

图11 液相色谱检测结果
采用以上实验获得的优化条件,最终得到R-(-)-乙酰基邻氯扁桃酸的收率为80%,eeS>99.9%。
3 结 论
采用动态动力学方法对乙酰基邻氯扁桃酸消旋体进行拆分制备R-(-)-乙酰基邻氯扁桃酸。为获得高产率光学纯的R-(-)-乙酰基邻氯扁桃酸,实验对拆分反应和消旋反应过程分别进行了条件优化。在此优化条件下,乙酰基邻氯扁桃酸消旋体拆分获得R-(-)-乙酰基邻氯扁桃酸的产率为47%,对映体过量值ee>99%。将拆分后的混合物通过氯仿和乙酸乙酯进行萃取分离后,将反应得到的邻氯扁桃酸进行消旋化,经过3h后就可获得完全消旋化的邻氯扁桃酸消旋体。将消旋体邻氯扁桃酸转化成乙酰基扁桃酸消旋体原料后,继续作为原料用于拆分反应。反应循环4次,最终得到的R-(-)-乙酰基邻氯扁桃酸的收率为80%。此试验研究打破了传统动力学拆分反应产物产率低的局限,实现了高产率光学纯R-(-)-乙酰基邻氯扁桃酸的制备分离过程。
[1] 唐田,王彦青,王海全. 氯吡格雷硫酸氢盐的合成[J]. 中国医药工业杂志,2009,40(50):324-325.
[2] Abbert D,Ferran C,Mafrand J P. Thieno[3,2-c] pyridine derivatives and their therapeutical use:EP,0099802[P]. 1987-04-02.
[3] 陈子明,杜玉民,鲍春和. 氯毗格雷合成路线图[J]. 中国医药工业杂志,2002,33(4):206-208.
[4] Yin L,Shan W J,Jia X. Ru-catalyzed enantioselective preparation of methyl (R)-o-chloromandelate and its application in the synthesis of (S)-clopidogrel[J].Journal of Organometallic Chemistry,2009,694:2092-2095.
[5] Uhm K N,Lee Y H. Enantioselective resolution of methyl 2-chloromandelate byCandida antarcticalipase A in a solvent-free transesterification reaction[J].Journal of Molecular Catalysis B:Enzymatic,2007,45:34-38.
[6] 张占辉,刘庆彬. 酶过渡金属配合物催化的动态动力学拆分研究进展[J]. 有机化学,2005,25(7):780-787.
[7] 马红敏,邵瑞链,成俊然,等. 动力学拆分法的研究进展[J]. 有机化学,2000,4(20):454-463.
[8] Héléne P. Recent developments in dynamic kinetic resolution[J].Tetrahedron,2008,64:1563-1601.
[9] 张占金,毛金城,万伯顺,等. 路易斯酸碱催化的外消旋体(动态)动力学拆分反应[J]. 化学进展,2004,16(4):574-583.
[10] Schnell B,Faber K,Kroutil W. Enzymatic racemisation and its application to synthetic biotransformations[J].Advanced Synthesis & Catalysis Adv.,2003,345:653-666.
[11] 杜志强,王安明,王华. 手性化合物的动态动力学拆分研究进展[J].分子催化,2008,22(5):1001-3555.
[12] Xin J,Jiang P,Yu H L,et al. ImprovingPseudomonassp. esterase performance by engineering approaches for kinetic resolution of 2-acetoxyphenylacetic acids[J].Biochemical Engineering Journal,2011,57:63-68.
[13] Xin J,Jiang P,Yu H L,et al. Bioproduction of chiral mandelate by enantioselective deacylation ofα-acetoxyphenylacetic acid using whole cells of newly isolatedPseudomonassp. ECU1011 [J].Applied Microbiology and Biotechnology,2010,86:83-91.
R-(-)-acetyl-o-mandelic acid preparation via enzymatic dynamic kinetic resolution
SHEN Sasa1,JIANG Ling2,LU Jie1,YU Hongwei2
(1School of Chemical and Material Engineering,Jiangnan University,Wuxi 214122,Jiangsu,China;2School of Chemical and Biological Engineering,Zhejiang University,Hangzhou 310028,Zhejiang,China)
In this study,asymmetric hydrolysis of acetyl chloromandelic acid was catalyzed byPseudomonassp. ECU1011,and theS-(-)-chloromandelic acid in the resolution mixture was then racemerized using the mutated mandelate racemase and fed back into the hydrolysis reaction after acylation,realizing enzymatic dynamic kinetic resolution for preparation ofR-(-)-acetyl chloromandelic acid. Firstly,the conditions for enzymatic resolution,separation of resolution mixture,and enzymatic racemization were optimized. Subsequently,dynamic kinetic resolution of acetyl chloromandelic acid was conducted under the optimal conditions,obtaining optically pureR-(-)-acetyl chloromandelic acid with final yield of 80%. The conditions for enzymatic resolution,chloromandelic acid recycling and racemization were optimized in this study,leading to preliminary establishment of the dynamic kinetic resolution process forR-(-)-acetyl chloromandelic acid preparation,with guiding significance for future industrial applications.
enzymatic dynamic kinetic resolution;Pseudomonassp. ECU1011 lipase;mandelate racemase;R-(-)-acetyl-o-mandelic acid;chloromandelic acid
TQ 463;Q 819
A
1000-6613(2014)09-2425-07
10.3969/j.issn.1000-6613.2014.09.032
2014-01-02;修改稿日期:2014-01-22。
国家自然科学基金(21176102、21176215、GZ935)、江苏省自然科学基金(BK20131100)、江苏省环保科研课题基金(2012004)及浙江省自然科学基金杰出青年基金(21076181)项目。
沈萨萨(1985—),女,硕士。E-mail sasashen@163.com。联系人:陆杰,男,教授,从事结晶分离和药物合成等研究。E-mail lujie@jiangnan.edu.cn。
