混合菌群合成聚羟基脂肪酸酯研究进展
2014-07-05刘英杰贾晓强闻建平班睿
刘英杰,贾晓强,2,3,闻建平,2,3,班睿
(1天津大学化工学院生物工程系,天津 300072;2天津大学系统生物工程教育部重点实验室,天津 300072;3天津大学天津化学化工协同创新中心,天津 300072)
混合菌群合成聚羟基脂肪酸酯研究进展
刘英杰1,贾晓强1,2,3,闻建平1,2,3,班睿1
(1天津大学化工学院生物工程系,天津 300072;2天津大学系统生物工程教育部重点实验室,天津 300072;3天津大学天津化学化工协同创新中心,天津 300072)
聚羟基脂肪酸酯(PHA)是微生物体内合成的可生物降解塑料,可以作为化学塑料的替代品。利用纯培养微生物发酵的合成方法由于使用葡萄糖等优质底物及过程需灭菌等原因,产品成本较高,严重制约了PHA的广泛使用;混合菌群利用废弃物合成PHA有效降低了纯培养方法的生产成本,因此受到人们越来越多的关注。本文对混合菌群合成PHA的历史沿革、合成原理、生产工艺、提取方法等方面进行了系统综述。回顾了混合菌群合成PHA的发展历程,简述了两种主要的合成机理,介绍了不同底物合成PHA的代谢途径,重点阐述了混菌合成PHA的三段式工艺和产物提取方法,同时也对新近的研究动态进行了分析总结。指出提高混菌浓度与利用实际废弃物的能力将成为未来研究的关键。
聚羟基脂肪酸酯;可生物降解性;混合菌群;生物技术;聚合物;合成
聚羟基脂肪酸酯(PHA)是当碳源过量而营养元素如N、P、S、Mg等不足时在细菌内合成的碳源能源储藏颗粒。l925年法国巴斯德研究所的Lemoigne首次在巨大芽孢杆菌细胞中发现聚羟基丁酸酯(PHB)颗粒[1],到目前已经分离得到300多种微生物可以合成至少有150种不同单体结构的PHA,并且还在不断地发掘出新的单体结构的PHA[2]。PHA具有可再生、可生物降解、生物相容、光学活性等特性,成为塑料的良好替代品,可以应用于各种可降解包装材料,在生物医药、海洋环境、建材、农业以及食品加工中也有广泛的市场。
目前,PHA主要采用纯种发酵生产,所使用的微生物包括产碱杆菌、固氮菌、假单胞菌以及重组大肠杆菌等,胞内PHA最高含量可达细胞干重的90%[3]。但纯种发酵需使用葡萄糖等优质底物,以及灭菌等发酵控制工艺造成其生产成本昂贵,高于传统塑料的4~9倍[4]。高昂的价格严重阻碍了PHA的市场需求和使用,以至于PHA只能用于生物医药及化妆品等一些特殊领域,不能实现其塑料替代品的使命。为了降低PHA的生产成本,人们进行了大量的研究工作。其中使用混菌进行PHA生产成为一个不错的选择[5]。与微生物纯种发酵需要使用高品质底物不同,混菌发酵可以使用廉价底物甚至废弃物进行PHA生产;混菌发酵使用开放系统无需灭菌,发酵控制等工艺也相对简单;此外,不同于单菌大多只能生产单一结构PHA,而混菌发酵产物为聚羟基丁酸(PHB)、聚羟基戊酸(PHV)等的共聚物,其性能有了显著提高,使用范围更加广泛。因此混菌合成PHA的研究引起了人们极大的兴趣。本文综述了混合菌群使用廉价底物合成PHA的发展历程,并展望了未来的研究方向。
1 合成机理
1974年,在厌氧好氧交替模式的生物除磷脱氮工艺中最早发现混菌可以合成PHA[6]。该系统中主要存在两种类型细菌:聚磷菌(PAOs)和聚糖菌(GAOs)。两者都具有特殊的能量供给方式,在能量相对较低的厌氧阶段比其他微生物能更有效地摄取基质,分别通过ED和EMP途径分解糖原合成PHA类物质;而在好氧阶段,积累的PHA被作为碳源和能源物质维持生命代谢活动,从而在厌氧好氧交替运行中成为优势菌群[7]。不同的是,PAOs还参与了磷酸的循环而GAOs只能通过分解糖原获得能量。后来人们在好氧污水处理工艺中也发现了活性污泥可以合成PHA,为解释该机理人们模拟了该工艺的条件,提出饱食饥饿模式,该模式后来获得普遍接受,并在SBR反应器中进行PHA的生产和研究。关于饱食饥饿模式的解释最被认可的是PHA合成由于胞内缺乏生长所需酶或者RNA[5]。持续周期性的饱食饥饿可以使细胞内部用于生长的酶和RNA含量降低,饱食期时,由于这部分酶和RNA不能马上恢复造成细胞生长受抑制,细胞选择进行储藏PHA。
PHA积累一般都可以归结为生长受阻,厌氧好氧模式中细胞积累PHA是由于外部生长抑制(缺乏氧、氮等);饱食饥饿模式中PHA积累由于内部生长抑制(生长相关酶或者RNA不足)。特殊的,有些混合菌群可以在不存在生长抑制情况下合成PHA[8],事实上,一旦具有PHA合成能力的微生物分离出来,便可以同时进行生长和PHA积累。
2 代谢途径
虽然还没有关于混菌合成PHA代谢途径的报道,一般认为混菌的代谢途径与单菌一致[5]。具体代谢途径如图1所示。乙酸是最容易合成PHA的底物,首先乙酸活化变成乙酰辅酶A,然后两分子乙酰辅酶A缩合成羟酰辅酶A(此处为丁酰辅酶A),最后丁酰辅酶A在PHA合成酶作用下聚合成PHB。丙酸可以活化变成丙酰辅酶A,两分子丙酰辅酶A缩合成3-羟基2-甲基辅酶A,最后合成P(3H2MV)(聚3-羟基2-甲基戊酸,PHA的一种)。当乙酰辅酶A和丙酰辅酶A同时存在时还可以合成P(3HV)(聚3-羟基戊酸)或者P(3H2MB)(聚3-羟基2-甲基丁酸)。丁酸和戊酸可以分别通过丁酰辅酶A和戊酰辅酶A直接合成PHB 和PHV。糖类物质可以通过糖酵解转化成乙酰辅酶A,进而合成PHA;乙酰辅酶A还可以进入脂肪酸合成途径,最终转化为羟酰辅酶A,从而合成PHA。长链脂肪酸通过β氧化进行解链,其中间产物酮酰辅酶A和烯酰辅酶A等都可以作为羟酰辅酶A的合成前体,最终合成PHA。
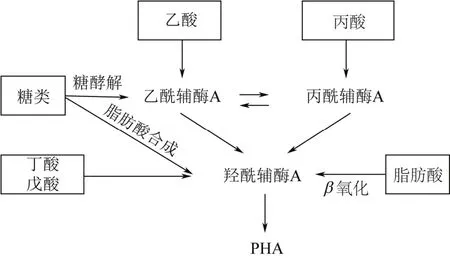
图1 混菌合成PHA代谢途径
3 合成工艺
使用乙酸等小分子脂肪酸(VFA)为底物时,一般采用两段式工艺即PHA合成菌群的筛选富集以及PHA积累。有研究表明,使用糖基底物混菌优先合成糖原而非PHA[9],因此使用糖类等废弃物时还需有一步底物酸化预处理,将复杂底物转化为VFA,即三段式工艺。
3.1 厌氧酸化
厌氧酸化预处理步一般使用厌氧全混反应器(CSTR),该工艺结构简单,建造与运行成本低,耐冲击负荷强,常作为废水的预处理[10]。有机物的厌氧降解包括4个阶段:水解、发酵酸化、产乙酸、产甲烷。该体系相当复杂,4个阶段分别对应4种不同类型的细菌:水解细菌、发酵细菌、产氢产乙酸细菌和产甲烷细菌。厌氧酸化步主要通过控制温度、pH值、水力停留时间(HRT)等手段促进水解发酵过程,抑制产甲烷菌的生长,最终使产酸率达到最大。
3.2 PHA合成菌群筛选
PHA合成中菌群筛选是最重要的一步,目的是通过施加合理的压力来获得高产和稳定的同质菌群。前述两种PHA合成机理衍生出了两种主要的筛选策略:厌氧好氧模式筛选(AN/AE)和饱食饥饿模式筛选[FF,也称动态底物投加方式(ADF)]。
3.2.1 AN/AE模式
AN/AE模式筛选得到的PAOs和GAOs合成的PHA含量最大可达到细胞干重的20%,但PHA产量不稳定。Satoh等[11]在此基础上进行了改进,提出微好氧工艺。通过在厌氧阶段通入微量的氧气既缓解了完全厌氧时聚磷或糖原水解产能有限,也避免了供氧充足时菌体主要进行同化作用而不积累PHA,从而筛选出高产PHA的优良菌株。通过该工艺Satoh获得PHA最高含量可达污泥干重的62%。郑裕东等[12]对比了厌氧好氧和微氧好氧两种工艺合成PHA的差别,染色和显微照相的结果表明,微氧-好氧工艺中PHA在细胞中的含量明显提高,但是该工艺的PHA产量也不稳定。
3.2.2 ADF模式
ADF模式一般使用SBR反应器,因为SBR以间歇操作为主要特征,可以使微生物不断经历营养丰富和匮乏阶段。这种工艺积累PHA的能力强并且产量稳定,是目前研究最为热门、最有前景的技术。在以乙酸等简单小分子有机酸为底物时,积累的PHA最高含量甚至可以达到纯菌发酵的水平。但是当使用一些低值废物质时,PHA的积累水平较纯种发酵还低得多。
不同筛选条件下,SBR中的微生物有很大的不同。Jiang 等[1]就发现20℃时污泥中主要菌群是Zoogloea,而30℃ 时Plasticicumulans acidivorans占据优势。其在另一篇文章中报道乙酸为底物时P. acidivorans是主要菌株,丙酸为底物时Thauera selenatis成为主要菌株,而当使用乙酸和丙酸混合物时,P. acidivorans和Thauerasp. 共存[13]。如何改进筛选工艺,优化筛选条件,针对所使用的底物快速有效地获得PHA高产菌群,将成为今后研究的主要方向和面对的主要挑战。
3.3 PHA积累
PHA积累即利用酸化产的VFA和筛选得到的菌群进行PHA合成。PHA的产量和组成受底物、氮磷、pH值、溶氧(DO)、温度等多因素影响。表1列出了一些使用不同底物与工艺生产PHA的例子。
3.3.1 底物影响
乙酸和丁酸等偶数碳原子VFA主要合成PHB,丙酸、戊酸等奇数碳原子VFA以及乳酸、长链脂肪酸等主要合成PHV。可见底物组成直接影响最终PHA结构,通过改变底物组成和配比可以对PHA组成和性状进行调控,从而达到人们所需性能。进料方式对 PHA合成也有很大影响。一般认为分批脉冲加入发酵底物可以克服底物抑制。Albuquerque等[14]则认为,这种投料方式会降低产率,因为每次投料时须停止操作,倒出上清液并流加新底物,这样会造成反应变慢或停止,消耗部分PHA,这方面的研究还有待深入。
3.3.2 氮磷影响
PHA是微生物在营养供给不平衡的情况下合成的。碳源充足时,通过限制氮磷的供给造成细胞生长抑制,从而促进PHA积累是一个简单可行的办法,也是大多数PHA生产研究中常用的方法。
3.3.3 pH值影响
pH 值对PHA合成的影响主要是由于高浓度有机酸造成的ATP泄漏。发酵底物乙酸等VFA在低pH值时大部分是未解离的,容易进入高pH值的胞内环境并解离,使胞内pH值降低。细胞在消耗ATP的情况下,泵出质子,来维持膜内外的质子浓度差和电势差,该过程消耗了ATP从而不利于PHA生产。因此PHA适宜在中性偏碱的环境中积累。Villano等[15]认为pH值不但会影响PHA的产量,还会影响PHA的单体组成,pH值越高,聚合物单体中HV含量越高。此外,pH值还会影响污泥和酶的稳定性。
3.3.4 DO影响
氧气作为反应中重要的电子受体,对PHA产量有很大影响。合适的DO可以促进活性污泥中细菌吸收代谢底物产生更多的ATP,从而PHA的合成;但过高的DO浓度会促进污泥生长而抑制PHA的合成[29]。需结合反应器类型、体积以及污泥浓度进行工艺条件优化,确定合适的DO,以期获得最大PHAs产量。
3.3.5 温度影响
温度的短期长期改变会对体系产生不同的影响。短期的改变主要影响微生物的代谢动力学;长期改变会影响活性污泥中微生物群落结构[30]。不同的微生物的最适温度不同,得到的PHA的产量和种类也各异,因此长期温度改变的影响更为显著。好氧/厌氧模式下,温度主要影响PAOs和GAOs的竞争。Lopez-Vazquez等[31]就发现10℃时,PAOs是优势菌群,随着温度增加GAOs逐渐占优势。而饱食饥饿模式下,Johnson等[32]研究表明,温度由15℃升高到30℃过程中,体系的饱食阶段持续时间逐渐缩短,菌体生长逐渐被抑制,PHB含量不断增加,由35%增加到最大的84%。可见温度对PHAs合成的影响是多方面的,应该结合实际反应工艺、pH值等其他条件,选取合适的发酵温度。
4 提 取
将PHA从细胞中提取出来是其工业化生产的主要限制因素之一,提取成本很大程度上影响最终的PHA成本,因此提取方法的选择意义重大。提取前一般有一步预处理来弱化坚固的细胞壁和细胞被膜,从而使后续的提取更加容易有效。预处理方法主要有加热法、碱法、氯化钠法和冻融循环法等[33]。加热法和碱法主要通过变性蛋白质等降低细胞的稳定性,使用范围广;氯化钠法和冻融循环法由于成本等因素不适宜工业上的大规模使用。提取法有溶剂抽提、次氯酸钠法等传统方法以及超临界流以及新近的非PHA细胞质子破碎等环境友好的方法。表2列出了一些主要的提取方法以及各自的原理和特点。
虽然混菌合成PHA仍处于试验研究阶段(其中混菌使用糖蜜生产PHA已实现工业化[2]),上述手段主要用于提取纯种培养合成的PHA,随着研究的不断深入,可以相信不远的将来混菌合成PHA也可以达到工业化的水平,届时,PHA提取也将成为主要的限制因素。幸运的是,和纯培养一样,混菌体系中的菌群也主要是G菌,从而基于纯培养合成的PHA提方法也可以用于混菌体系。
5 新近研究动态
由于混菌体系本身的复杂性以及细菌间相互作用关系的不可预知性,关于混菌产PHA的研究一直集中在工艺优化等表观层面,主要通过改变相应条件考量对最终PHA产量和组成的影响。随着研究的不断深入,模型构建、代谢通量分析(MFA)和通量平衡分析(FBA)等纯菌研究方法逐渐应用到混菌合成PHA的研究中,此外,末端限制性片段长度多态性技术(T-RFLP),变性梯度凝胶电泳(DGGE),实时荧光定量PCR(qPCR),显微放射自显影-原位荧光杂交(MAR-FISH)等先进技术手段的不断成熟也为研究混菌合成PHA提供了强大的技术保障。近几年混菌合成PHA的研究逐渐转向了机理层面,从而更好的指导PHA合成菌群的筛选以及生产。
Johnson等[34]通过参数测定、修正、计算、平衡、评估五步法构建了混菌合成PHA的基本模型。Jiang等[35]以乙酸和丙酸为底物构建了PHA合成模型,该模型可以很好的预测底物对最终PHA组分的影响。Pardelha等[36]尝试使用代谢通量分析(MFA)和通量平衡分析(FBA)来分析VFA组成和富集时间对最终PHA的影响。MFA分析表明,PHA储藏通量与偶数碳原子VFA吸收通量有关,而HV通量与奇数碳原子VFA吸收通量有关;FBA分析显示饱食饥饿模式驯化的结果是使TCA循环通量最小化,从而最大合成PHA。该研究表明PHA的组成和产量可以被很好的预测。与单菌不同,混菌是有多种微生物组成的复杂体系,而FBA只能对混合菌群整体进行分析,接着Pardelha又对FBA进行了改进,使用隔离FBA的分析方法来评估混菌体系细菌的代谢异质性,发现PHA组成与VFA流加方式和菌落组成也有很大的关系[37]。此外,南开大学使用T-RFLP结合DGGE技术进行了菌群结构分析并构建了体系中PHA合成酶基因文库,从基因角度对PHA组成进行了解释[38]。
6 结 语
相对于单菌,混菌合成PHA具有很多优势,相关研究已经取得了很大的进展,使用乙酸等小分子VFA为底物时混菌合成PHA的能力已经可以与单菌媲美。但是混菌体系浓度低,报道的最大菌体浓度为7g/L,而纯菌生产PHA其浓度一般能达到80g/L以上。此外,产量低也会加重提取负担,最终增加PHA成本。Dias等[2]通过模型预测当混菌浓度达到10g/L以上时才可以与单纯竞争。如何提高混菌浓度仍是混菌生产PHA面临的主要挑战,将是今后一段时间内主要的研究方向。
常用的三段式工艺较为繁琐,底物转化率较低,废水中已有的大量挥发性脂肪酸会对厌氧酸化造成强烈的抑制[39]。加之驯化周期长,有的研究使用的活性污泥混合菌群驯化时间长达2年[27],极大制约了混菌生产PHA工业化进程。此外当以真实废弃物为底物时,PHA的产量还很低,目前这方面的研究还处于起步阶段,只有糖蜜产PHA实现了工业化生产[2]。目前全世界范围内面临资源短缺和环境污染问题,利用纤维素基原料合成PHA的研究将占据越来越重要的地位,基于此我们以木糖为底物,采用驯化筛选相结合的方法一步合成PHA,最终PHA积累占细胞干重的20%,取得了很好的效果。选择合适的筛选压力,简化甚至创新生产工艺也将成为未来的研究热点。
[1]Jiang Y,Marang L,Kleerebezem R,et al. Effect of temperature and cycle length on microbial competition in PHB-producing sequencing batch reactor[J].The ISME Journal,2010,5(5):896-907.
[2]Dias J M L,Lemos P C,Serafim L S,et al. Recent advances in polyhydroxyalkanoate production by mixed aerobic cultures:From the substrate to the final product[J].Macromolecular Bioscience,2006,6(11):885-906.
[3]Sudesh K,Bhubalan K,Chuah J A,et al. Synthesis of polyhydroxyalkanoate from palm oil and some new applications[J].Applied Microbiology and Biotechnology,2010,89(5):1373-1386.
[4]Reddy C S K,Ghai R,Kalia R V C. Polyhydroxyalkanoates:An overview[J].Bioresource Technology,2003,87(2):137-146.
[5]Serafim L S,Lemos P C,Albuquerque M G E,et al. Strategies for PHA production by mixed cultures and renewable waste materials[J].Applied Microbiology and Biotechnology,2008,81(4):615-628.
[6]Wallen L L,Rohwedder W K. Poly-β-hydroxyalkanoate from activated sludge[J].Environmental Science and Technology,1974,8:576-579.
[7]魏书斋,孙静,刘丽丽. 活性污泥积累PHAs的研究进展[J]. 山东水利,2007,8:29-32.
[8]Dionisi D,Majone M,Miccheli A,et al. Glutamic acid removal and PHB storage in the activated sludge process under dynamic conditions[J].Biotechnology and Bioengineering,2004,86(7):842-851.
[9]Carta F,Beun J J,Van Loosdrecht M C M,et al. Simultaneous storage and degradation of PHB and glycogen in activated sludge cultures[J].Water Research,2001,35(11):2693-2701.
[10]贺延龄. 废水的厌氧生物处理[M]. 北京:中国轻工业出版社,1998:536-543.
[11]Satoh H,Iwamoto Y,Mino T,et al. Activated sludge as a possible source of biodegradable plastic[J].Water Science and Technology,1998,38(2):103-109.
[12]郑裕东,钟青华,马文石,等. 厌氧-好氧驯化活性污泥生物合成PHAs的研究[J]. 环境科学研究,2001,14(2):41-44.
[13]Jiang Y,Marang L,Kleerebezem R,et al. Polyhydroxybutyrate production from lactate using a mixed microbial culture[J].Biotechnology and Bioengineering,2011,108(9):2022-2035.
[14]Albuquerque M G E,Concas S,Bengtsson S,et al. Mixed culture polyhydroxyalkanoates production from sugar molasses:The use of a 2-stage CSTR system for culture selection[J].Bioresource Technology,2010,101(18):7112-7122.
[15]Villano M,Beccari M,Dionisi D,et al. Effect of pH on the production of bacterial polyhydroxyalkanoates by mixed cultures enriched under periodic feeding[J].Process Biochemistry,2010,45(5):714-723.
[16]Johnson K,Jiang Y,Kleerebezem R,et al. Enrichment of a mixed bacterial culture with a high polyhydroxyalkanoate storage capacity[J].Biomacromolecules,2009,10(4):670-676.
[17]Dai Y,Yuan Z,Jack K,et al. Production of targeted poly(3-hydroxyalkanoates) copolymers by glycogen accumulating organisms using acetate as sole carbon source[J].Journal of Biotechnology,2007,129(3):489-497.
[18]Lemos C,Viana C,Sagueiro E N,et al. Effect of carbon source on the formation of polyhydroxyalkanoates by a phosphate accumulating mixed culture[J].Enzyme and Microbial Technology,1998,22(8):662 -671.
[19]Satoh H,Ramey W D,Koch F A,et al. Anaerobic substrate uptake by the enhancedbiological phosphorus removal activated sludge treating real sewage[J].Water Science and Technology,1996,34(1):9-16.
[20]Levantesi C,Serafim L S,Crocetti G R,et al. Analysis of the microbial community structure and function of a laboratory scale enhanced biological phosphorus removal reactor[J].Environmental Microbiology,2002,4(10):559-569.
[21]Beccari M,Majone M,Massanisso P,et al. A bulking sludge with high storage response selected under intermittent feeding[J].Water Research,1998,32(11):3403-3413.
[22]Albuquerque M G E,Torres C A V,Reis M A M. Polyhydroxyalkanoate (PHA) production by a mixed microbial culture using sugar molasses:Effect of the influent substrate concentration on culture selection[J].Water Research,2010,44(11):3419-3433.
[23]Bengtsson S,Pisco A R,Reis M A M,et al. Production of polyhydroxyalkanoates from fermented sugar cane molasses by a mixed culture enriched in glycogen accumulating organisms[J].Journal of Biotechnology,2010,145(3):253-263.
[24]Rhu D H,Lee W H,Kim J Y,et al. Polyhydroxyalkanoate (PHA) production from waste[J].Water Science and Technology,2003,48(8):221-228.
[25]Bengtsson S,Werker A,Christensson M,et al. Production of polyhydroxyalkanoates by activated sludge treating a paper mill wastewater[J].Bioresource Technology,2008,99(3):519-526. [26]Bengtsson S,Werker A,Welander T. Production of polyhydroxyalkanoates by glycogen accumulating organisms treating a paper mill wastewater[J].Water Science and Technology,2008,58(2):323-330.
[27]Gurieff N. Production of biodegradable polyhydroxyalkanoate polymers using advanced biological wastewater treatment process technology[D]. Queensland:University of Queensland,2007.
[28]Waller J L,Green P G,Loge F J. Mixed-culture polyhydroxyalkanoate production from olive oil mill pomace[J].Bioresource Technology,2012,120:285-289.
[29]曲波,刘俊新. 活性污泥合成可生物降解塑料PHB的工艺优化研究[J]. 科学通报,2008,53(13):1598-1604.
[30]Lopez-Vazquez C M,Hooijmans C M,Brdjanovic D,et al. Temperature effects on glycogen accumulating organisms[J].Water Research,2009,43(11):2852-2864.
[31]Lopez-Vazquez C M,Oehmen A,Hooijmans C M,et al. Modeling the PAO-GAO competition:Effects of carbon source,pH and temperature[J].Water Research,2009,43(2):450-462.
[32]Johnson K,van Geest J,Kleerebezem R,et al. Short-and long-term temperature effects on aerobic polyhydroxybutyrate producing mixed cultures[J].Water Research,2011,44(6):1689-1700.
[33]Madkour M H,Heinrich D,Alghamdi M A,et al. PHA recovery from biomass[J].Biomacromolecules,2013,14(9):2963-2972.
[34]Johnson K,Kleerebezem R,van Loosdrecht M. Model-based data evaluation of polyhydroxybutyrate producing mixed microbial cultures in aerobic sequencing batch and fed-batch reactors[J].Biotechnology and Bioengineering,2009,104(1):50-67.
[35]Jiang Y,Hebly M,Kleerebezem R,et al. Metabolic modeling of mixed substrate uptake for polyhydroxyalkanoate (PHA) production[J].Water Research,2011,45(3):1309-1321.
[36]Pardelha F,Albuquerque M G E,Reis MAM,et al. Flux balance analysis of mixed microbial cultures:Application to the production of polyhydroxyalkanoates from complex mixtures of volatile fatty acids[J].Journal of Biotechnology,2012,162:336-345.
[37]Pardelha F,Albuquerque M G E,Carvalho G,et al. Segregated flux balance analysis constrained by population structure/function data: The case of PHA production by mixed microbial cultures[J].Biotechnology and Bioengineering,2013,110(8):2267-2276.
[38]Yang C,Zhang W,Liu R,et al. Analysis of polyhydroxyalkanoate (PHA) synthase gene and PHA-producing bacteria in activated sludge that produces PHA containing 3-hydroxydodecanoate[J].FEMS Microbiology Letters,2013,346(1):56-64.
[39]Pratt S,Liew D,Batstone D J,et al. Inhibition by fatty acids during fermentation of pre-treated waste activated sludge[J].Journal of Biotechnology,2012,159(1):38-43.
Recent Advances in polyhydroxyalkanoates production by mixed cultures
LIU Yingjie1,JIA Xiaoqiang1,2,3,WEN Jianping1,2,3,BAN Rui1
(1Department of Biological Engineering,School of Chemical Engineering and Technology,Tianjin University,Tianjin 300072,China;2Key Laboratory of Systems Bioengineering (Ministry of Education),Tianjin University,Tianjin 300072,China;3SynBio Research Platform,Collaborative Innovation Center of Chemical Science and Engineering (Tianjin),School of Chemical Engineering and Technology,Tianjin University,Tianjin 300072,China)
Polyhydroxyalkanoates (PHA) are biodegradable plastics synthesized by microorganism,which can be used as a substitute of chemical plastics. Synthesizing PHA by pure cultures is expensive due to the use of glucose and other high-quality substrates and the requirement of sterilization for the process,seriously restricting the widespread use of PHA; while synthetizing PHA by mixed cultures can use waste as substrate thus significantly reducing cost. The purpose of this paper is to describe the research advances in PHA production by mixed cultures,such as its history,synthesis mechanism,production process,and extraction method. The development of PHA production by mixed cultures is reviewed; two main synthesis mechanisms are described; metabolic pathways of different substrates to synthesize PHA are introduced; a three-stage synthesis process and product extraction are addressed; and recent research trends are summarized. Future research in this area should be focused on increasing concentration of mixed cultures and capacity of using real waste.
PHA;biodegradability;mixed cultures;biotechnology;polymers;synthesis
Q 819
A
1000-6613(2014)10-2729-07
10.3969/j.issn.1000-6613.2014.10.034
2014-02-17;修改稿日期:2014-02-24。
国家重点基础研究发展计划(2014CB745100)、天津市应用基础与前沿技术研究计划青年项目(14JCQNJC06700)及天津大学自主创新基金项目。
刘英杰(1987—),男,硕士研究生。联系人:贾晓强,副教授,硕士生导师。E-mail xqjia@tju.edu.cn。
