Ku70和端粒酶及端粒酶逆转录酶预测直肠癌新辅助放化疗的疗效
2014-07-01帆覃宇周茹海明谢学成
汤 帆覃宇周 林 源 茹海明 谢学成
作者单位:530021 南宁 广西医科大学附属肿瘤医院胃肠外科;△广西医科大学研究生学院
临床研究
Ku70和端粒酶及端粒酶逆转录酶预测直肠癌新辅助放化疗的疗效
汤 帆△覃宇周 林 源 茹海明 谢学成△
作者单位:530021 南宁 广西医科大学附属肿瘤医院胃肠外科;△广西医科大学研究生学院
目的 研究Ku70、端粒酶(telomerase)及端粒酶逆转录酶(hTERT)3种蛋白预测Ⅱ期和Ⅲ期直肠癌放疗联合XELOX方案化疗的疗效。方法 根据新辅助放化疗前后影像学检查的疗效评价,将入组患者分为有效组27例和无效组18例;采用免疫组化SP法检测两组患者新辅助放化疗前后Ku70、端粒酶及hTERT蛋白的表达情况,并分析其与疗效的关系。结果 有效组患者hTERT蛋白的表达水平比无效组低,差异具有统计学意义(P<0.05)。Ku70、端粒酶蛋白在有效组与无效组患者中的表达水平差异无统计学意义(P>0.05)。Ku70、端粒酶及hTERT蛋白的表达水平在放化疗前后的差异有统计学意义(P<0.05)。直肠癌患者新辅助放化疗的疗效与患者KPS评分、性别、年龄和病理类型等无关(P>0.05)。结论 hTERT蛋白的表达可以反映Ⅱ期和Ⅲ期直肠癌患者予放疗联合XELOX方案化疗的新辅助放化疗的疗效。
直肠肿瘤;Ku70;端粒酶;端粒酶逆转录酶;新辅助放化疗;疗效
新辅助放化疗是促进肿瘤降期、进一步提高疗效的有效措施[1],XELOX方案联合放疗是直肠癌新辅助放化疗的方案之一,但临床上不同患者之间的疗效各异,且目前尚缺该方案疗效的预测指标。因此制订疗效评估标准进行治疗以获得更好的疗效,是直肠癌新辅助放化疗关注的问题之一[2]。人端粒酶(telomerase)是由端粒酶逆转录酶(hTERT)、端粒酶RNA和假尿嘧啶合成酶组成。Shin等[3]报道端粒酶及hTERT蛋白的表达情况可以反映直肠癌放疗的敏感性。Ku70是一种二聚体蛋白,主要表达在肿瘤细胞核中,研究表明其表达与放疗敏感性相关[4]。本研究探讨Ku70、端粒酶及hTERT蛋白在直肠癌患者新辅助放化疗前后的表达水平与新辅助放化疗疗效的关系,以期为临床提供预测直肠癌新辅助放化疗疗效的指标,从而为制订合理的“个体化”综合治疗方案提供依据。
1 材料和方法
1.1 一般资料
收集我院2009年9月至2012年9月术前TNM分期确诊为Ⅱ期和Ⅲ期的中低位直肠癌(距离肛缘≤12 cm)45例患者,其中Ⅱ期19例,男性13例,女性6例;Ⅲ期26例,男性18例,女性8例。腺癌35例,其中管状腺癌23例,黏液腺癌8例,乳头状腺癌4例,未分化癌10例。患者年龄25~86岁,中位年龄48岁,KPS评分≥60分。手术治疗41例,4例未手术,术前获取组织标本45例,术后标本41例。术后病理检查pCR者未找到癌细胞,全组病例的病理类型与术前一致。所有患者经辅助检查确定无肝、肺等远处器官转移,均可耐受放化疗。全组患者均经同意并签署相关医疗文书后行术前放化疗。
1.2 治疗方法
对入组的直肠癌患者予CT或MRI影像学检查并分期评估,予以术前同步放化疗后行手术治疗。①化疗(XELOX方案):奥沙利铂50 mg/(m2·w),加入5%葡萄糖250 ml静滴2 h;卡培他滨800 mg/m2,Bid,5天/周,随放疗周期服用。②放疗:予6 MV X直线加速器X射线照射,靶区包括直肠原发灶及淋巴引流区域。等中心三野照射,后野∶左侧野∶右侧野=2∶1∶1,照射剂量为50 Gy/25次,共5周。放化疗期间定期检查血常规和肝肾功能,并予以对症和营养支持治疗。③手术:放疗结束6~8周后根据CT或MRI影像学检查的分期评估决定是否手术,可手术者在全麻下接受规范的直肠癌根治术。
1.3 评价标准及分组
①评价标准:使用CT或MRI影像学检查判定放化疗的疗效,根据WHO实体瘤疗效评定标准(RECIST 1.1)分为完全缓解(CR)、部分缓解(PR)、稳定(SD)和进展(PD)。②分组:由3位影像学专家判定肿瘤达到降期,或肿瘤最长径缩小超过30%,或达CR者判定为有效(CR+PR)组;肿瘤未达到降期或肿瘤最长径缩小未超过30%者判定为无效(SD+PD)组。
1.4 主要试剂、检测方法及结果判断
①试剂:Ku70、hTERT一抗购自药明康德新药开发有限公司;端粒酶购自北京中杉金桥生物有限公司;二抗及DAB显色剂购自福建迈新公司。②检测方法:采用免疫组化SP法检测Ku70、端粒酶及hTERT 3种蛋白的表达,玻片经防脱片处理,高压碱修复后按试剂盒说明书进行操作。③结果判断:以已知阳性表达的直肠癌标本切片为阳性对照,以PBS作阴性对照。检测的每张切片随机选取4个视野镜下观察(400倍),每个视野计数200个细胞,细胞核着色染为棕黄色为阳性细胞。阳性结果判断:>5%中染色到强染色或>50%弱染色判为癌细胞阳性;癌细胞间质单个核细胞数>50%强染色判为间质细胞阳性。计算平均阳性细胞率。
1.5 统计学方法
使用SPSS 17.0统计软件进行数据分析。蛋白表达水平的比较使用独立样本四格表的χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 患者放化疗的疗效及其与临床病理参数的关系
根据影像学检查和评估,入组患者中有效组27例,无效组18例。放化疗后获pCR 2例,CR 5例,PR 22例,SD 14例,PD 4例。放化疗期间16例(35.6%)出现各种不良反应,包括腹泻、手足综合征、肛门疼痛、肛周皮肤糜烂和白细胞减少等,大多数为Ⅰ~Ⅱ级不良反应,其中有6例(13.3%)出现Ⅲ级手足综合征,5例(11.1%)出现Ⅲ级骨髓抑制,Ⅲ级不良反应的发生率为24.4%,无Ⅳ级不良反应发生。分析显示患者的性别、年龄、病理类型和KPS评分等与放化疗的疗效无关(P>0.05)。见表1。
2.2 免疫组化法检测Ku70、端粒酶及hTERT蛋白的表达
显微镜下观察Ku70蛋白主要表达在肿瘤细胞核中;端粒酶及hTERT蛋白主要表达在肿瘤细胞核和部分细胞质中,蛋白染色后均为棕黄色颗粒,阴性对照的细胞核为深蓝色颗粒,细胞质及间质均不染色。每张切片随机选取不同视野计算棕黄色染色的细胞个数,并计算阳性细胞率。见图A、图B、图C和图D。

注:A.癌细胞细胞核呈棕黄色,少部分呈深蓝色,细胞质及间质呈现淡黄色或不染色(SP×40);B.细胞核呈棕黄色染色、深蓝色,部分细胞核呈深蓝、棕黄交界色,细胞质及间质见有大片棕黄色染色区(SP×100);C.大部分细胞核呈棕黄色,间质及细胞质未见明显染色或淡黄色(SP×100);D.细胞核呈深蓝色,细胞质及间质不染色(SP×100)。

表1 45例患者临床病理参数与疗效的关系(n)
2.3 3种蛋白在放化疗有效组和无效组及放化疗前后的表达水平
Ku70蛋白在有效组、无效组患者中阳性表达率分别为44.4%、55.6%,差异无统计学意义(P>0.05),放化疗前后Ku70蛋白的阳性表达率分别为48.8%、4.9%,差异具有统计学意义(P<0.05)。端粒酶蛋白在有效组、无效组患者中阳性表达率分别为63.0%、72.2%,差异无统计学意义(P>0.05),放化疗前后端粒酶的阳性表达率分别为65.9%、17.1%,差异具有统计学意义(P<0.05)。hTERT蛋白在有效组、无效组中阳性表达率分别25.9%、77.8%,差异性具有统计学意义(P<0.05),放化疗前后hTERT的阳性表达率分别为43.9%、9.8%,差异具有统计学意义(P<0.05)。见表3、表4。
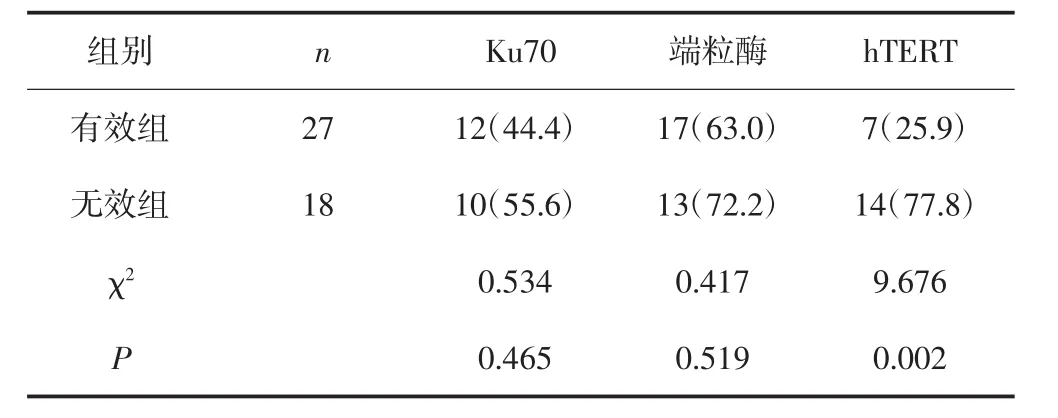
表3 Ku70、端粒酶及hTERT在放化疗有效组和无效组患者组织中的阳性表达[n(%)]

表4 Ku70、端粒酶及hTERT在放化疗前后患者组织中的阳性表达[n(%)]
3 讨论
临床上XELOX作为直肠癌一线化疗方案已成共识,卡培他滨是在体内可转变成5-FU的抗代谢氟嘧啶脱氧核苷氨基甲酸酯类药物,与奥沙利铂有协同作用,目前临床上已将XELOX方案化疗联合放疗作为进展期结直肠癌的新辅助治疗方案。有研究表明患者临床缓解与血液循环中的铂-DNA加合物的水平相关[5],如果肿瘤细胞DNA修复能力减弱,则导致对铂-DNA加合物的清除减少,使患者对铂类药物的临床缓解率提高,反之则差,所以DNA对损伤的修复能力与化疗疗效关系密切,而放射线对肿瘤细胞杀伤主要是通过肿瘤细胞DNA双链断裂导致致死性损伤,DNA损伤修复能力的高低成为影响放射敏感性的重要因素。
近年关于预测新辅助放化疗疗效的研究较多。Shim等[6]研究104例Ⅱ期和Ⅲ期直肠癌患者的疗效,结果显示GLUT1蛋白高表达者较低表达者具有较低的CR率。Chen等[7]分析1 830例直肠癌新辅助放化疗的患者,认为野生型p53与新辅助放疗有相关性,表明p53是直肠癌患者新辅助放疗治疗反应的预测指标。Pucciarelli等[8]研究98例直肠癌新辅助放化疗的结果,认为血浆中cf RNA和hTERT的水平可作为直肠癌新辅助放化疗的敏感性指标。本研究采用免疫组化法检测直肠癌组织中hTERT蛋白在有效组和无效组的阳性表达率,结果两组差异有统计学意义(P<0.05),表明直肠癌组织中hTERT蛋白低表达的患者予新辅助放化疗较高表达者有更好的疗效。而端粒酶蛋白在有效组和无效组的差异则无统计学意义(P>0.05),表明端粒酶蛋白的表达不能反映XELOX方案化疗联合放疗疗效的敏感性。认为hTERT是端粒酶的成分之一,端粒酶的表达结果差异推测与其RNA及尿嘧啶的影响有关,因此有待扩大样本量,或用PCR定量分析以进一步验证。Ku70是广泛存在于生物体内的一种核蛋白,其重要功能之一是参与DNA的双链断裂修复,检测Ku70蛋白可以预测结直肠癌放疗的敏感性,高表达者提示对放疗敏感性更好[9]。本研究Ku70蛋白的表达在有效组和无效组差异无统计学意义,表明Ku70不能反映XELOX方案化疗联合放疗的疗效,不能作为直肠癌放化疗敏感性的指标。分析其原因推测DNA双链断裂时在断裂末端Ku70和Ku80形成异源二聚体,因此不能排除Ku80的影响,亦可能与样本量较少、不同病理类型的患者对放疗敏感性不一和化疗因素影响蛋白的表达水平有关。本研究Ku70、端粒酶及hTERT 3种蛋白在放化疗前后的表达差异均有统计学意义(P<0.05),这与余细球[10]的研究结果相似。本研究入组患者新辅助放化疗后CR率为10.7%,新辅助放化疗的疗效与患者性别、年龄、病理类型和KPS评分等无相关性。但治疗后CR率较低,而不良反应高达35.6%,考虑可能为样本量较小所致。
综上,hTERT蛋白在Ⅱ期和Ⅲ期直肠癌组织中的表达情况可以反映放疗联合XELOX方案化疗的疗效,表明hTERT蛋白的表达水平与新辅助放化疗的疗效有相关性,Ku70、端粒酶蛋白的表达水平不能反映新辅助放化疗的疗效,且联合放化疗可以引起直肠癌组织Ku70、端粒酶及hTERT 3种蛋白的表达量降低。本研究3种蛋白的表达水平与生存期关系有待进一步随访调查,有必要加大样本量并深入研究。
[1] Pollack J,Holm T,Cedermark B,et a1.Late adverse effects of short-course preoperative radiotherapy in rectal cancer[J].Br J Surg,2006,93(12):1519-1525.
[2] Sauer R,Becker H,Hohenberger W,et al.Preoperative versus postoperative chemoradiotherapy for rectal cancer[J].N Engl J Med,2004,351(17):1731-1740.
[3] Shin JS,Foo T,Hong A,et a1.Telomerase expression as a predictive marker of radiotherapy response in rectal cancer[J].Pathology,2012,44(3):209-215.
[5] 李国苗,王雪霁,刘艳莉,等.低剂量放射超敏感性和放射抗拒与DNA依赖蛋白激酶的表达[J].现代肿瘤医学,2013,21(4):880-883.
[6] Shim BY,Jung JH,Lee KM,et a1.Glucose transporter 1(GLUT1)of anaerobic glycolysis as predictive and prognostic values in neoadjuvant chemoradiotherapy and laparoscopic surgery for locally advanced rectal cancer[J].Int J Colorectal Dis,2013,28(3):375-383.
[7] Chen MB,Wu XY,Yu R,et a1.p53 status as a predictive biomarker for patients receiving neoadjuvant radiation-based treatment:a metaanalysis in rectal cancer[J].PLoS One,2012,7(9):e45388.
[8] Pucciarelli S,Rampazzo E,Briarava M,et a1.Telomere-specific reverse transcriptase(hTERT)and cell-free RNA in plasma as predictors of pathologic tumor response in rectal cancer patients receiving neoadjuvant chemoradiotherapy[J].Ann Surg Oncol,2012,19(9):3089-3096.
[9] Komuro Y,Watanabe T,Hosoi Y,et a1.Prediction of tumor radiosensitivity in rectal carcinoma based on p53 and Ku70 expression[J].J Exp Clin Cancer Res,2003,22(2):223-228.
[10]余细球.希罗达术前化疗对结直肠癌组织TP/PD-ECGF表达和血管生成的影响[J].世界华人消化杂志,2007,15(1):95-98.
[2013-11-25收稿][2014-01-23修回][编辑 阮萃才]
Ku70,telomerase and hTERT as novel predictors of sensitivity to neoadjuvant chemoradiotherapy to treat rectal cancer
TANG Fan△,QIN Yu-zhou,LIN Yuan,RU Hai-ming,XIE Xue-cheng△(Department of Gastrointestinal surgery,Affiliated Tumor Hospital of Guangxi Medical University;△Graduate School of Guangxi Medical University,Nanning 530021,P.R.China)
QIN Yu-zhou.E-mail:qyz402@126.com
Objective To correlate the efficacy of neo-adjuvant chemoradiotherapy in phaseⅡandⅢrectal cancer patients with expression of Ku70,telomerase and hTERT proteins.Methods Expression levels of Ku70,telomerase and hTERT were analyzed by immunohistochemistry in rectal cancer patients who responded effectively to neoadjuvant chemoradiotherapy(XELOX regimen,n=27)and in patients in whom such therapy was ineffective(n=18).Levels in the two groups were compared before and after neoadjuvant chemoradiotherapy.Results Expression of hTERT was significantly lower in patients who responded effectively to therapy than in those who did not(P<0.05).The two patient groups showed similar expression of Ku70 and telomerase(P>0.05).In each of the patient groups,expression levels of hTERT,telomerase and Ku70 differed significantly before and after chemoradiotherapy(P<0.05).Efficacy of neoadjuvant chemoradiotherapy did not correlate with sex,age,pathological type or KPS score(P>0.05).Conclusion Expression of hTERT in phaseⅡandⅢrectal cancer patients may correlate with the efficacy of neoadjuvant chemotherapy combined with radiotherapy.
Rectal neoplasm;Ku70;Telomerase;hTERT;Neoadjuvant chemoradiotherapy;Efficacy
R735.3+7
A
1674-5671(2014)01-05
10.3969/j.issn.1674-5671.2014.01.10
广西教育厅科研基金资助项目[200911MS29]
覃宇周。E-mail:qyz402@126.com
