高致病性猪繁殖与呼吸综合征病毒N基因真核表达载体的构建及表达
2014-06-29廖立珊曾少灵杨俊兴阮周曦张彩虹曹琛福唐金明吕建强秦智锋林庆燕花群义
廖立珊,曾少灵,孙 洁,杨俊兴,阮周曦,张彩虹,曹琛福,唐金明,吕建强,秦智锋,林庆燕,花群义
(深圳出入境检验检疫局动植物检验检疫技术中心/深圳市外来有害生物检测技术研发重点实验室,广东 深圳 518045)
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)又称猪蓝耳病,是由猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)引起的一种以母猪繁殖障碍、仔猪呼吸道症状和高病死率为特征的传染病。自1987年首先在美国发现该病,此后迅速波及欧、亚各国,一度给世界养猪业造成巨大的经济损失[1-2]。目前,世界上流行的PRRSV毒株以基因型区分主要分为以LV株为代表的欧洲型和以VR2332株为代表的美洲型。我国已在许多地区分离PRRSV,该病已在我国流行[3-6]。PRRSV 基因组有ORF1~ORF7共8个开放阅读框(open reading frames,ORFs),其中ORF1包括ORF1a 和ORF1b。ORF2~ORF7编码7种病毒结构蛋白,分别是GP2a、GP2b、GP3、GP4、GP5(E蛋白)、基质蛋白(M蛋白)和核衣壳蛋白(N蛋白)。N蛋白是含有一个潜在糖基化位点的磷酸化蛋白,是PRRSV粒子中含量最高的结构蛋白,占病毒蛋白的20%~40%[7]。N蛋白保守性较好,在欧洲株与美洲株中N蛋白的氨基酸组成相对保守,可作为PRRSV抗体的检测抗原,无论在早期还是晚期都有重要的诊断学意义[8]。本研究利用 Bac-to-Bac杆状病毒表达系统表达高致病性PRRSV云南A06株的N蛋白,为进一步研究N蛋白的结构、功能及免疫学特性奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒 从云南某猪场猪病料中分离到的PRRSV毒株A06、Sf9昆虫细胞、穿梭质粒Bacmid(在DH10Bac细胞中)均由本室保存;质粒pMD18-T,宝生物工程(大连)有限公司产品;E.coli DH 5α,Novagen 公司产品;转移载体pFast-BacHTB,Invitrogen公司产品。
1.1.2 试剂与仪器 病毒RNA/DNA快速纯化试剂 盒 (MiniBEST Viral RNA/DNA Extraction Kit)、一步法反转录PCR试剂盒(One Step RNA PCR Kit)、DNA分子量标记(Marker DL 2000和6000)、DNA凝胶回收试剂盒(Agarose Gel DNA Purification Kit)、pMD18-T克隆载体连接试剂盒、质粒DNA小量纯化试剂盒(MiniBEST Plasmid Purification Kit)和限制性内切酶等,宝生物工程(大连)有限公司产品。DNA测序由宝生物工程(大连)有限公司负责完成。ABI Veriti 96well Thermal Cycler型PCR仪,BioRad Universal HoodⅡ凝胶成像仪,Eppendorf 5415R型高速离心机,CTC-256型恒温恒湿培养箱等。
1.2 方法
1.2.1 引物设计 在GenBank上搜集PRRSV多个毒株的ORF7基因序列,经分析比较,同源性很高,利用PrimerSelect软件设计一对引物,扩增全长ORF7基因,上、下游引物5′端分别添加BamH Ⅰ和HindⅢ酶切位点(划线部分),引物由深圳超世生物,宝生物工程(大连)有限公司合成。通用引物PUC13F/PUC13R参照Bac-to-Bac杆状病毒表达系统由深圳莱伯克生物技术有限公司合成。引物序列 如 下:PRRSV-N-F-BamH Ⅰ:CGGATCCATGCCAAATAACAACG ;PRRSV-N-R-HindⅢ:GAAGCTT TCATGCTGAGGGTGATGC;PUC13Forward:5′-CCCAGTACGACGTTGTAAAACG-3′; PUC13 Reverse:5′-AGCGGATAACAATTTCACACAGG-3′。
1.2.2 病毒RNA的提取 按病毒RNA/DNA快速纯化试剂盒(MiniBEST Viral RNA/DNA Extraction Kit)操作说明书,对PRRSV毒株A06的细胞培养物提取病毒RNA。
1.2.3 ORF7基因的RT-PCR扩增与目的扩增片段的回收 按一步法反转录PCR试剂盒(One Step RNA PCR Kit)操作说明书,以PRRSV-N-F 和PRRSV-N-R进行 RT-PCR 扩增,在 PCR Express Gradient PCR仪上执行以下反应程序:42℃45min;95℃ 3min;94 ℃ 30s,58 ℃ 40s,72 ℃30s,35个循环;72℃10min。以12g/L琼脂糖凝胶电泳对扩增产物进行检测。按DNA凝胶回收试剂盒(Agarose Gel DNA Purification Kit)操作说明书,回收目的扩增片段。
1.2.4 重组转座载体的构建 将回收的PCR产物与杆状病毒转移载体pFastBacHTB分别用BamHⅠ和HindⅢ双酶切,并回收目的片段,用T4DNA连接酶16℃连接过夜,转化大肠埃希菌DH 5α。经蓝白斑及抗性筛选,挑取阳性菌落,提取质粒,采用相应引物进行PCR鉴定和双酶切鉴定。将鉴定结果正确的重组质粒命名为pFastBacHTB-PRRSV-N。
1.2.5 穿梭载体的构建 按照Bac-to-Bac Baculovirus Expression System使用说明,将重组质粒pFast-BacHTB-PRRSV-N 转化 DH10Bac,用三抗(庆大霉素、卡那霉素和四环素)抗性筛选及蓝白斑筛选,挑取白色菌落,提取质粒。分别利用特异性引物和通用引物PUC13F、PUC13R进行PCR鉴定。通用引物的扩增条件如下:93℃3min;94℃45s,45℃45s,72℃5min,35个循环;72℃7min。阳性重组转座子命名为rBacmid-N。
1.2.6 重组蛋白的表达及免疫学检测 按照Cellfection Reagent转染试剂盒说明书操作,将重组质粒转染六孔板Sf9昆虫细胞,28℃培养72h,期间观察细胞形态变化,28℃培养72h,并设置未转染的正常Sf9细胞作为空白对照。感染后72h,弃培养基上清,细胞沉淀用冰预冷的PBS洗涤2次,混匀。样品缓冲液和样品的比例为1∶1,样品缓冲液:β-ME=9∶1,将沉淀打散后煮沸15min,3000r/min离心10min后用于SDS-PAGE。
将病变明显的Sf9昆虫细胞弃去上清,用PBS洗涤昆虫细胞,放入-80℃冰箱,反复冻融3次,用常规方法裂解细胞。进行SDS-PAGE后,电转印到硝酸纤维素膜上,用PRRSV阳性血清作为一抗,以辣根过氧化物酶标记的抗猪IgG作为二抗,经二氨基联苯胺(DAB)显色,待2min~3min后条带深至要求,终止显色,用去离子水略微漂洗,观察特异性条带。
2 结果
2.1 ORF7基因的扩增
以PRRSV-N-F和PRRSV-N-R引物扩增全长 N基因,通过12g/L琼脂糖电泳检测可见大小约372bp的扩增片断,与预期目的片段大小相符(图1)。

图1 N基因RT-PCR扩增结果Fig.1 N gene amplified by RT-PCR
2.2 重组转座载体pFastBacHTb-N的酶切鉴定
pFastBacHTb-N重组质粒经BamHⅠ和HindⅢ双酶切后,分别切出约4857bp和372bp两个条带,与预期结果相符(图2)。
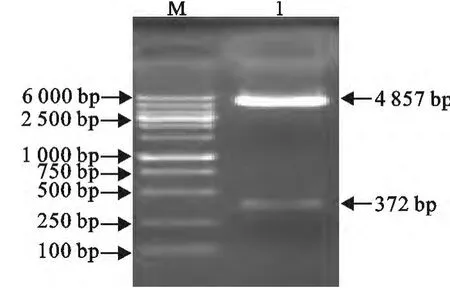
图2 重组质粒的酶切鉴定结果Fig.2 Indentification analysis of recombinant plasmid by enzyme digestion
2.3 重组Bacmid DNA的PCR鉴定
由于用N特异性引物进行PCR鉴定呈阳性的菌落可能是野生型Bacmid和pFastBac-HTb-N的杂合子,所以用引物 M13-P1和 M13-P2对重组Bacmid-N进行鉴定。PCR扩增产物大小约为3000bp,与预期大小相符(图3)。

图3 Bacmid-N PCR鉴定结果Fig.3 PCR identificion of Bacmid-N
2.4 重组Bacmid转染Sf9后的细胞病变
重组Bacmid转染Sf9昆虫细胞后,早期(24h~48h)细胞变大,细胞核变大,几乎充满细胞,之后细胞生长停止,部分细胞脱落漂浮,细胞质中出现小颗粒,部分细胞溶解、破裂,溶液中出现细胞碎片(图4),72h后收获细胞。

图4 重组Bacmid转染Sf9细胞后的细胞病变,左边图片为正常对照(400×)Fig.4 Pathologic lesions of Sf9cells transfected by recombinant bacmid;Left.Negative control(400×)
2.5 表达产物的SDS-PAGE电泳结果
经SDS-PAGE分析表达蛋白,比对照组多出一条约17ku的蛋白条带,与预期大小基本一致(图5)。
2.6 Western blot检测结果
经SDS-PAGE电泳,然后转移硝酸纤维素膜,用PRRSV阳性血清和抗猪IgG作为第一和第二抗体对表达产物进行免疫印迹分析(Western blot),结果如图6所示,在硝酸纤维素膜上17ku处出现特异性条带。

图5 重组N蛋白的SDS-PAGE分析Fig.5 SDS-PAGE analysis of recombinant protein N

图6 重组蛋白N的Western blot分析Fig.6 Western blot analysis of recombinant protein N
3 讨论
目前,国内外许多学者都对PRRSV的N基因进行了原核表达,本试验利用N基因重组到杆状病毒,在昆虫细胞Sf9中表达,通过SDS-PAGE和Western blot试验结果表明N基因在重组杆状病毒感染的Sf9细胞中表达了重组N蛋白。
N蛋白为高保守性的非糖基化核衣壳蛋白,具有良好的免疫原性和反应原性,能激发机体产生较强的免疫应答。PRRSV感染7d后,机体首先产生针对该蛋白的抗体,随后才产生针对其他蛋白的抗体,该抗体最长可维持1年以上。虽然该抗体没有中和活性,但能反应病毒在机体内的复制水平。因此,N蛋白在PRRSV诊断方法的研究上具有较高的研究价值[9-10]。
本研究采用的Bac-to-Bac昆虫表达系统表达外源重组蛋白,相对传统原核表达系统,具有许多优点[11]。该表达系统能够稳定且高水平的表达外源蛋白[12],且重组蛋白大多均具有天然活性。杆状病毒穿梭载体Bacmid含有完整的AcMNPV基因组,既能在大肠埃希菌中低拷贝复制和稳定分离,又可以直接转染昆虫细胞,得到病毒粒子。外源基因通过位点特异性转座作用整合到Bacmid中,经过筛选重组Bacmid,直接转染昆虫细胞,得到纯的重组病毒,同时高效表达外源基因,该系统具有快速稳定高效等特点。
本研究表达的猪繁殖与呼吸综合征病毒N蛋白,在病毒感染细胞后的培养上清中理论上应该检测到一定浓度的重组N蛋白。为证明这一点,利用常规SDS-PAGE,结果上清中没有出现目的条带,而在细胞裂解物中有清晰可见目的蛋白条带。将收获的细胞裂解液与细胞培养上清经SDS-PAGE后进一步做Western blot鉴定表达产物是否具有抗原性,能否与相应抗体结合,结果显示细胞裂解液可见一清晰的17ku蛋白带,具有抗原性。
本研究利用杆状病毒表达系统表达PRRSV云南A06株N蛋白,并证明N蛋白具有良好的免疫原性,为进一步研究N蛋白功能的研究和猪繁殖与呼吸综合征的诊断试剂盒研究鉴定了基础。
[1]Li Y F,Wang X L,Bo K T,et al.Emergence of a highly pathogenic porcine reproductive and respiratory syndrome virus in the Mid-Eastern region of China[J].Vet J,2007,174(3):577-584.
[2]袁庄川,王鲁彦,梅匀安,等.猪繁殖与呼吸综合征病毒GP5基因的克隆和原核表达[J].动物医学进展,2013,34(12):17-21.
[3]陈博文,孙颖杰,罗长保,等.猪繁殖与呼吸系统综合征的血清学检测及病毒的分离和鉴定[J].中国兽医杂志,1996,22(5):6-8.
[4]姜 平,简中友,马志勇,等.中国某地区猪繁殖与呼吸综合征流行病学调查及病毒分离[J].南京农业大学学报,1996,19(8):118.
[5]杨汉春,管山红,尹晓敏,等.猪繁殖与呼吸综合征病毒的分离与初步鉴定[J].中国兽医杂志,1997,23(10):9-10.
[6]刘文兴,蔡雪晖,郭宝清,等.猪繁殖与呼吸道综合征病毒(PRRSV)分离鉴定及其与欧美PRRSV抗原的比较[J].中国畜禽传染病,1998,20(4):193.
[7]Meng X J,Paul P S,Halbur P G,et al.Sequence comparison of open reeding frames 2to 5of low and high virulence United States isolates of porcine reproductive and respiratory syndrome virus[J].J Gene Virol,1996,76:3181-3188.
[8]黄小波,钱洪喜,曹三杰,等.猪繁殖与呼吸综合征病毒ORF7基因的克隆及其在毕赤酵母中表达[J].中国兽医学报,2013,33(8):1137-1141.
[9]Denac H,Moser C,Tratschin J D,et al.An indirect ELISA for the detection of antibodies against porcine reproductive and respiratory syndrome virus using recombinant nucleocapsid protein as antigen[J].Virol Meth,1997,65(2):169-181.
[10]夏平安,尹彦涛,李素平,等.猪繁殖与呼吸综合征病毒重组N蛋白的高效表达及间接ELISA方法的建立[J].中国兽医科学,2009,29(5):537-541.
[11]Stepanyuk G,Xu H,Chia Kuei Wu,et al.Expression,purification and characterization of the secreted luciferase of the copepod Metridia longafrom Sf9insect cells protein[J].Protein Expr Purif,2008,61(2):142-148.
[12]Kost T A,Condreay J P,Jarvis D,et al.Baculovirus as versatile vectors for protein expression in insect and mammalian cells[J].Nat Biotechnol,2005,23(5):567-575.
