凝固酶阴性猪葡萄球菌的分离鉴定及耐药性研究
2014-06-29刘金凤白安斌梁兆强吴健敏
刘金凤,陈 冰,谢 江,白安斌,马 玲,梁兆强,李 辉,吴健敏*
(1.广西兽医研究所,广西 南宁 530001;2.南宁市水产畜牧兽医局,广西 南宁 530022;3.南宁市动物卫生监督所,广西 南宁 530001)
凝固酶阴性葡萄球菌(coagulase negative Staphylococcus,CNS)是一种条件性人兽共患病原菌,广泛存在于自然界及人、动物的皮肤、黏膜组织中。条件合适时可在动物体内大量生长繁殖,引起机体的局部毛囊炎、肺炎、心包炎、子宫内膜炎等炎症反应。近年来,凝固酶阴性葡萄球菌已成为具有重要临床意义的感染致病菌。
子宫内膜炎(Endometritis)是子宫黏膜的卡他性或化脓性炎症,是引起母猪繁殖障碍的主要疫病之一。据统计,近年来在规模化养猪生产中,因发情延期或发情不正常而屡配不孕的母猪中有50%以上都会患有子宫内膜炎[1]。子宫内膜炎造成的子宫内膜损伤,不仅影响配子受精和胚胎发育着床,严重时引起胎儿死亡、流产等,给养猪业造成重大经济损失[2]。一直以来,临床上常用抗生素进行治疗,但效果不显著,这与病因不明大量滥用抗生素和消毒药造成病原菌耐药性增强不无关系。为此,本研究针对分离自猪子宫内膜炎的一株病原菌进行系统鉴定及耐药性研究,筛选敏感性药物,为临床上有效治疗猪子宫内膜炎提供参考。
1 材料与方法
1.1 材料
1.1.1 样品 无菌取广西南宁市某农场种猪场临床诊断为子宫内膜炎,经药物治疗,虽有好转,但未痊愈的经产母猪的子宫脓性分泌物。
1.1.2 主要试剂 营养肉汤培养基、MH培养基、微量生化鉴定管、药敏纸片,杭州微生物试剂有限公司产品;PCR Mix,宝生物工程(大连)有限公司产品;DNA Marker,北京康为世纪公司产品;基因组DNA提取试剂盒、DNA纯化回收试剂盒,北京天根公司产品;其他常规试剂均为分析纯。
1.2 方法
1.2.1 细菌分离鉴定 无菌取子宫分泌物,10000r/min离心1min,弃去大部分上清,将沉淀混合物接种于50mL/L山羊血琼脂平板和普通琼脂平板,37℃分别需氧和厌氧培养12h~24h后,挑选形态特征一致的优势菌落,接种于50mL/L山羊血琼脂平板进一步纯化,培养24h后观察菌落颜色、形态特征,并分别挑取单个菌落进行革兰染色、芽胞染色、鞭毛染色、运动性检查。根据菌落、菌体形态,染色特性及运动特性进行初步判定,然后将典型菌落接种于营养肉汤进行增殖培养备用。
1.2.2 生理生化特征鉴定 采用细菌生化反应微量鉴定管对分离菌的各项生理、生化指标进行测试,依据常见细菌系统鉴定手册对各生理生化反应结果进行判定[3]。
1.2.3 16SrRNA序列测定及分析 按常规方法提取菌株的基因组DNA,以其为模板,参照文献[4]合成16SrRNA基因通用引物并进行PCR扩增。扩增产物送上海生工生物工程技术服务有限公司进行测序。测序结果在NCBI数据库中用Blast进行同源性比对,取同源性较高的序列以及同属不同种菌株的16SrRNA序列,用MEGA3.1中的Neighbor-Joing(NJ)法构建系统发育树,进行遗传进化分析。
1.2.4 药物敏感性及耐药基因检测 药敏性试验,即采用世界卫生组织(WHO)推荐的Kirby-Bauer法,进行3个重复,测抑菌圈直径,取平均值。依据临床实验室标准化协会(CLSI)的抗菌药物敏感性试验标准,判定分离菌株对药物的敏感性。
耐药基因检测,即以分离菌的基因组DNA为模板,PCR检测氨基糖苷类、四环素类、青霉素类、头孢菌素类、氯霉素类、大环内脂类、喹诺酮类及磺胺类药物耐药基因的共8大类22种耐药基因的存在情况。
1.2.5 生物膜测定 根据 Beenken K E等[5]的微孔板半定量法并稍加改进。将单菌落接种新鲜MH培养基中培养至于OD 600达0.8,将菌液与MHB以1∶100的比例混合后接入96孔细胞培养板中,每孔200μL,平行接种6个孔,以相同条件下的无菌MHB培养基作为阴性对照,37℃静置培养24h后,去除培养液,PBS洗涤3遍,室温风干后加入200μL 1g/L结晶紫染色10min,弃去染色液,PBS洗涤3遍,每孔加入200μL 330g/L乙酸,完全溶解后酶标仪测定650nm波长下吸光值。计算阴性对照菌株的平均光密度(OD 650)、标准差(SD),并参考文献[6]对界定值的描述以及Stepanovic S等[7]的划分标准,以空白对照的OD 650+3s值为临界值来衡量生物膜的形成量。
1.2.6 icaA基因检测 参考文献[8]报道合成icaA基因检测引物检测分离株icaA基因的存在情况。
1.2.7 小鼠致病性试验 将昆明小鼠随机分2组,每组3只,试验组通过腹腔接种分离菌株24h纯培养液,0.3mL/只,对照组接种等量的无菌生理盐水,连续观察7d,记录小鼠感染发病情况,分析分离菌株的致病性。
2 结果
2.1 分离菌形态及培养特征
将采集到的4份病猪子宫脓液接种于普通琼脂和山羊血平板,37℃需氧或厌氧培养24h后,结果均生长呈灰白色、光滑、湿润、突起的中等圆形菌落,经纯化后获得4株细菌,经涂片、染色、镜检均为G+球菌,呈单个、短链或葡萄串状排列、无芽孢、无荚膜、无鞭毛,不运动,依形态特征初步判定为葡萄球菌(图1)。

图1 分离菌形态特征Fig.1 Morphology of the isolated bacteria strain
2.2 分离菌生化特性鉴定
将各分离菌株的纯化培养物分别进行各种糖、醇发酵试验、V-P试验、血浆凝固酶试验等各种生化指标测定,4株分离菌糖、醇发酵能力及各种生化鉴定结果均与葡萄球菌生化特性基本一致(表1)。
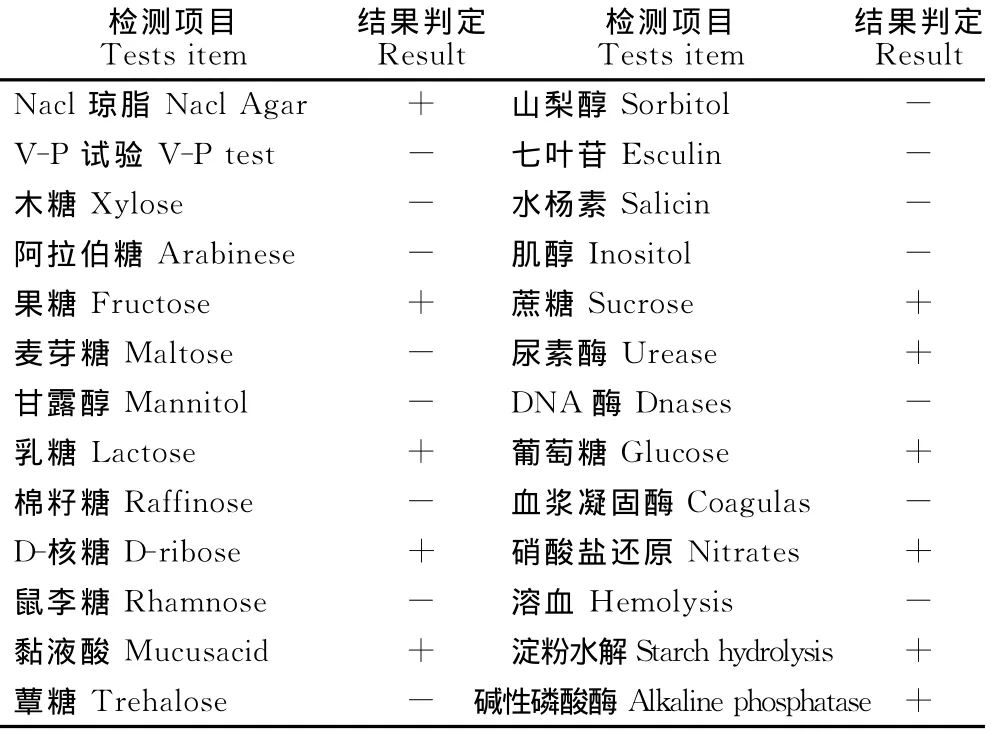
表1 分离株的生理生化特征Table1 Physiological and biochemical characteristics of the isolated bacterial strain
2.3 分离菌16SrRNA基因扩增及序列分析
以分离菌的DNA为模板,采用16SrRNA通用引物进行PCR扩增,获得大小约1.4kb片段(图2)。测序结果证实4株分离菌株核苷酸序列完全一致,经Blast搜索比对,发现与猪葡萄球菌(NR036905.1)同源性最高达99%。进一步将其与GenBank中收录的金色葡萄球菌、表皮葡萄球菌、腐生葡萄球菌、猪葡萄球菌、海豚葡萄球菌、鸡葡萄球菌、中间葡萄球菌、产色葡萄球菌、克氏葡萄球菌、施氏葡萄球菌等菌株的16SrRNA序列进行序列比对,构建系统发育树(图3),发现分离株与猪葡萄球菌(NR036905.1)位于进化树的同一个簇中;结合分离菌株的形态特征及生理生化特性,确定分离株为猪葡萄球菌,并将其命名为S.hyicus strain GXNN。
2.4 分离菌药敏特性及耐药基因测定
分离菌株药敏和耐药基因检测结果见表2。分离菌株对阿米卡星、强力霉素、青霉素、头孢氨苄、替米考星、呋喃妥因等11种药物高度敏感,对庆大霉素、左氟沙星、氟苯尼考、泰乐菌素、氧氟沙星、万古霉素6种药物中敏,对链霉素、四环素、氯霉素、诺氟沙星、磺胺二甲嘧啶、林可霉素、呋喃唑酮等12种药物完全耐药。以PCR方法对分离株进行8大类22种耐药基因检测,发现GXNN株Aph3-Iia(氨基糖苷类)、cmlA(氯霉素类)、SulI(磺胺类)的检测结果为阳性(图4),与药敏试验结果基本吻合。

图2 16SrRNA基因扩增结果Fig.2 PCR amplified products of 16SrRNA

图3 分离菌16SrRNA基因构建系统发育树Fig.3 Phylogenetic tree of 16SrRNA genes of the isolated bacterial strain

图4 GXNN株耐药基因及icaA基因PCR检测结果Fig.4 PCR detection results of drug resistance genes and icaA gene of tGXNN strain

表2 分离菌株的药敏试验及耐药基因检测结果Table2 Drug sensitivity test and resistance gene detection of the isolated bacterial strain
2.5 生物膜的测定
将分离菌株按照1.2.5方法进行生物膜测定,结果显示,试验组的 OD 650=0.397±0.037,空白对照OD 650=0.139,s=0.033,OD c=OD 650空白对照+3s=0.238,试验组与空白对照组比较差异显著,按照Stepanovic等的判定标准,分离菌株OD 650在1OD c<OD 650<2OD c范围内,证明分离株可形成生物膜,但其形成生物膜的能力较弱。
2.6 IcaA基因检测
以分离菌的DNA为模板,采用icaA引物进行PCR扩增,icaA检测结果为阴性(图4)。
2.7 小鼠致病性试验
将4株分离菌株混合后经腹腔注射小鼠,观察7d,试验组小鼠全部健活,并且无明显的临床症状,剖检组织器官也无明显的病变。将小鼠子宫腔液无菌接种于鲜血培养基,分离不到接种病原菌特征一致的菌株。说明该分离菌正常条件下不感染小鼠,为条件性致病菌。
3 讨论
猪葡萄球菌被Sompolinsky描述为凝固酶阴性微球菌,目前已被确认为葡萄球菌属的一种,常在渗出性皮炎病猪上分离到[9],而在引起猪子宫内膜炎的葡萄球菌属中,其分离率不高。本研究采用山羊血琼脂平板对所采集的子宫脓液进行病原分离培养,通过培养特性、形态特征观察,结合生化鉴定试验,可以初步判定所分离的细菌为凝固酶阴性猪葡萄球菌。16SrRNA基因保守区序列与细菌基因组的变化有高度的保守性,近年来一直被作为细菌鉴定、分类的金标准[10]。本研究在对分离菌进行初步鉴定的基础上,进一步对其16SrRNA保守区域进行序列分析,结果显示该序列与已发表的猪葡萄球菌株(NR036905.1)的同源性高达99%以上,且系统进化树中也位于同一分支上,从而证实GXNN分离株为猪葡萄球菌。从攻毒试验结果看,小鼠对猪葡萄球菌不敏感,该菌在正常条件下不致病,属于条件性致病菌,而本研究在不同病猪样品中均分离出同一菌株,可以初步判断该菌是引起该猪场母猪患病的主要元凶之一,提示着凝固酶阴性葡萄球菌在引起子宫内膜炎感染的发生过程中起到重要作用。
传统观点认为,一般只有凝固酶阳性葡萄球菌对动物有致病性。凝固酶阴性葡萄球菌(CNS)常被认为致病性不强而被忽视,但近年来CNS引起的感染有上升趋势,且耐药性也逐年增加,关于其耐药性问题也越来越引起人们的关注。耐药性的产生与抗生素的不恰当使用有很大的关系。从本试验药敏检测结果看,分离菌对临床上常用的青霉素和头孢菌素依然具有较好的敏感性外,对磺胺类、喹诺酮类、林可霉素和多黏菌素类药物产生了极强的耐药性,对氨基糖苷类、四环素类、氯霉素类和大环内酯类也产生了不同程度的耐药性,值得注意的是该菌株对目前抑制CNS最有效的万古霉素也只是中度敏感。耐药基因检测发现分离菌携带有氨基糖苷类、磺胺类、氯霉素类的耐药基因,是一株多重耐药菌株,应引起高度重视。虽然凝固酶阴性葡萄球菌为低毒力条件致病菌,但它可在动物体内长期存在,一但受到各种抗生素长期诱导,或是其他携带耐药基因的细菌通过质粒、转座子和整合子等将耐药基因转移过来整合到自身的基因组中,更容易形成“超级耐药菌株”;另一方面它可作为耐药基因的存储库将耐药基因转移给致病性强的金黄色葡萄球菌等其他细菌,给临床诊断和治疗带来更大的困难,同时它还可通过猪与人类的接触而造成人类感染。因此有条件的猪场应进行药敏及耐药基因的监测,根据药敏试验结果及时调整用药。
细菌生物膜的形成被认为是细菌耐药性增强的原因之一,生物膜还可作为毒力因素对CNS的致病性进行评价。有研究表明,细菌处在有生物膜状态对抗菌药物的抗性可提高100倍~1000倍。并能逃避宿主免疫系统的监控,使感染呈现持续性和反复性。本试验分离株耐药性强也可能与其形成的生物膜有关。虽然该分离菌株能形成生物膜,但成膜能力不是很强,这可能与细菌的培养条件有关,因为培养的时间、温度、营养和材料等都会对生物膜的形成造成影响[11]。IcaA基因被认为是葡萄球菌生物膜形成所必须的,其编码的胞外多糖PIA在细菌的初始黏附过程中起着非常重要的作用。因此,一般认为可以通过检测icaA基因的存在预测菌膜的形成[12]。本分离菌株没有检测到icaA基因的存在,但仍然表现出一定的生物膜形成能力,是否暗示着凝固酶阴性葡萄球菌还有独立于icaA以外的其他菌膜形成机制,值得更深入的研究。
[1]沈永恕,唐光武.规模化猪场母猪子宫内膜炎的综合防治措施[J].上海畜牧兽医通讯,2007(6):04-105.
[2]叶健毅,赵学峰,陶家树,等.母猪子宫内膜炎致病菌药敏试验及临床治疗[J].动物医学进展,2010,31(12):172-176.
[3]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:248-254.
[4]马 玲,谭义俊,邵 帅,等.可形成生物膜的禽源产色葡萄球菌的分离鉴定及耐药性研究[J].西南农业学报,2012,25(2):703-707.
[5]Beenken K E,Blevins J S,Smeltzer M S.Mutation of sarA in Staphylococcusaureuslimits biofilm formation[J].Infect Immu,2003,71(7):4206-4211.
[6]Christensen G D,Simpson W,Younger J,et al.Adherence of coagulase-negative staphylococci to plastic tissue culture plates:aquantitative model for the adherence of staphylococci to medical devices[J].J Clin Microbiol,1985,22(6):996-1006.
[7]Stepanovic S,Vukovic D,Dakic I,et al.A modified microtiter-plate test for quantification of staphylococcal biofilm formation[J].J Microbiol Meth,2000,40(2):175-179.
[8]Valle J,Toledo Arana A,Berasain C,et al.SarA and notσB is essential for biofilm development by Staphylococcus aureus[J].Mol Microbiol,2003,48(4):1075-1087.
[9]邓雨修,杨明柳,杜云平,等.一株猪葡萄球菌的分离鉴定[J].动物医学进展,2009,30(10):62-65.
[10]Hooper S J,Crean S J,Fardy M J,et al.A molecular analysis of the bacteria present within oral squamous cell carcinoma[J].J Med Microbiol,2007,56(12):1651-1659.
[11]李琼琼,胡 瑜,姚晓敏,等.金黄色葡萄球菌分离株的菌膜测定及其影响因素[J].上海交通大学学报:农业科学版,2011(3):013.
[12]Klug D,Wallet F,Kacet S,et al.Involvement of adherence and adhesion Staphylococcus epidermidis genes in pacemaker lead-associated infections[J].J Clin Microbiol,2003,41(7):3348-3350.
