脯氨酰脯氨酸二肽的液相合成及表征
2014-06-27李运涛范娇娇邓李慧
李运涛, 范娇娇, 沈 文, 王 凡, 邓李慧
(1.陕西科技大学 化学与化工学院, 陕西 西安 710021; 2.陕西科技大学 生命科学与工程学院, 陕西 西安 710021; 3.东华大学 纤维改性国家重点实验室, 上海 201620)
0 引言
目前关于氨基酸二肽合成方法报道的主要有活泼酯法[4]、酰氯法[5]、混合酸酐法[6]、缩合剂法[7,8].缩合剂法具有操作简单、反应速率高、反应速度快等优点,本实验采用缩合剂法在液相中合成脯氨酰脯氨酸二肽,其合成方案如图1所示.本文通过正交试验探讨了合成中关键步骤Ⅲ的最佳反应条件,对产物进行了IR、1H NMR表征,通过熔点测定、热重分析研究了产物的热稳定性能.

Ⅰ.氨基保护 Ⅱ.羧基保护 Ⅲ.肽键生成 Ⅳ.脱去羧基保护基 Ⅴ.脱去氨基保护基图1 脯氨酰脯氨酸二肽合成路线图
1 实验部分
1.1 实验试剂及仪器
试剂:脯氨酸(分析纯)、N-羟基苯并三氮唑(HOBT,分析纯)、三氟乙酸(TFA,化学纯)、二碳酸二叔丁酯((Boc)2O,分析纯)、二环己基碳二亚胺(DCC,优级纯),二氯甲烷(DCM,分析纯),其他试剂均为分析纯.
仪器:VETER70型傅里叶红外光谱仪(德国PE公司);ADVANCEⅢ 400 MHz核磁共振波谱仪(德国Bruker公司);TGA Q500热重分析仪(美国TA公司);SHZ-III真空泵(上海亚荣生化仪器厂);RE-5203旋转蒸发仪(上海亚荣生化仪器厂);WRS-数字熔点仪(上海精密数字仪器厂).
1.2 合成步骤
1.2.1 N-叔丁氧羰基脯氨酸的合成
于250 mL三口烧瓶中依次加入90 mL 5%的NaOH溶液、90 mL 1.2 mol·L-1(Boc)2O的二氧六环溶液、11.5 g脯氨酸,室温下搅拌反应8 h,用薄层色谱(TLC)检测反应完全.减压蒸馏除去溶剂,残留物用蒸馏水稀释.稀释液在冰水浴条件下用2 mol· L-1盐酸调至pH=3,分别用50 mL乙酸乙酯萃取3次,合并萃取液,用无水CaCl2干燥,减压蒸馏至溶剂完全蒸干,得到白色晶体.
1.2.2 脯氨酸甲酯盐酸盐的合成
Nemati A, Wang Q, Hong M H, Teng J H. Tunable and reconfigurable metasurfaces and metadevices. Opto-Electronic Advances1, 180009 (2018).
于250 mL三口烧瓶中加入100 mL无水甲醇,开动搅拌,冰盐浴(-5 ℃~-10 ℃)下,逐滴加入7.2 mL二氯亚砜,低温反应30 min;分批加入11.5 g脯氨酸,低温反应2 h.自然升至室温继续反应8 h,TLC监测反应完全.减压蒸馏除去溶剂,得到白色晶体.
1.2.3 N-叔丁氧羰基脯氨酰脯氨酸甲酯的合成
于250 mL三口烧瓶中加入50 mL一定浓度的脯氨酸甲酯盐酸盐(H-Pro-OMe·HCl)溶液,加入三乙胺调溶液至碱性,备用.于另一250 mL三口烧瓶加入50 mL等浓度的N-叔丁氧羰基脯氨酸溶液,冰水浴条件下加入一定量的催化剂及等量的DCC溶液,搅拌30 min后,将两种溶液混合.搅拌反应一定时间,TLC监测反应完全.反应完成后,过滤除去白色沉淀,滤液减压蒸馏,将浓缩液溶于乙酸乙酯后再次抽滤.滤液依次用0.1 mol·L-1盐酸、饱和NaHCO3溶液、饱和NaCl溶液各40 mL洗涤3次,用无水CaCl2干燥,减压蒸除溶剂得到淡黄色油状物.
1.2.4 N-叔丁氧羰基脯氨酰脯氨酸的合成
将4.34 g N-叔丁氧羰基脯氨酰脯氨酸甲酯溶于50 mL甲醇中,冰水浴条件下滴加20 mL10% NaOH溶液,搅拌反应2 h.用2 mol·L-1盐酸调pH=8,减压蒸馏除去溶剂,残留物溶于水.水相在冰水浴条件下酸化至pH=3,溶液分别用50 mL乙酸乙酯萃取3次,合并萃取液,依次用蒸馏水、10%的柠檬酸溶液以及饱和NaCl溶液各40 mL洗涤3次,有机层用无水CaCl2干燥,过滤,减压蒸馏除去溶剂,得到白色油状物.
1.2.5 脯氨酰脯氨酸二肽的合成
将1.96 g N-叔丁氧羰基脯氨酰脯氨酸溶于20 mL含50%TFA的二氯甲烷溶液中,室温搅拌30 min.减压蒸馏除去溶剂,残留物溶于20 mL水,分别用10 mL乙醚萃取水溶液中杂质2次,水相用三乙胺调至pH=5,放置冰箱中24 h,析出白色针状物,过滤、干燥,得目标产物.
1.3 实验条件优化
Ⅲ(肽键形成)采用正交试验设计确定最佳反应条件,正交试验选定5个影响因素[9]:A.温度、B.时间、C.投料比(H-Pro-OMe·HCl与DCC的摩尔数之比)、D.催化剂、E.溶剂,试验中考察的各因素水平见表1.其中D、E为两水平,其它各因素为四水平.为此,采用L16(44×23)混合水平正交表,其中前四列为四水平,后三列为二水平,根据表头设计原则[10],做出各因素的安排(见表2),进行16次试验,得出结果.

表1 因素水平表
1.4 产物表征
1.4.1 IR表征
分别对脯氨酸原料及目标产物进行红外光谱表征(KBr压片法),对波数在2 500~500 cm-1范围内的两种化合物的红外光谱图进行比较,分析考察各基团的特征频率.
1.4.21H NMR表征
对目标产物进行核磁共振氢谱表征,分析化合物的结构组成.
1.4.3 熔点测定
测定产物的熔点,考察产物纯度.
1.4.4 TG测试
对产物进行热重分析,测试条件:N2保护,温度范围30 ℃~550 ℃,升温速率10 ℃/min.考察产物的热稳定性及热分解温度.
2 结果与讨论
2.1 正交试验结果分析
表2为正交试验结果,由表2可得出试验在A4B4C3D2E1组合条件下产率最高,即反应温度30 ℃,反应时间20 h,投料摩尔比为1∶1.2, 催化剂为HOBT,溶剂为THF.当反应温度过低或过高,反应时间过短,DCC用量过低时,产率较低.这可能是因为反应为可逆反应,低温不利于反应正向进行,而温度过高会导致使反应物不稳定;缩合剂的量过低时使缩合物反应不完全.

表2 正交试验结果
续表2
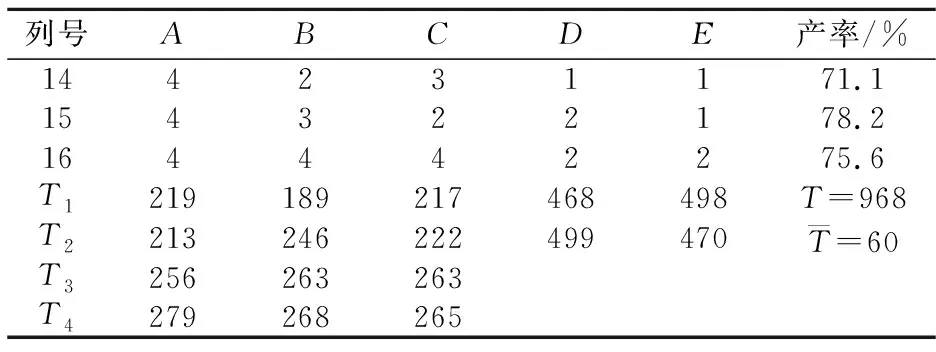
列号ABCDE产率/%144231171.1154322178.2164442275.6T1219189217468498T=968T2213246222499470T=60T3256263263T4279268265
表3为正交试验方差分析表,考察了各因素对试验的显著性影响.在显著水平α=0.1时,F0.9(3,4)=4.19,F0.9(1,4)=4.54,FA>4.19,FB>4.19,可知因素A、B对产率有显著性影响,其它各因素对产率影响不明显.因此,从简单、经济、安全等方面综合考虑,选定A4B4C3D2E2组合,即反应温度为30 ℃,反应时间为20h,投料比为1∶1.2,催化剂为HOBT,溶剂为DCM.按照选定的试验条件进行三组平行试验,平均产率达78%.

表3 方差分析表
2.2 产物结构表征
2.2.1 IR分析
图2为脯氨酸(曲线1)和Pro-Pro(曲线2)的红外光谱图,从图中可看出,曲线1在1 675 cm-1处有强吸收峰,归属于C=O伸缩振动,在1 378 cm-1处吸收峰归属于C-O伸缩振动,在1 198~1 127 cm-1范围内吸收峰为碳骨架的伸缩振动.曲线2在1 750 cm-1处的吸收峰归属于羧酸中C=O的伸缩振动,1 689 cm-1处吸收峰归属于酰胺中C=O伸缩振动,1 397 cm-1处为典型的酰胺中C-N的伸缩振动,比较发现化合物中吸收峰均向高波数移动[11],表明Pro-Pro中四氢吡咯环具有较大张力,使环外化学键振动加强. 通过比较分析,证明了产物中酰胺键的存在.

图2 脯氨酸和Pro-Pro的红外光谱图
2.2.21H NMR分析
图3为Pro-Pro的1H NMR谱图,从图3可看出,δ=7.29处应为结构式中15位置上-OH质子峰,由于羧酸中两个O的屏蔽作用较强,使得质子峰产生于低场;δ=3.35处应为-NH中的质子峰,因为Pro-Pro中仅存在一个-NH基团,导致峰强度较弱;δ=3.13~3.07处属于结构式中2、6位置上-CH2的质子峰;δ=1.44~1.31应为结构式中1、3、5、7位置上-CH2的质子峰;δ=3.13~3.07与δ=1.44~1.31两处峰面积比为1.25∶2.01,与理论个数1∶2接近.

图3 Pro-Pro的1H NMR及结构式
2.3 热稳定性分析
2.3.1 产物熔点
经熔点仪测定,N-叔丁氧羰基脯氨酸的熔点为134 ℃~136 ℃,脯氨酸甲酯盐酸盐的熔点为68 ℃~69 ℃ ,Pro-Pro的熔点为178 ℃~180 ℃,与已有的文献报道一致[12-14].产物的熔程在2 ℃ 范围以内,说明产物纯度较高.
2.3.2 TG-DTG曲线
图4为Pro-Pro的热重及微商热重曲线,由图4可看出,Pro-Pro在155 ℃时重量开始下降,此时可能为氨基脱落所致;在171 ℃~262 ℃之间,产物失重明显,最大失重温度为206 ℃,最大失重速率达2.2%/℃.当温度高于230 ℃时Pro-Pro已经完全分解.表明Pro-Pro最高使用温度为155 ℃.

图4 Pro-Pro的热重及微商热重曲线
3 结论
(1)通过实验优化了工艺条件,脯氨酰脯氨酸二肽中肽键生成的最佳条件:反应温度为30 ℃,反应时间为20 h,投料量的摩尔比为1∶1.2, 催化剂为HOBT,溶剂为DCM,产率达78%.
(2)通过IR、1H NMR分析,证明成功合成了脯氨酰脯氨酸二肽;TG-DTG分析表明脯氨酰脯氨酸二肽最高使用温度达155 ℃.在作为Aldol反应中的催化剂方面有良好的应用前景.
[1] 张志良,瞿伟箐.植物生理学试验指导[M].3版.北京:高等教育出版社,2003:258-260.
[2] Serda K,Aysen E.Conformational analysis and vibrational spectroscopic investigation of L-proline-tyrosine(L-Pro-Tyr) dipeptide[J].Journal of Molecular Structure,2011,993(1):349-356.
[3] 骆建轻,谭 蓉,孔 瑜,等.助剂对L-脯氨酸催化直接不对称Aldol反应的影响[J].催化学报,2012,33(7):1 133-1 138.
[4] 张晓晓,黄龙江,滕大为,等.光活环二肽环(L-脯-L-丙)和环(L-脯-L-缬)的合成[J].化学与生物工程,2013,30(3):61-63.
[5] 刘志磊,胡继文.氨基酸酰胺类化合物的简便合成[J].合成化学,2013,21(5):619-622.
[6] 赵湘萌,王文智,张丽娟,等.N-(4-羟基-L-脯氨酰基)-L-丝氨酸的合成[J].精细化工中间体,2012,42(2):36-37.
[7] 陈美玲,于世钧,张树彪,等.甘氨酸二肽合成中缩合剂的选择[J].化学世界,2013,54(9):538-541,556.
[8] 冯艳芳.氨基酸保护及肽键合成的研究[D].太原:山西大学,2011.
[9] Bandur N G,Harms K,Koert U.First steroselective synthesis of a pro-pro E-alkene dipeptide isostere[J].Synlett,2005(5):773-776.
[10] 张成军.试验设计与数据处理[M].北京:化学工业出版社,2009.
[11] 谢 晶,常俊彪,王旭明.红外光谱在有机化学和药物化学中的应用[M].北京:科学出版社,2001.
[12] 高军龙.脯氨酸二肽类手性催化剂的合成、固载及应用研究[D].吉林:吉林大学,2009.
[13] Englund E A,Gopi H N,Appella D H. An Efficient synthesis of a probe for protein function:2,3-Diaminopropionic Acid with orthogonal protecting groups[J].Org Lett,2004,6:213-215.
[14] Zanardi F,Sartori A.Diastereoselective synthesis of 4,5-bis-proline compounds via reductive dimerization of N-acyloxyiminium ions[J].J Org Chem,2007,72(5):1 814-1 817.
