水解胶原蛋白乳化性和乳化稳定性研究
2014-06-27张素风王学川郝晓丽强涛涛
张素风, 王 群, 王学川, 郝晓丽, 强涛涛
(1.陕西科技大学 轻工与能源学院 陕西省造纸技术及特种纸品开发重点实验室, 陕西 西安 710021; 2.陕西科技大学 资源与环境学院, 陕西 西安 710021)
0 引言
我国是制革大国,每年产生约140万吨的皮革废弃物,大部分是皮边角余料,这些废弃物中含有80%以上的胶原蛋白[1].针对制革废弃物的利用,国内外学者做了许多研究.主要有以下几个方面:(1)填埋处理[2],该法会污染土地,处理成本较高;(2)热解或焚烧处理[3-6],该方法可以得到燃气、油和碳质残渣,但也会产生二次污染;(3)作为肥料和饲料[7],该方法只局限于不含铬的废弃物.显然上述处理方式不会是其最终的处理方式.制革废弃物经过常规方法[8]如酶法、酸法、碱法、氧化法等得到的水解胶原蛋白,由于水解胶原蛋白分子链上含有氨基、羧基、酰胺基等活性基团,一般采用乳液聚合的方式对其进行改性利用[9-12].胶原蛋白在乳液聚合中可以作单体,同时也可以是乳化剂.而乳化剂对乳液聚合性能有重要的影响.乳化是一种液体以极微小液滴均匀地分散在互不相溶的另一种液体中形成的具有相当稳定性的多相分散体系的过程[13,14],蛋白质乳化性是指蛋白质能使油与水形成稳定的乳化液而起乳化剂的作用.测定乳化能力和乳化稳定性的方法有很多[15],如离心法、分光光度法、电导法等.但测定时使用的仪器大多均为高速均质机,大量文献中转速和时间都无据可循,没有选取该条件的原因.
本文采用分光光度法,利用高速搅拌机进行乳化实验,首先探究了转速和时间对乳化性的影响.然后选择合适的转速和时间,并在此条件下考察了pH、电解质(NaCl)浓度、水解胶原蛋白浓度和水解胶原蛋白的分子量等因素对水解胶原蛋白乳化性及乳化稳定性的影响.
1 实验部分
1.1 实验原料
胶原蛋白(分子量2 000、5 000、7 000、10 000、50 000、100 000、150 000、200 000,河北某公司提供);鲁花花生油(襄阳鲁花浓香花生油有限公司);十二烷基磺酸钠(AR,上海化学试剂公司).
1.2 实验仪器
高速搅拌机(MAX-E1100,上海沐轩实业有限公司);可见分光光度计(722N,上海精科仪器有限公司);多参数分析仪(DNZ-708,上海仪电科学仪器股份有限公司).
1.3 分光光度法测定乳化活性能(EA)和乳化稳定性指数(ESI)
参考文献[16,17]中的方法测定乳化活性及乳化稳定性.取一定体积浓度为1%的水解胶原蛋白溶液,加入同体积的大豆色拉油,以一定的速度高速搅拌一定的时间,之后分别在0 min、10 min取样,以0.1%(w/v)SDS(十二烷基磺酸钠,pH7.0)稀释100倍,以SDS溶液为空白,测定500 nm处的吸光度值,以0 min的吸光度值(A0)表示EA,乳化稳定性用ESI表示:
式中:A0为0时刻的吸光值;ΔT为时间差(min);ΔA为ΔT内的吸光值差.
2 结果与讨论
2.1 转速对乳化性及乳化稳定性的影响
以分子量为7 000的水解胶原蛋白为原料,设定转速分别是500、1 000、1 500、2 000、2 500、3 000、3 500 r/min,乳化时间20 min条件下,测定转速对乳化性能的影响,结果见图1.
由图1可以看出,转速对胶原蛋白的乳化性及乳化稳定性的影响比较大.2 000转以前,随着转速的增加,乳化性呈增长趋势,这是因为随着转速的增加,油相和水相受到的剪切力变大,使得油滴和水滴直径变小,两种液体均以极微小的液滴均匀地分散在彼此中,油和水的分散效果越来越好.随着转速的继续增加,乳化稳定性先提高后降低,在2 000 r/min时,存在最佳稳定性ESI点.在转速很低时,乳化稳定性也较低,是由于搅拌速度过低,油相与水相达不到充分混合的目的.当搅拌速度超过2 000 r/min时,乳化稳定性降低,这是因为转速过高,将气泡带入体系,使之成为三相体系,而使乳状液不稳定[18,19].后续研究均确定转速为2 000 r/min.

图1 转速对乳化性及乳化稳定性的影响
2.2 乳化时间对乳化性和乳化稳定性的影响
在转速为2 000 r/min条件下,考察乳化时间对乳化性和乳化稳定性的影响.分别设定乳化时间为10、20、30、40、50、60/min,测定乳化性及乳化稳定性,结果见图2.

图2 乳化时间对乳化性和乳化稳定性的影响
由图2可以看出,乳化稳定性和乳化活性成反比,随着乳化时间的增加,乳化活性先降低,后有缓慢增加趋势,最终趋于稳定.乳化稳定性先增加,后减小,最后也是逐渐趋于稳定.造成该趋势的原因是,在乳化时间较短时,由于油相与水相达不到充分混合,此时活性较高,乳化稳定性较低.随着时间的增加,当乳化时间为20 min时,油相与水相恰好可以充分混合,此时乳化稳定性最高,乳化活性最低.随着时间的继续增加,气泡更多进入油相与水相充分混合体系,使得乳化稳定性降低.
图1和2的结果表明,进行乳化实验时,并不一定要利用高速均质机,利用高速搅拌器也可以做乳化实验,但实验条件要进行探究.
2.3 电解质的浓度对胶原蛋白乳化性的影响
将一定量的水解胶原蛋白溶解在不同浓度的NaCl溶液中,其中水解胶原蛋白的浓度为1%,测定乳化性及乳化稳定性,观察NaCl浓度对蛋白乳化性和乳化稳定性的影响,结果见图3.

图3 NaCl浓度对乳化性及乳化稳定性的影响
由图3可以看出,当NaCl浓度低于4%时,乳化性及乳化稳定性均随着NaCl浓度的升高而增加,乳化性在NaCl浓度为4%时达到最大值,此后,随着NaCl浓度的继续增加,乳化性开始下降.而乳化稳定性在5%达到最大值后才开始明显下降.分析上述结果的原因有以下几个方面:一方面其浓度增加会降低胶原蛋白分子间的斥力,有利于胶原蛋白的溶解,使油滴更容易与胶原蛋白结合,从而提高其乳化性;另一方面,随着浓度增加,盐离子将压缩扩散的双电层厚度,乳状液滴表面电位降低,导致乳状液体系的斥力能垒下降,液滴之间易产生聚集,引起乳化性的降低[14].在浓度较低范围内,前者起主要作用,随着浓度增加,后一种作用优势更为明显,故胶原蛋白乳化性又随着浓度升高而降低.因此,一定范围内的盐浓度增加有利于减少蛋白之间的排斥力,提高其乳化性;但当浓度超过一定范围时,蛋白出现凝聚而使其乳化性降低.
2.4 胶原蛋白的浓度对胶原蛋白乳化性的影响
不调节pH,蛋白浓度分别为1%、2% 、3% 、4%、5%、6%(w/v)下,考察不同浓度胶原蛋白对其乳化性和乳化稳定性的影响,结果见图4.
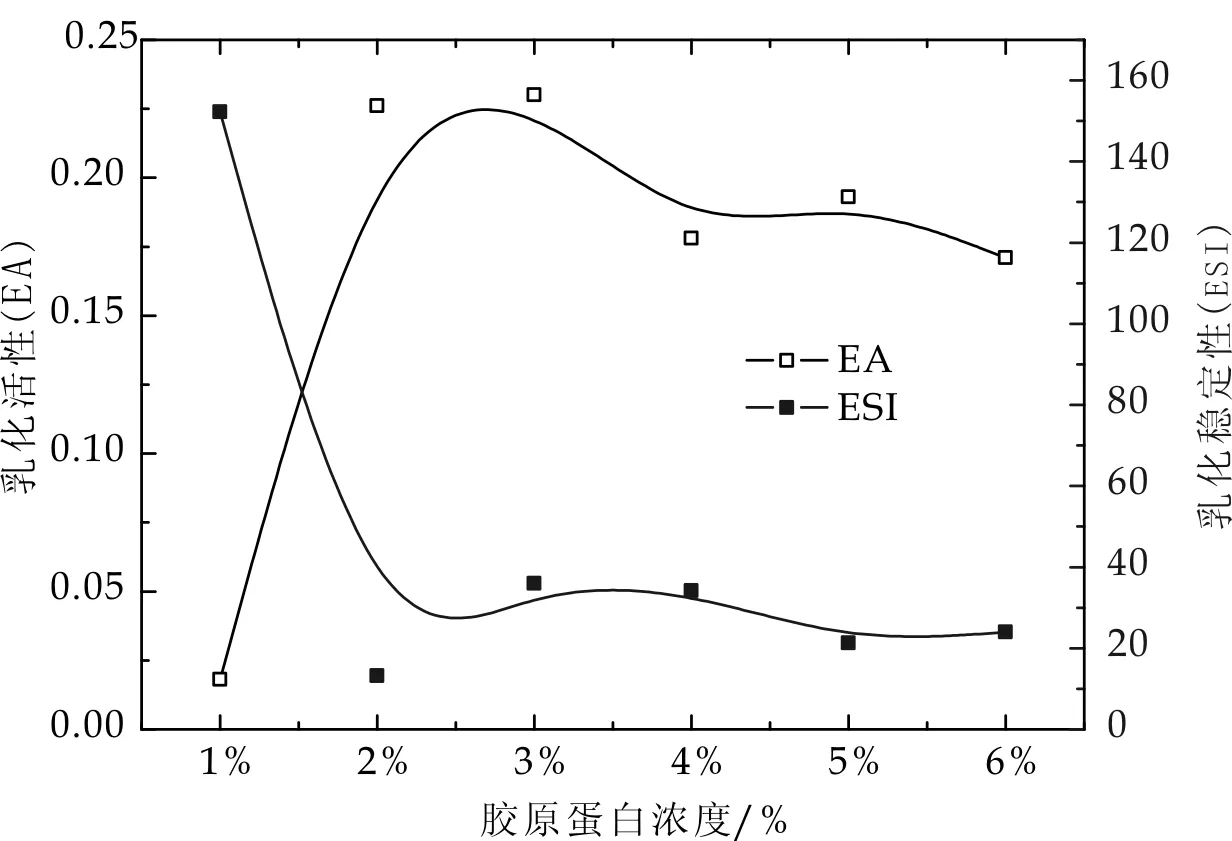
图4 胶原蛋白的浓度对胶原蛋白乳化性的影响
由图4可以看出,随着胶原蛋白浓度的增加,乳化性先增加后缓慢降低,乳化稳定性则是先降低后随胶原蛋白浓度增加变化很小,趋于稳定.在1%~2%浓度范围内,其增加幅度很快,其后随着浓度的增加,其乳化性有所降低,最后大致趋于稳定,浓度在2%~3%时达到最大值.这是由于随着浓度的增加,胶原蛋白在界面上分级吸附造成的.在较低浓度范围内,随着浓度增加,胶原蛋白彼此吸附趋势越来越大.随着其浓度进一步增加,吸附层逐渐形成更加紧密的、具有一定厚度和强度的界面膜,而当浓度超过一定值时,即使再增加浓度,结合油的量变化也不明显,即膜厚度和强度增加幅度减小,乳化性保持稳定.
2.5 胶原蛋白的分子量对胶原蛋白乳化性的影响
选取不同分子量的胶原蛋白,其它条件不变,考察不同分子量的胶原蛋白对其乳化性和乳化稳定性的影响,结果见图5和图6.

图5 胶原蛋白的分子量对胶原蛋白乳化性的影响

图6 胶原蛋白的分子量对胶原蛋白乳化性的影响
由图5和图6可以看出,不同分子量胶原蛋白对其乳化性和乳化稳定性的影响很大,水解胶原蛋白的分子量在10 000以下时,乳化性及乳化稳定性的变化是一致的,当其分子量在10 000以上时,乳化性和乳化稳定性的变化相反.并且分子量低于10 000的胶原蛋白的乳化性和乳化稳定性明显要优于分子量高于10 000的胶原蛋白.其原因可能是因为分子量较低时,水解胶原蛋白暴露在外面的活性基团较多,从而乳化性和乳化稳定性较高,但分子量很低时,胶原蛋白的肽链被破坏,结构受到损坏,所以乳化性和乳化稳定性较低.当分子量为7 000时恰好能保持肽链完整,而且活性基团也大部分暴露出来,所以乳化性和乳化稳定性较高.
2.6 不同pH对水解胶原蛋白乳化性的影响
利用醋酸和氢氧化钠调节水溶液的pH,将胶原蛋白溶解于不同pH的水溶液,其它条件不变,考察不同pH对水解胶原蛋白乳化性的影响,实验结果见图7.

图7 pH对胶原蛋白乳化性的影响
由图7可以看出,pH对胶原蛋白乳化性和乳化稳定性影响较大,乳化性和乳化稳定性变化趋势不同,乳化性先升高,在pH为6时得到最大值,然后下降.乳化稳定性先保持不变,当pH为碱性时,迅速上升.这是由于胶原蛋白是十分典型的两性聚电解质,由于侧链酸性和碱性等基团的存在,在溶液中,将电离为大分子离子和抗衡离子,使得胶原蛋白所带净电荷可以随环境pH变化而变化,在不同pH条件下,有不同的状态[20].该分子量7 000的胶原蛋白的等电点经测定为4.14,水溶液显酸性.在酸性条件下,其乳化活性先降低,当溶液pH为4时最低,此时pH距离其等电点最近,胶原蛋白的溶解度较低,所以相对的乳化活性较低.随着pH的继续增加,离等电点越远,胶原蛋白所带静电荷越高,电荷互相排斥,分子分散性好,乳化性就越好.当pH为碱性时,胶原蛋白的乳化性开始下降,其原因可能是胶原蛋白的空间结构遭到破坏,或降解成小分子所引起.当pH为酸性时,其稳定性基本保持不变,胶原蛋白的水溶液显酸性,酸性条件下胶原蛋白分子间一直是斥力主导,分散得较好,乳化稳定性不变,但当pH为碱性时,胶原蛋白的空间结构遭到破坏或降解成小分子,乳化稳定性增加.
3 结论
(1)采用高速搅拌器进行乳化实验时,转速为2 000 r/min,乳化时间为20 min时胶原蛋白的乳化性和乳化稳定性较好.
(2)胶原蛋白乳化性与其浓度、电解质、分子量等因素密切相关.乳化性开始随蛋白浓度增大而增加,之后稍微有所降低,最后趋于稳定.在远离胶原蛋白等电点时,胶原蛋白表现出良好的乳化性;接近等电点,在pH为4时,乳化性最差.NaCl浓度也影响胶原蛋白的乳化性,在较低NaCl浓度范围内,NaCl的加入对乳化性有促进作用,而过高的浓度,则使乳化性降低.较低分子量的水解胶原蛋白的乳化性和乳化稳定性明显要优于分子量较高的,但水解胶原蛋白的分子量也不是越低越好.
(3)胶原蛋白乳化稳定性的变化较复杂,影响因素也较多,大多数情况下乳化性较差,乳化稳定性较好,反之亦然.因此,要同时综合考虑胶原蛋白乳化性与乳化稳定性的变化,来获得最佳的改性效果.
[1] 彭立新,王志杰.胶原蛋白的提取及在造纸中的应用[J].中国皮革,2007,36(5):49-51.
[2] B.Wang,W.Lin,C.H.Ma,et al.Recovery of leather waste materials-basis,present and future situation of utilization of collagen[J].Leather Chem.,2001,18:10-14.
[3] J.M.Tinjum,C.H.Bensonb,T.B.Edilb.Mobilization of Cr (VI) from chromites ore processing residue through acid treatment [J].Sci.Total Environ,2008,391:13-25.
[4] O.Yilmaz,I.CemKantarli,M.Yuksel,et al.Conversion of leather wastes to useful products[J].Resour.Conserv.Recycle.,2007,49:436-448.
[5] J.S.Piccin,C.S.Gomes,L.A.Feris,et al.Kinetics and isotherms of leather dye adsorption by tannery solid waste[J].Chemical Engineering Journal,2012,183:30-38.
[6] I.C.Kantarli,J.Yanik.Activated carbon from leather shaving wastes and its application in removal of toxic materials[J].Hazard.Mater.,2010,179:348-356.
[7] E.E.Konrad,D.D.Castilhos.Soil chemical changes and corn growth as affected by the addition of tannery sludge′s[J].R.Bras.Ci.Solo,2002,26:257-265.
[8] 王远亮.铬鞣废皮屑的脱铬方法[J].中国皮革,1990,19(10):4-8.
[9] 杨 奎,汪建根,张新强.有机硅丙烯酸酯双改性明胶皮革涂饰剂的研制[J].西部皮革,2007,29(6):18-21.
[10] 苏德强,王坤余,陈晓威,等.胶原多肽与丙烯酸类单体接枝共聚反应的研究[J].中国皮革,2009,38(5):21-26.
[11] T.J.Madera-sana,M.J.Aguilar-vega.Production of leather-like composites using chemically modified short leather fibers.I:chemical modification by emulsion polymerization[J].Polymer Composites,2002,23(1):49-60.
[12] C.S.Cantera.Hydrolysis of chrome shavings:application of collagen hydrolyzate and “acr ylic-protein” in post tanning operation[J].Soc.Leather Tech.Chem.,1997,81(5):183-191.
[13] David Julian,Mc Clements.Food emulsions:principles,practice,and techniques[M].Washington:CRC Press,2005.
[14] 梁治齐,宗惠娟,李金华.功能性表面活性剂[M].北京:中国轻工业出版社,2002:113-115.
[15] 郭兴凤,慕运动,阮诗丰.不同测定方法对大豆分离蛋白乳化性测定结果的影响[J].食品研究与开发,2007,28(2):129-131.
[16] 熊远钦.精细化学品配方设计[M].北京:化学工业出版社,2011:102.
[17] 董银卯.化妆品配方设计与生产工艺[M].北京:中国纺织出版社,2007:33-34.
[18] Javier Vioque,Raul Sanchez Vioque,Alfonso Clemente,et al.Partially hydrolyzed rapeseed protein isolates with improved functional[J].Journal of the American Oil Chemists Society,2000,77(4):447-450.
[19] 郭庆启,张 娜,赵新淮.大豆分级蛋白的功能性质评价[J].食品工业科技,2006,27(10):74-79 .
[20] 金 龙,莎丽娜,格日勒图.羊皮胶原蛋白乳化性和乳化稳定性的研究[J].食品工业科技,2011,32(1):65-67.
