合浦珠母贝贝壳珍珠层EDTA可溶性基质蛋白对无定形碳酸钙稳定性的影响
2014-06-26林慧娟谢莉萍王洪钟张贵友麻彩萍张荣庆
林慧娟,方 东,向 量,谢莉萍,王洪钟,张贵友,麻彩萍,张荣庆
(清华大学 生命科学学院,北京 100084)
生物矿化是指生物体通过生物有机物质调控无机矿物,在其体内特定部位有序沉积的过程[1]。常见的生物矿物,如牙齿、骨骼、贝壳等可以强化组织、支撑结构与保护生物体;此外,趋磁细菌体内的磁小体还具有磁力感应和导航的功能[1-2]。生物体通过生物有机质调控生物矿化过程,使生物矿物具有与其多种功能相适应的晶型与晶貌。
作为典型的碳酸钙生物矿物,珍珠具有机械性能优良、结构精细、形成环境温和、生物相容性好等天然矿物和人工合成矿物所不具备的优势。因此,其形成机理一直被生物学家、材料学家等所关注。由于珍珠和贝壳珍珠层均由文石组成,且其晶貌、物质组成相近,对贝壳文石层形成机理的研究是珍珠形成机理研究的重要组成部分。天然碳酸钙矿物相比,贝壳最大的特点是其中含有5%左右的有机大分子[1-2]。因此,对其生物矿化分子机理的研究主要集中在这些有机基质(organic matrix),尤其是基质蛋白(matrix protein)对晶体生长的调控作用上。研究表明,基质蛋白参与了贝壳有机框架形成[3]、诱导碳酸钙结晶并控制晶体形状[4]与类型[5]、调控贝壳矿化过程[6-7]等几乎整个贝壳形成过程。贝壳一般由棱柱层和珍珠层组成,通常认为,棱柱层来源的生物大分子促进方解石的形成而珍珠层来源的生物大分子与文石的形成密切相关[6-11]。因此,贝壳珍珠层来源生物大分子对珍珠的形成具有重要的意义。无定形碳酸钙(amorphous calcium carbonate,ACC)是碳酸钙晶体中溶解度最高、最不稳定的结晶形式。早在20世纪初,人们就在生物体内发现了 ACC[12],但是其分布的有限性和不稳定性阻碍了人们对其的研究。研究表明,ACC可以被视为由 Ca2+和形成稳定碳酸钙晶体过程中的中间形[13],生物体通过精密调控ACC的稳定性来控制其晶型转化过程以及矿化产物的晶型与晶貌。2007年Ma 等[19]在合浦珠母贝间液中发现ACC结合蛋白以来,对ACC晶型转化及其分子调控机制的研究成为了生物矿化领域的研究热点。常温常压下,ACC在体外水溶液中很快发生晶型转化形成稳定晶型。转化过程的迅速性是造成研究ACC晶型转化过程具有难度的主要原因。因此,对ACC晶型转化过程中稳定性及其机理的研究,不仅有助于阐明生物体如何调控 ACC的稳定性,也有助于对ACC的晶型转化进行体外研究。生物体内还存在一些稳定的ACC。对其研究表明,其大多含有Mg2+[20]。体外研究表明,人工合成的ACC可以分别被间液[21]和Mg2+[19]稳定。
虽然珍珠层基质蛋白对于生物矿化具有重要作用,但目前的研究集中在其在无机离子形成稳定晶体过程中的整体作用[6,22-25],对于其在 ACC晶型转化阶段中的作用涉及较少。但鉴于ACC的稳定及晶型转化在生物矿化中的重要性,不难推测,基质蛋白对ACC的稳定及晶型转化具有重要作用,且这种作用很有可能伴随着ACC中Mg2+含量的变化。因此,本研究通过研究合浦珠母贝贝壳珍珠层 EDTA可溶性基质蛋白(ESM),对 ACC晶型转化过程中是否具有稳定ACC的作用,及在此过程中晶体镁钙比的变化,初步探讨了贝壳珍珠层基质蛋白对ACC稳定及晶型转化的作用及其可能的机制,为阐明生物矿化机制及体外合成珍珠提供参考。
1 材料与方法
1.1 材料
1.1.1 实验材料
合浦珠母贝采自广西北海市珍珠总公司珍珠养殖场。
1.1.2 试剂
CaCl2·2H2O购于 Sigma公司;其余化学试剂均为国产分析纯。
1.2 方法
1.2.1 ACC的制备
以去离子水为溶剂分别制备A溶液(20 mmol/L碳酸钠,0.2 mol/L氢氧化钠)和B溶液(20 mmol/L氯化钙),并于4℃冷却6 h以上。将等体积A溶液与B溶液于 4℃混合,并迅速混匀后进行抽滤以除去水分,将反应所得沉淀用丙酮冲洗3次,无水乙醇冲洗3次后,真空晾干24 h。
1.2.2 合浦珠母贝贝壳珍珠层EDTA可溶性基质蛋白的提取
取新鲜珍珠贝壳,用2 mol/LNaOH处理3 d后将棱柱层用机械方法刮除。将珍珠层研磨至粉末状,取10 g溶解于 50 mL 0.5 mol/L EDTA(pH8.0)中,于4℃用力搅拌4 d,离心。将蛋白溶液用2 μm滤膜过滤后于3 kD超滤管中3 900 g,4℃离心浓缩并将溶剂替换为Tris-Cl(pH8.0)。采用BCA法对蛋白浓度进行检测。
1.2.3 ACC体外转化
中的方法[26]并进行了细微调整。将ACC加入到二甘醇(Diethylene glycol,DEG)中(3.95 mg/mL)。将 1.6mLTris-Cl、MgCl2(1 mmol/L)以及20 μ g/mL贝壳珍珠层EDTA可溶性基质蛋白分别加入到 1.24 mLDEG中形成反应溶液。将0.76 mLACC-DEG混合溶液加入到反应溶液中,取不同转化时间的 ACC离心并用乙醇多次分散去除DEG后进行FTIR检测。为了观察贝壳珍珠层EDTA可溶性基质蛋白在反应液中有 Mg2+存在时对 ACC转化的影响,先将 1.36 mLMgCl2(1mmol/L)加入到0.94 mLDEG中,再加入0.76 mLACC-DEG混合溶液,1 h后加入贝壳珍珠层EDTA可溶性基质蛋白(20 μg/mL),同样取不同转化时间的ACC做FTIR检测。上述溶液浓度均为反应体系中的终浓度,MgCl2及蛋白均溶解于Tris-Cl溶液(pH8.0)中。反应在室温环境下进行。
1.2.4 傅立叶变换红外色谱(FTIR)检测
将1.2.3中的ACC样品与KBr混合研磨均匀压片,测定红外光谱。FTIR红外光谱仪系美国 Thermofisher公司的Nicolet 6700傅立叶红外光谱仪,扫描波数为4 000~400 cm–1,扫描32次。
1.2.5 X射线衍射(XRD)光谱检测
将1.2.1中的ACC样品进行XRD检测。测试参数: 步距 2(°/min),2θ角范围 10°~120°。X 射线衍射仪系日本理学公司的D/max 2500立式X射线衍射仪,仪器参数: 40 kV,200 mA,Cu-Kα辐射。
1.2.6 扫描电镜(SEM)及能谱(EDS)检测
将 1.2.3干燥的 ACC样品喷碳镀膜后利用SEM-EDS联用仪进行SEM及EDS检测,扫描电镜系美国 FEI公司的 QUANTA200F,仪器参数: 加速电压15 kV。
2 结果与分析
2.1 体外制备ACC的性质鉴定

图1 ACC的X射线衍射图谱Fig.1 XRD pattern of ACC
对制备产物进行 XRD 检测(图 1)发现,图谱中只有 20°~40°(2θ)和 40°~50°(2θ)之间分别检测到一个宽阔的衍射峰,并没有检测到方解石、文石等结晶态碳酸钙的任何特征衍射峰,表明在制备过程中 ACC没有发生晶型转化。扫描电镜结果(图 2)显示,制备产物为均匀球状颗粒,没有检测到体外结晶的方解石晶体的正方体或文石晶体的针簇状形貌,表明ACC保持了其无定形状态。
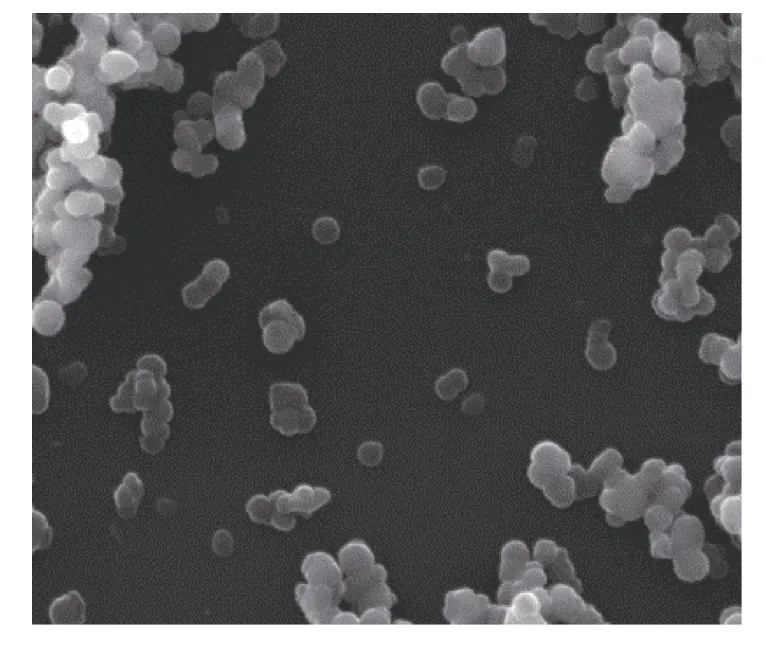
图2 扫描电子显微镜下ACC的形貌Fig.2 SEM image of ACC
2.2 珍珠层EDTA可溶性基质蛋白对ACC稳定性及晶型转化的影响
取1.2.3中ACC晶型转化体外反应体系中不同反应时间的碳酸钙样品分别进行FTIR检测。结果表明,在转化体系不含有 Mg2+的情况下,ACC在水溶液中反应5 min后的样品便在712 cm–1检测到典型的方解石吸收峰,表明水溶液中ACC迅速转化为方解石(图3)。在Tris-Cl缓冲溶液中ACC转化较在水溶液中缓慢,但仍在10 min内发生了转化形成方解石(图4A)。加入 20 μg/mL珍珠层 ESM后 ACC的转化速率明显减慢,在1 h后才发生转化形成方解石(图4B)。结果表明,珍珠层ESM具有稳定ACC的作用,稳定时间大于1 h。
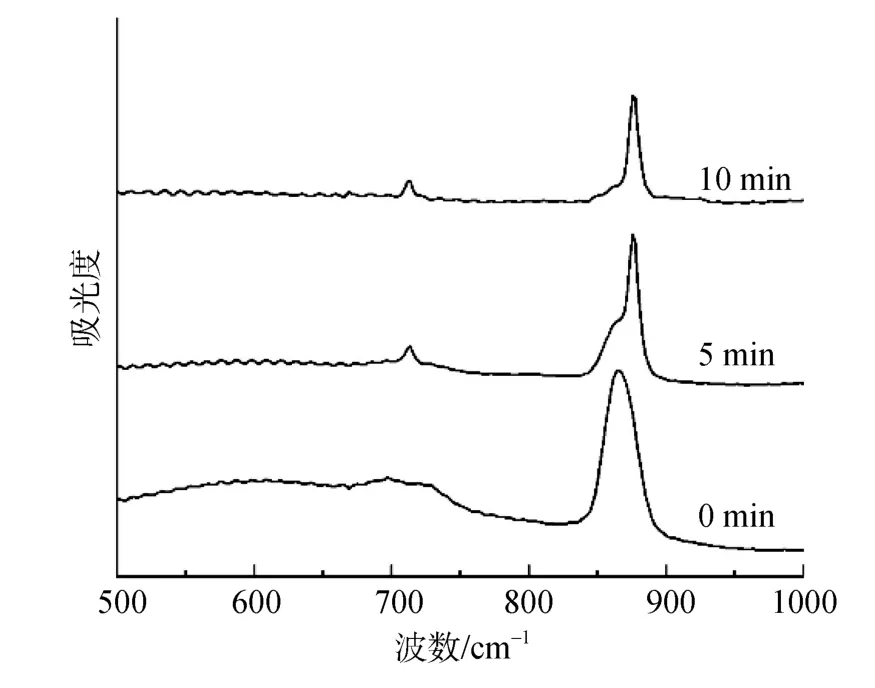
图3 水溶液中ACC的转化速率Fig.3 FT-IR spectra of ACC in water at different time intervals
在ACC晶型转化体外反应体系中含有1 mmol/L Mg2+的情况下,未加入珍珠层 ESM 时,Mg2+并没有明显的稳定ACC的作用,ACC在30 min之内便发生转化形成方解石(图3C),表明1 mmol/L的Mg2+对于ACC的稳定作用不及20 μg/mL的珍珠层ESM。但在反应体系中加入20 μg/mL珍珠层ESM后,ACC的转化明显受到抑制,在转化体系中反应23 h后仍稳定存在而不发生转化(图3D)。结果表明,Mg2+和珍珠层ESM对于ACC的稳定具有协同作用。Mg2+和珍珠层ESM对于ACC的稳定时间分别小于30 min和3 h,但体系中同时存在Mg2+和珍珠层ESM时,ACC的稳定时间可长达24 h以上。
在ACC晶型转化体外反应体系中含有5 mmol/L Mg2+的情况下,未加入珍珠层ESM时,ACC的稳定时间不及3 d(图3E),ACC在3 d内发生转化形成方解石。但加入珍珠层ESM后,ACC可被Mg2+和珍珠层ESM的协同作用稳定长达4 d以上(图3F)。
2.3 珍珠层 EDTA可溶性基质蛋白对晶体镁钙比的影响
取1.2.3中ACC晶型转化体外反应体系中不同反应时间的碳酸钙样品分别进行能谱检测,结果表明(表1),在含有1mmol/L Mg2+且未加入珍珠层ESM的转化体系中,ACC未发生转化时,ACC中镁离子相对于钙离子的含量为2.2%±1.5%,而ACC转化成方解石后这一数值达到8.4%±0.7%,增加了282%,说明在未加入珍珠层 ESM 时,随着时间的推移,Mg2+参与ACC转化为方解石的过程并最终掺入方解石晶体中,使得晶体中 Mg2+含量明显增加。但在加入珍珠层ESM后,ACC发生转化前,ACC中镁离子含量为 1.3%±0.9%,ACC转化成方解石后这一数值为3.6%±0.4%,虽然镁离子含量增加了 177%,但明显小于未加入珍珠层 ESM 的情况。由此可见,珍珠层ESM 可以抑制 ACC晶型转化形成方解石的过程中Mg2+的参与,减少最终形成的方解石中Mg2+的含量。
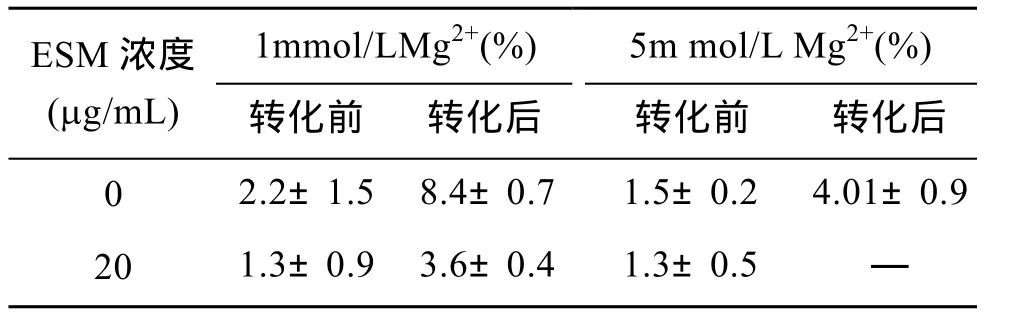
表1 不同浓度 Mg2+存在的条件下转化前后 ACC中Mg2+/Ca2+(%)的变化Tab.1 Changes of Mg2+/Ca2+(%)in ACC before/after ACC transformation in the systems of different concentrations of Mg2+
2.4 珍珠层 EDTA可溶性基质蛋白对晶体形貌的影响
取1.2.3中加入1 mmol/LMg2+的ACC晶型转化体外反应体系中不同反应时间的碳酸钙样品进行SEM检测,结果表明,未加入珍珠层ESM时,ACC转化形成的方解石有两种晶貌。一种呈棒槌型多层片状晶貌,另一种则类似体外结晶的典型正方体方解石堆叠而成的晶貌。而加入珍珠层ESM后,ACC晶型转化后形成的方解石晶貌则具有明显的不规则性,晶貌趋向于球状,且没有明显的分层结构。说明珍珠层ESM可能具有调节ACC中离子的排列的作用,从而调节ACC转化产物的晶貌。
3 讨论
研究表明,生物体中方解石和文石均由暂态ACC转化而来[14-15]。同时,生物体内的稳定ACC作为机械强化剂和钙离子和碳酸根离子的暂时贮存位点,在生物矿化中也起着重要作用[16-18]。生物体中存在稳定性不同的ACC表明,生物体必定通过某种机制调节 ACC的稳定性,从而使暂态 ACC得以在合适的条件下结晶,而稳定 ACC得以保持其稳定状态。因此,研究生物体调节 ACC稳定性的机制,对阐明生物矿化过程以及解释生物矿化产物具有优良材料学特性的原因具有重要意义。另一方面,通过一些手段提高ACC的稳定性并探究其稳定机理,不仅有助于在体外研究ACC的晶型转化过程,更有助于阐明生物体调节ACC稳定性的机制,从而进一步解释生物矿化的机制。同时,提高ACC的稳定性也有助于今后对体外模拟珍珠形成的过程进行准确控制。研究表明,向溶液中添加某些成分,如镁离子[27],磷酸根离子[28],乙二醇[29]等都可以可逆地稳定ACC。这些添加剂可能通过吸附在初生晶核上从而抑制碳酸钙沉淀。也有研究表明,在含有镁的情况下,从藻类Corallina提取的大分子可以稳定ACC[30],说明向溶液中添加两种以上成分也可以有效稳定ACC。这与本研究中,相较于不含有Mg2+的情况,在含有Mg2+的溶液中珍珠层ESM对ACC的稳定作用显著增强一致。
生物矿物的形成环境复杂多变,因此其中或多或少会含有一些杂质成分。但由于固相的溶解度以及杂质离子丰度的限制,这些杂质成分的含量非常少,对生物矿物性质的影响也较小。但Mg元素对碳酸钙生物矿物的影响却受到了广泛关注。生物矿化过程中Mg2+整合进方解石晶格会使得方解石的溶解度升高[31-32],而溶解度升高往往伴随着稳定性的降低;Mg元素对文石的溶解度的影响则较小,因此,在高Mg/Ca比的结晶溶液中则倾向于沉积文石。研究表明,生物来源的方解石中Mg含量受到严格的调控[33-34]。也有体外研究表明,贝壳棱柱层ESM可显著降低方解石Mg含量,但贝壳珍珠层ESM却对方解石中 Mg含量没有显著影响[35]。这可能是由于上述研究中方解石体外结晶过程由饱和离子溶液为开端,因此,贝壳 ESM 的作用体现了由无机离子转化为稳定晶体的过程中的整体作用,对于ESM在ACC转化为稳定晶型阶段的作用并没有进行详细探讨。由于 ACC的晶型转化是珍珠生物矿化的关键步骤,因此本研究主要探讨了珍珠层ESM在ACC晶型转化过程中对于Mg2+含量的调节作用。结果表明,ACC晶型转化过程中珍珠层ESM可以显著降低方解石中Mg2+的含量。而珍珠层 ESM 在 Mg2+存在时可以显著提高ACC的稳定性。因此,贝壳珍珠层ESM可能通过抑制Mg2+结合到ACC,调节晶体中镁含量来稳定ACC。同时SEM结果表明,珍珠层ESM可以调节ACC转化形成的方解石的晶貌,使ACC以不同于典型方解石正方体晶貌的形式结晶。这表明,生物体可能通过珍珠层ESM来塑造ACC的晶貌,从而使其结构与功能相适应。
参考文献:
[1]Simkiss K,Wilbur K M.Biomineralization: Cell biology and Mineral Deposition[M].New York:Academic Press,1989.
[2]Lowenstam H A,Weiner S.On Biomineralization[M].New York: Oxford University Press,1989.
[3]Hare P E.Amino Acids in proteins from aragonite and calcite in shells of Mytiluscalifornianus[J].Science,1963,139(355): 216.
[4]Weiner S,Traub W,Parker S B.Macromolecules in mollusc shells and their functions in Biomineralization[J].Philosophical Transactions of the Royal Society of London.Series B,Biological Sciences,1984,304(1121): 425-433.
[5]Falini G,Albeck S,Weiner S,et al.Control of aragonite or calcite polymorphism by mollusk shell macromolecules[J].Science,1996,271(5245): 67-69.
[6]Miyamoto H,Miyashita T,Okushima M,et al.A carbonic anhydrase from the nacreous layer in oyster pearls[J].Proceedings of the National Academy of Sciences of the United State of America,1996,93(18):9657-9660.
[7]Kong Y W,Jing G,Yan Z G,et al.Cloning and characterization of prisilkin-39,a novel matrixprotein serving a dual role in the prismatic layer formation from the oyster pinctadafucata[J].Journal of Biological Chemistry,2009,284(16): 10841-10854.
[8]Takeuchi T,Sarashina I,Iijima M,et al.In vitro regulation of CaCO3crystal polymorphism by the highly acidic molluscan shell protein aspein[J].Febs Letters,2008,582(5): 591-596.
[9]Kono M,Hayashi N,Samata T.Molecular mechanism of the nacreous layer formation in pinctada maxima[J].Biochemical and Biophysical Research Communications,2000,269(1): 213-218.
[10]Yan Z G,Jing G,Gong N P,et al.N40,a novel nonacidic matrix protein from pearl oyster nacre,facilitates nucleation of aragonite in vitro[J].Biomacromolecules,2007,8(11): 3597-3601.
[11]Feng Q L,Pu G,Pei Y,et al.Polymorph and morphology of calcium carbonate crystals induced by proteins extracted from mollusk shell[J].Journal of Crystal Growth,2000,216(1-4): 459-465.
[12]Prenant M.The types of calcium mineral in living beings and the problem of their determination[J].Biological Reviews and Biological Proceedings of the Cambridge Philosophical Society,1927,2(4): 365-393.
[13]Ogino T,Suzuki T,Sawada K.The formation and transformation mechanism of calcium-carbonate in water[J].Geochimica et Cosmochimica Acta,1987,51(10): 2757-2767.
[14]Beniash E,Aizenberg J,Addadi L,et al.Amorphous calcium carbonate transforms into calcite during sea urchin larval spicule growth[J].Proceedings of the Royal Society B-Biological Sciences,1997,264(1380):461-465.
[15]Weiss I M,Tuross N,Addadi L,et al.Mollusc larval shell formation: Amorphous calcium carbonate is a precursor phase for aragonite[J].Journal of Experimental Zoology,2002,293(5): 478-491.
[16]Aizenberg J,Weiner S,Addadi L.Coexistence of amorphous and crystalline calcium carbonate in skeletal tissues[J].Connective Tissue Research,2003,441: 20-25.
[17]Aizenberg J,Lambert G,Weiner S,et al.Factors involved in the formation of amorphous and crystalline calcium carbonate: A study of an ascidian skeleton[J].Journal of the American Chemical Society,2002,124(1): 32-39.
[18]Aizenberg J,Lambert G,Addadi L,et al.Stabilization of amorphous calcium carbonate by specialized macromolecules in biological and synthetic precipitates[J].Advanced Materials,1996,8(3): 222.
[19]Ma Z J,Huang J,Sun J,et al.A novel extrapallial fluid protein controls the morphology of nacre lamellae in the pearl oyster,Pinctada fucata[J].Journal of Biological Chemistry,2007,282(32): 23253-23263.
[20]Addadi L,Raz S,Weiner S.Taking advantage of disorder: Amorphous calcium carbonate and its roles in biomineralization[J].Advanced Materials,2003,15(12):959-970.
[21]Raz S,Hamilton P C,Wilt F H,et al.The transient phase of amorphous calcium carbonate in sea urchin larval spicules: The involvement of proteins and magnesium ions in its formation and stabilization[J].Advanced Functional Materials,2003,13(6): 480-486.
[22]Samata T,Hayashi N,Kono M,et al.A new matrix protein family related to the nacreous layer formation of Pinctada fucata[J].Febs Letters,1999,462(1-2):225-229.
[23]Suzuki M,Saruwatari K,Kogure T,et al.An acidic matrix protein,pif,is a key macromolecule for nacre formation[J].Science.2009,325(5946): 1388-1390.
[24]Yano M,Nagai K,Morimoto K,et al.A novel nacre protein N19 in the pearl oyster Pinctada fucata[J].Biochemical and Biophysical Research Communications,2007,362(1): 158-163.
[25]Zhang C,Li S,Ma Z J,et al.A novel matrix protein p10 from the nacre of pearl oyster (Pinctada fucata)and its effects on both CaCO3crystal formation and mineralogenic cells[J].Marine Biotechnology,2006,8(6): 624-633.
[26]Tao J H,Zhou D M,Zhang Z S,et al.Magnesium-aspartate-based crystallization switch inspired from shell molt of crustacean[J].Proceedings of the National Academy of Sciences of the United States of America,2009,106(52): 22096-22101.
[27]Reddy M M,Nancollas G H.Crystallization of calcium carbonate: IV.theeffect of magnesium,strontium and sulfate-ions[J].Journal of Crystal Growth.1976,35(1):33-38.
[28]Clarkson J R,Price T J,Adams C J.Role of metastable phases in the spontaneous precipitation of calcium carbonate[J].Journal of the Chemical Society-Faraday Transactions,1992,88(2): 243-249.
[29]Kjellin P,Holmberg K,Nyden M.A new method for the study of calcium carbonate growth on steel surfaces[J].Colloids and Surfaces A-Physicochemical and Engineering Aspects,2001,194(1-3): 49-55.
[30]Raz S,Weiner S,Addadi L.Formation of high-magnesian calcites via an amorphous precursor phase: Possible biological implications[J].Advanced Materials,2000,12(1): 38.
[31]van Enckevort W,van den Berg A.Impurity blocking of crystal growth: a Monte Carlo study[J].Journal of Crystal Growth,1998,183(3): 441-455.
[32]Voronkov V V,Rashkovich L N.Influence of a mobile adsorbed impurity on the motion of steps[J].Soviet Physics-Crystallography,1992,37(3): 289-295.
[33]Mucci A.Influence of temperature on the composition of magnesium calcite overgrowths precipitated from seawater[J].Geochimica et Cosmochimica Acta,1987,51(7): 1977-1984.
[34]Blackmon P D,Todd R.Mineralogy of some foraminifera as related to their classification and ecology[J].Journal of Paleontology,1959,33(1): 1-15.
[35]朱方捷.合浦珠母贝贝壳基质大分子对含镁方解石镁含量的调控[D].北京: 清华大学,2010.
