青少年首发抑郁症患者大脑静息状态功能网络小世界特性研究
2014-06-23金晨望马现仓高成阁
陈 策,金晨望,马现仓,高成阁,张 明
(西安交通大学医学院第一附属医院:1.精神心理科;2.影像科,陕西西安 710061)
◇临床研究◇
青少年首发抑郁症患者大脑静息状态功能网络小世界特性研究
陈 策1,金晨望2,马现仓1,高成阁1,张 明2
(西安交通大学医学院第一附属医院:1.精神心理科;2.影像科,陕西西安 710061)
目的利用复杂网络理论比较青少年首发未用药抑郁症患者与正常对照组之间大脑小世界功能网络拓扑结构的异同点,以期进一步阐明青少年抑郁症患者的神经病理发病机制。方法共纳入研究对象32例,青少年抑郁症患者组16例,符合美国精神疾病诊断与统计手册第4版(DSM-IV)的首发单相青少年抑郁症患者,以往从未接受过任何治疗;正常对照组16名,两组间年龄、教育程度相匹配。所有被试对象均为右利手。采用不同的相关系数作为阈值构建大脑复杂网络。结果青少年首发未服药患者组大脑神经网路拓扑结构,较正常健康对照呈现一种相对无序混乱的状态。青少年抑郁症组大脑网络小世界特性明显下降,神经网络整体运行效率下降。杏仁核在大脑拓扑结构中度值上升,杏仁核与颞叶皮层、杏仁核与顶叶皮层、杏仁核与中央后回、前额叶与顶下小叶等脑区之间功能连接增高,并且功能连接改变与患者病程呈正相关。青少年抑郁症组中,静息态背景下,前扣带回、前额叶背外侧段、前额叶内侧段、前额叶下段、岛叶和颞叶皮层度值增加。结论杏仁核在抑郁症发生、发展中起重要的作用,有关杏仁核的神经网络拓扑结构异常可能是潜在的青少年抑郁症患者抑郁易感性、疾病发展的生物学标记。抑郁症患者大脑多个脑区存在结构和功能的异常。
青少年;抑郁症;功能网络;杏仁核
抑郁症患者其标志性的症状是蔓延的负性情绪和不能抑制的负性情绪的产生[1]。青少年大脑正在发育,神经元之间突触连接尚未最终形成,缺乏完善的心理调控机制,更容易导致情绪与控制失衡,负性情绪程度加重[2]。功能性磁共振成像,可以在生理状态下在体无创研究人脑的形态结构和功能活动,为求证认知和行为异常与脑功能改变间的关联提供了十分有效的工具[3]。
作为人类最复杂的动态系统之一,人脑通过脑区之间持续不断的信息传递和整合,实现、重塑复杂功能。复杂网络方法为我们从系统层面考察大脑的复杂功能提供了一种新的研究手段和平台[10]。本研究利用复杂网络理论比较青少年首发未用药抑郁症患者与正常对照组之间大脑小世界功能网络拓扑结构的异同点,以期进一步阐明青少年首发未用药抑郁症患者的神经病理发病机制。
1 对象与方法
1.1 研究对象抑郁症组:来源于2009年7月至2012年11月西安交通大学医学院第一附属医院精神心理科门诊初诊和住院的青少年抑郁症患者。入组标准:采用美国精神疾病诊断与统计手册第4版(DSM-IV)招募单相抑郁症患者,所有参与本研究的被试均为首次发作,以往从未接受过任何治疗,年龄13~18岁,HAMD评分>17分。排除标准:超过5 min以上的意识障碍史,既往符合中国精神障碍分类与诊断标准第3版和美国精神疾病诊断与统计手册第4版的物质滥用和物质依赖诊断标准;既往有精神疾患、神经系统变性性疾病、脑外伤、血管疾患者、心脏、肝脏、肾脏重大疾患者。
健康对照组:来源于附近社区招募的健康志愿者,于2009年10月至2012年7月选择入组。入组标准:年龄13~18岁,不符合美国精神疾病诊断与统计手册第4版的抑郁症诊断标准,参与本研究前一个月没有服用过任何精神类药物,HAMD<7分。排除标准:既往有精神病史或一级亲属中有严重精神和神经系统疾病史,具有意识障碍史(时长>5 min),既往符合中国精神障碍分类与诊断标准第3版以及美国精神疾病诊断与统计手册第4版的物质滥用和物质依赖诊断标准,既往有精神疾患、神经系统变性性疾病、脑外伤、血管疾患者、心脏、肝脏、肾脏重大疾患者。
所有研究对象均为右利手,实验前所有被试均被详细告知本研究的目的、方法以及可能的不适和相应的风险。研究经西安交通大学医学院医学伦理委员会同意,所有对象自愿参加并签署知情同意书。
1.2 设备及参数采用Philips Gyroscan Intera 1.5T超导型磁共振成像系统,标准八通道正交头线圈进行MR检查。检查前告知被试者扫描流程,检查大致需要时间及扫描过程中可能出现的问题及注意事项。扫描时,受试者仰卧,头部固定,戴耳机以尽量减少扫描时MR机器噪声影响,保持轻闭双眼,减少视觉的刺激。嘱被试者保持静息状态,尽量不去思考问题,同时不要入睡。检查过程中,受试者若无法耐受检查,及时终止扫描。所有被试者扫描均由同一名能够熟练操作MR机器影像科医师进行。
首先进行轴位、矢状位及冠状位三平面定位序列扫描,以前联合-后联合连线(AC-PC线)为轴位扫描平行线,扫描平面垂直于中线结构,保证轴位像两侧脑组织结构对称。常规MR序列扫描:矢状T1WI:TR=73 ms,TE=2 ms,NSA=1;冠状T2-FSE:TR =1 213 ms,TE=120 ms,NSA=1。轴位T2-FLRIAR序列:TR=6 000 ms,TE=110 ms,IR=2 000 ms,快速因子25,翻转角90°,采集次数1次,层数27,层厚5 mm,层间距0 mm。扫描视野(FOV)256 mm×256 mm。扫描时间2 min 42 s。首先观察并评价3个序列,对脑实质内有明显器质性病变者终止进一步检查,若无重大器质性改变继续静息态f MRI序列扫描。
静息态f MRI序列:单次激发FFE-EPI,轴位扫描,TR=3 000 ms,TE=50 ms,翻转角90°,采集次数1次,层数27,层厚5 mm,层间距0 mm。扫描视野(FOV)256 mm×256 mm。矩阵64 mm×64 mm,重建矩阵128 mm×128 mm。图像空间分辨率为2 mm ×2 mm×5 mm,采用自动匀场,SPIR压脂,扫描150个时间点全脑数据,扫描时间为7 min 39 s。扫描范围包括全脑,自枕骨大孔至颅顶。
1.3 脑功能数据的处理所有青少年首发未用药抑郁症患者的静息态功能磁共振数据的处理都是在图像参数分析软件5(statistical parametric mapping 5,SPM5)软件应用平台上进行,具体步骤如下:①空间校正。纠正数据采集过程中由于被试对象头动而造成图像在空间上的错位。首先采用最小二乘算法对采集到的青少年首发未用药抑郁症患者的静息态功能磁共振数据进行头动校正。并对校正后数据采用人工一一检查。若试验数据头颅平移超过1 mm或旋转超过1度,数据将予以剔除,不予分析。经核实患者组所有数据符合要求,正常对照组数据有1例头动平移约3 mm,该数据予以排除。②时间校正。消除脑不同扫描层面f MRI信号采集时间不同而引起的差异。③空间标准化。消除不同被试个体间的差异,对校正后数据利用12个参数的放射变换将平均图像配准到蒙特利尔神经学研究(montreal neurological institute,MNI)标准模板,并重建为3 mm× 3 mm×3 mm大小的体素。④数据平滑、滤波。采用具有高斯核函数(全半高宽=6 mm)的滤波器,将上述处理完的影像数据进行平滑处理,该处理步骤可以有效降低噪声并提高数据的信噪比。并用带宽(0.01~0.1 Hz)的滤波器,去除数据的高频生理噪声以及低频的信号漂移,提取所需的低频涨落信号。⑤采用回归分析方法消除可能因素对分析结果引起的效应。
1.4 基于复杂网络方法的建模大脑脑功能网络数据的处理构建可以表征大脑网络的邻接矩阵,从大脑全局功能网络水平观察脑功能网络的拓扑特性。①利用由2002年Tzourio-Mazoyer提出的解剖标记模板(automated anatomical labeling,AAL)对前期预处理完的静息态数据进行分割处理。参考LIU和YUAN的方法,根据标准MNI空间坐标将大脑皮层分割为90个脑区、左右大脑各45个。②计算90个脑区之间时间序列的同步性。将整个大脑看作一个系统,忽略子系统内部的动力学行为,着重观察子系统互相之间的联系,并重点分析了子系统之间联系的统计学特性。90个脑区中每个脑区都被认为是脑复杂功能网络的一个节点。我们提取代表该脑区时间序列和脑功能活动自身属性的相应时间,计算每个脑区的对应的时间序列的平均值。利用Pearson相关系数,计算各脑区平均时间序列间的同步性,由此计算出一个相关系数矩阵(89×90),用来衡量各脑区间相互功能关系。③阈值R的选定。关于阈值R的选定,是脑功能网络建模过程中相对有争议的一步。普遍认为,脑功能网络具有复杂且稀疏的特性,具有大量的短程边,辅以少量的长程边(捷径)的特性。合理的阈值选择可以将弱连接认为是噪声边,加以去除;同时又能保障网络连通性(保证网络中无孤立的节点)。基于以上两点考虑,本研究选取的阈值范围为0.35~0.53,自0.35起,每间隔0.02设立一个阈值,总共设立10个阈值。阈值0.36可以保证网络中每个节点都存在连接性。④定量计算与网络特性相关的拓扑指标。既往研究表明人类脑网络具有小世界特性,这是一种高效的神经网络构成。聚类系数、平均最短路径长度和节点的度以及小世界网络特性是衡量小世界网络的最常用的重要指标,如果最短路径小于同维度的随机网络,而同时网络聚类系数又高于同维度的随机网络,这种网络被认为是小世界网络。
2 结 果
2.1 抑郁症组和健康对照组一般资料的比较本研究共纳入研究对象32例,青少年抑郁症患者组16例,正常对照组16名,两组间性别、年龄、教育程度相匹配(表1)。所有受试对象均为右利手。
表1 抑郁症组和对照组一般资料的比较Tab.1 Comparison of general information between depressive patients and healthy controls()

表1 抑郁症组和对照组一般资料的比较Tab.1 Comparison of general information between depressive patients and healthy controls()
HAMD-17(Hamilton-17 depression rating scale):汉密尔顿-17项抑郁量表。
一般项目抑郁症组(n=16)健康对照组(n=16)P值17.1±1.5 17.2±1.5 0.893性别(男/女) 8/8 8/8教育(年) 9.6±1.6 10.1±1.5 0.407病程(d)153.6±47.5 -HAMD-17评分20.0±2.1 3.2±1.0<年龄(岁) 0.05
2.2 抑郁症组与正常对照组小世界网络特性的比较采用不同的相关系数作为阈值构建大脑复杂网络。自0.35起,每间隔0.02设立一个阈值,总共设立10个阈值。阈值0.36可以保证网络中每个节点都存在连接性。结果发现,患者组和对照组大脑网络结构都呈现小世界特性,相比较正常组,患者组小世界网络特性下降,当T值选择0.47时,两组网络之间小世界网络可定量指标差别最为显著(P<0.01,FDR校正,图1)。在这个阈值下,正常对照组小世界网络特性为2.13,而患者组小世界网络特性为1.57。因此,我们选取T值为0.47时构建的小世界网络作为进一步分析的对象。
2.3 抑郁症患者组与正常健康对照组之间脑区度值的比较

图1 不同阈值时抑郁症患者组与正常健康对照组小世界网络特性的比较Fig.1 Comparison of the characteristics of the resting network in first-episode medication-naive depressive adolescents and healthy controls
2.3.1 青少年抑郁症患者组与健康对照组相比静息状态下边缘叶的前扣带回、岛叶、杏仁核脑区度值异常(表2)。
表2 抑郁症患者组与正常健康对照组之间脑区度值的比较Tab.2 Comparison of the brain region value between depressive patients and healthy controls()

表2 抑郁症患者组与正常健康对照组之间脑区度值的比较Tab.2 Comparison of the brain region value between depressive patients and healthy controls()
边缘系统感兴趣区健康对照组抑郁症组P值ACC L 22.4±14.5 43.6±20.6 0.02 ACC R 23.1±11.1 48.6±19.3 0.01 INS R 17±18.2 42.3±21.9 0.01 AMYG L 8.2±14.1 23.4±15.9 0.04
2.3.2 青少年抑郁症患者组相对正常健康对照组杏仁核与颞叶皮层、杏仁核与顶叶皮层、杏仁核与中央后回、前额叶与顶下小叶等两脑区之间功能连接异常,并且功能连接改变与患者病程呈正相关(图2)。

图2 抑郁患者组与正常健康对照组之间脑区功能连接情况的比较Fig.2 Comparison of the functional connectivity of brain region between depressive patients and healthy controls
2.3.3 青少年抑郁症患者组静息状态下前额叶的背外侧皮层、前额叶内侧皮层、前额叶下段皮层脑区度值异常(表3)。
2.3.4 青少年抑郁症患者组与健康对照组相比静息状态下颞叶的颞上回、颞下回脑区度值异常(表4)。
表3 患者组与健康对照组边缘叶之间脑区度值的比较Tab.3 Comparison of the value of brain region in limbic lobe between depressive patients and healthy controls()
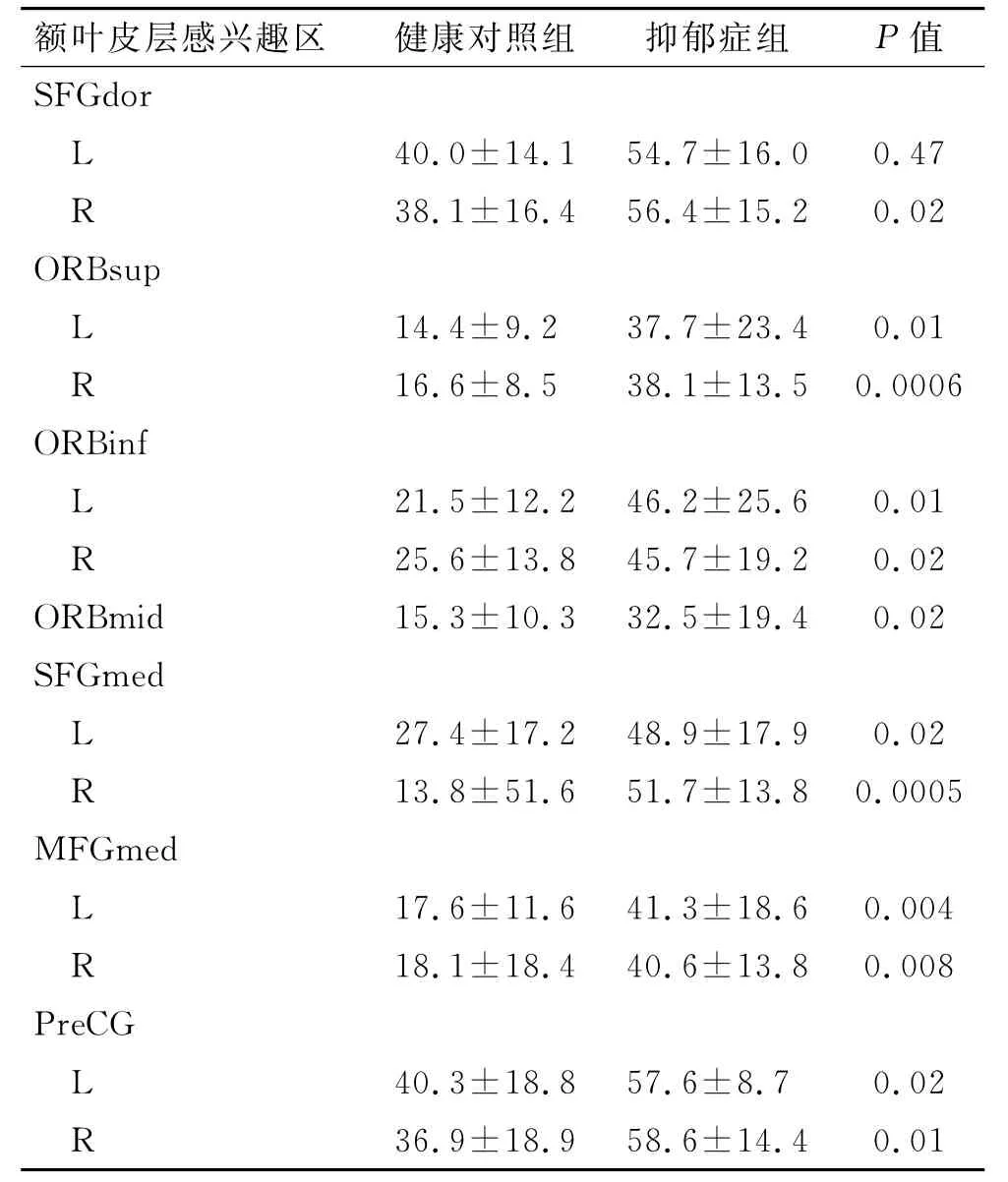
表3 患者组与健康对照组边缘叶之间脑区度值的比较Tab.3 Comparison of the value of brain region in limbic lobe between depressive patients and healthy controls()
额叶皮层感兴趣区健康对照组抑郁症组P值SFGdor L 40.0±14.1 54.7±16.0 0.47 R 38.1±16.4 56.4±15.2 0.02 ORBsup L 14.4±9.2 37.7±23.4 0.01 R 16.6±8.5 38.1±13.5 0.0006 ORBinf L 21.5±12.2 46.2±25.6 0.01 R 25.6±13.8 45.7±19.2 0.02 ORBmid 15.3±10.3 32.5±19.4 0.02 SFGmed L 27.4±17.2 48.9±17.9 0.02 R 13.8±51.6 51.7±13.8 0.0005 MFGmed L 17.6±11.6 41.3±18.6 0.004 R 18.1±18.4 40.6±13.8 0.008 PreCG L 40.3±18.8 57.6±8.7 0.02 36.9±18.9 58.6±14.4 0.01 R
表4 患者组与健康对照组颞叶之间脑区度值的比较Tab.4 Comparison of the value of brain region in temporal lobe between depressive patients and healthy controls()

表4 患者组与健康对照组颞叶之间脑区度值的比较Tab.4 Comparison of the value of brain region in temporal lobe between depressive patients and healthy controls()
颞叶皮层感兴趣区健康对照组抑郁症组P值STG R 37.6±20.7 57.3±14.8 0.03 TPOsup L 33.1±21.1 54.0±17.1 0.03 R 33.5±19.8 52.3±15.5 0.03 MTG L 39.5±18.9 60.4±17.2 0.02 R 35.2±22.0 57.0±17.1 0.03
3 讨 论
抑郁症患者其标志性的症状是蔓延的负性情绪和不能抑制的负性情绪的产生[1]。青少年大脑正在发育,神经元之间突触连接尚未最终形成,缺乏完善的心理调控机制,更容易导致情绪与控制失衡,负性情绪程度加重[2]。功能性磁共振成像,可以在生理状态下在体无创研究人脑的形态结构和功能活动,为求证认知和行为异常与脑功能改变间的关联提供了十分有效的工具[3]。
既往基于任务的功能磁共振成像研究发现,青少年抑郁症患者多个脑区与正常人比较活动强度发生异常变化[4]。YANG等[5-6]发现青少年抑郁症患者在执行面部表情识别任务过程中,双侧杏仁核激活强度较正常健康对照组增加,并且左侧杏仁核激活强度与青少年抑郁症患者发病程度呈正相关。FORBES等[7]研究表明,青少年抑郁症患者存在青少年奖赏处理异常改变和正性情感减少。
静息态功能磁共振成像研究可以避免繁杂的任务设计,但是研究结果会受到研究者所用不同数据分析方法和所选择感兴趣脑区的影响[8]。基于感兴趣区的静息态磁共振成像脑功能研究发现,青少年抑郁症患者以扣带回膝下部为核心的功能网络连接度异常,提示扣带回膝下部是青少年情绪调节环路的重要节点,其功能异常可能是青少年抑郁症患者的负性情感认知的神经病理基础[9]。JIAO等[20]发现,青少年抑郁症患者前额叶皮层与皮层下结构自发神经元同步活动差距增大,提示皮层下结构尤其是与情感有关的杏仁核、海马、前扣带回与前额叶皮层不同步的发育模式,容易引起青少年抑郁症的产生。
虽然上述研究从不同视角阐述了青少年抑郁症患者神经病理机制,但青少年抑郁症神经病理机制至今不明。因此,从大脑整体水平评价青少年抑郁症患者大脑神经网络的异常活动,可能有利于进一步阐明青少年抑郁症患者的神经病理学机制。复杂网络分析方法将复杂系统内的子系统作为节点,将子系统之间的关系用边进行表达,然后根据复杂系统和子系统之间的相互关系,使用边的方向和权重等参数来描述系统内部各种联系的强弱、大小及拓扑特性等[10]。不仅可以对系统和子系统之间的关系进行定义,还能宏观地对整个系统进行描述。既往复杂网络方法研究已经应用到精神分裂,物质依赖成瘾等疾病,也得到了一定的结果[11,12-15]。但是,针对青少年抑郁症患者的复杂网络研究,相关文献报道较少。
本研究利用复杂网络分析方法比较了青少年首发未用药抑郁症患者与正常对照组之间大脑功能网络拓扑结构的异同点。首先,本研究发现虽然青少年大脑神经元之间突触连接尚未最终形成,但其网络拓扑结构同成人一样,都具有小世界网络的特性[2]。小世界网络模型由WATTS等[28]提出是一种高效的网络运行模式。研究证实,大脑神经网络的联接模式具有小世界特性,是不同脑区神经活动同步的最佳选择[11,16]。
其次,与正常健康青少年相比,青少年首发未用药抑郁症患者大脑神经网络结构呈现一种相对无序混乱的拓扑结构,大脑网络小世界特性明显下降,神经网络运行效率减低。有关成人首发未用药抑郁症患者复杂网络研究同样报道了这一现象[15],该研究发现首发未用药抑郁症患者大脑网络运行模式更像一种随机网络的连接。不同精神、心理疾患都会影响大脑神经网络拓扑结构,小世界网络特性下降可能仅仅是一种共性的表现,探讨引起青少年抑郁症患者引起大脑小世界网络特性下降的原因,才能更深层次地阐明青少年抑郁症神经病理学的发病机制。
进一步研究发现,静息状态下青少年抑郁症患者组大脑网络拓扑结构中,杏仁核度值增加,并且以杏仁核为枢纽,杏仁核与颞叶皮层、杏仁核与顶叶皮层、杏仁核与中央后回、前额叶与顶下小叶等两脑区之间功能连接异常,并且功能连接改变与患者病程呈正相关。杏仁核属于边缘系统,是调节情绪,识别、产生情绪的重要结构。本次实验的被试人群为青少年,青春期额叶皮层的情绪调节能力发育尚不完全,有关情感网络调控功能未完善,而皮层下结构尤其是与情感有关的杏仁核、海马、前扣带回发育较前额叶迅速,会出现脱抑制而凌驾于皮层调节的表现。这可能是我们实验发现在大脑网络拓扑结构中杏仁核度值增加的主要原因。JIAO等[20]发现,静息状态下青少年抑郁症患者相对正常健康志愿者额叶皮层与皮层下结构自发神经元同步活动差距进一步加大,CULLEN等[21]也发现连接杏仁核与前扣带回区域的白质束的整合性减低,前扣带回对杏仁核的输入调节存在缺陷。以上研究从侧面证实了我们的推测,也说明青少年抑郁症的神经病理学机制和成人期不同,青春期大脑皮层与皮层下结构(海马、杏仁核等)发育不均衡有可能是导致青少年抑郁症易发、发展、反复发作的神经病理学基础。另外,我们还发现杏仁核与颞叶皮层、杏仁核与顶叶皮层、杏仁核与中央后回、前额叶与顶下小叶等两脑区之间功能连接异常,并且功能连接改变与患者病程呈正相关,提示我们杏仁核在抑郁症发生、发展中起重要的作用,有关杏仁核的神经网络拓扑结构异常可能是潜在的青少年抑郁症患者抑郁症易感性、疾病发展的生物学标记。
此外,本研究还发现在青少年抑郁症患者组中,静息态背景下,前扣带回在大脑神经网络拓扑结构中度值增加。作为大脑边缘系统的一部分,扣带回主要参与的认知过程包括学习、情感和记忆。以前扣带回为感兴趣区的静息态功能磁共振成像研究结果[21]提示,除杏仁核之外扣带回膝下部的功能异常可能会导致青少年抑郁症患者的负性情感认知。基于核磁共振成像的结构学研究[4]发现,有抑郁症状的男孩前扣带回喙部皮层体积明显小于无抑郁症状的男孩,并且前扣带回喙部皮层容体积与抑郁症状呈负相关,提示我们前扣带回喙部结构的改变可能是潜在的青少年男性抑郁症易感性的生物学标记特征。
除了杏仁核、扣带回之外,本研究还发现在青少年抑郁症组中,静息态背景下,前额叶背外侧段、前额叶内侧段、前额叶下段、颞叶皮层在大脑神经网络拓扑结构中度值增加。这些脑区都曾在既往有关抑郁症研究中广泛报道,这一现象进一步证实了抑郁症患者大脑多个脑区存在结构和功能的异常。抑郁症对青少年患者的大脑脑区与脑区间的信息传递和整合、大脑复杂功能的实现和重塑都产生不良的影响。
本研究利用基于90个脑区级的复杂网络分析方法,观察大脑神经网络拓扑结构,比较了青少年首发未用药抑郁症患者与正常健康对照组之间大脑小世界功能网络整体工作效率及网络组织模式。研究结果表明,青少年首发未服药患者组大脑神经网路拓扑结构,较正常健康对照呈现一种相对无序混乱的状态。青少年抑郁症组大脑网络小世界特性明显下降,神经网络整体运行效率下降。杏仁核在大脑拓扑结构中度值上升,杏仁核与颞叶皮层、杏仁核与顶叶皮层、杏仁核与中央后回、前额叶与顶下小叶等脑区之间功能连接增高,并且功能连接改变与患者病程呈正相关。提示杏仁核在抑郁症发生、发展中起重要的作用,有关杏仁核的神经网络拓扑结构异常可能是潜在的青少年抑郁症患者抑郁易感性、疾病发展的生物学标记。除此之外,我们还发现在青少年抑郁症组中,静息态背景下,前扣带回、前额叶背外侧段、前额叶内侧段、前额叶下段、岛叶和颞叶皮层度值增加,提示抑郁症患者大脑多个脑区存在结构和功能的异常。抑郁症患者认知功能损伤并非某个脑区单独引起,从大脑整体水平,观察脑区与脑区间的信息传递和整合,大脑复杂功能如何实现和重塑,有利于我们进一步阐明青少年抑郁症患者神经病理学机制。
[1]DISNER SG,BEEVERS CG,HAIGH EA,et al.Neural mechanisms of the cognitive model of depression[J].Nat Rev Neurosci,2011,12(8):467-477.
[2]SUPEKAR K,UDDIN LQ,PRATER K,et al.Development of functional and structural connectivity within the default mode network in young children[J].Neuroimage,2010,52 (1):290-301.
[3]LOGOTHETIS NK.What we can do and what we cannot do with f MRI[J].Nature,2008,453(7197):869-878.
[4]DREVETS WC,PRICE JL,FUREY ML.Brain structural and functional abnormalities in mood disorders:implications for neurocircuitry models of depression[J].Brain Struct Funct,2008,213(1-2):93-118.
[5]YANG TT,SIMMONS AN,MATTHEWS SC,et al.Adoles-cents with major depression demonstrate increased amygdala activation[J].J Am Acad Child Adolesc Psychiatry,2010,49 (1):42-51.
[6]YANG TT,SIMMONS AN,Matthews SC,et al.Depressed adolescents demonstrate greater subgenual anterior cingulate activity[J].Neuroreport,2009,20(4):440-444.
[7]FORBES EE,HARIRI AR,Martin SL,et al.Altered striatal activation predicting real-world positive affect in adolescent major depressive disorder[J].Am J Psychiatry,2009,166(1):64-73.
[8]ROSAZZA C,MINATI L.Resting-state brain networks:literature review and clinical applications[J.Neurol Sci,2011,32 (5):773-785.
[9]CULLEN KR,GEE DG,KLIMES-DOUGAN B,et al.A preliminary study of functional connectivity in comorbid adolescent depression[J].Neurosci Lett,2009,460(3):227-231.
[10]BULLMORE E,SPORNS O.Complex brain networks:graph theoretical analysis of structural and functional systems[J].Nat Rev Neurosci,2009,10(3):186-198.
[11]ACHARD S,SALVADOR R,WHITCHER B,et al.A resilient,low-frequency,small-world human brain functional network with highly connected association cortical hubs[J].Neurosci,2006,26(1):63-72.
[12]AUGUETINE JR.Circuitry and functional aspects of the insular lobe in primates including humans[J].Brain Res Reviews,1996,22(3):229-244.
[13]PENFIELD OM,CMG MG,JASPER MD.Epilepsy and the functional anatomy of the human brain[J].J Am Med Assoc,1954,155(2):86.
[14]WANG L,LI Y,METZAK P,et al.Age-related changes in topological patterns of large-scale brain functional networks during memory encoding and recognition[J].NeuroImage,2010,50(3):862-872.
[15]ZHANG J,WANG J,WU Q,et al.Disrupted brain connectivity networks in drug-naive,first-episode major depressive disorder[J].Biol Psychiatry,2011,70(4):334-342.
[16]LOWE MJ,MOCK BJ,SORENSON JA.Functional connectivity in single and multislice echoplanar imaging using restingstate fluctuations[J].Neuroimage,1998,7(2):119-132.
[17]LIU J,LIANG J,QIN W,et al.Dysfunctional connectivity patterns in chronic heroin users:an f MRI study[J].Neurosci Lett,2009,460(1):72-77.
[18]YUAN K,QIN W,LIU J,et al.Altered small-world brain functional networks and duration of heroin use in male abstinent heroin-dependent individuals[J].Neurosci Lett,2010,477(1):37-42.
[19]MONK CS,KLEIN RG,TELZER EH,et al.Amygdala and nucleus accumbens activation to emotional facial expressions in children and adolescents at risk for major depression[J].Am J Psychiatry,2008,165(1):90-98.
[20]JIAO Q,DING J,LU G,et al.Increased activity imbalance in fronto-subcortical circuits in adolescents with major depression[J].PLoS One,2011,6(9):e25159.
[21]CULLEN KR,KLIMES-DOUGAN B,MUETZEL R,et al. Altered white matter microstructure in adolescents with major depression:a preliminary study[J].J Am Acad Child Adolesc Psychiatry,2010,49(2):173-183.
[22]KILLGORE WD,GRUBER SA,YURGELUN-TODD DA. Depressed mood and lateralized prefrontal activity during a Stroop task in adolescent children[J].Neurosci Lett,2007,416(1):43-48.
[23]SPRENGELMEYER R,STEELE JD,MWANGI B,et al.The insular cortex and the neuroanatomy of major depression[J].J Affect Disord,2011,133(1-2):120-127.
[24]PENG J,LIU J,NIE B,et al.Cerebral and cerebellar gray matter reduction in first-episode patients with major depressive disorder:a voxel-based morphometry study[J].Eur J Radiol,2011,80(2):395-399.
[25]TAKAHASHI T,YUCEL M,LORENZETTI V,et al.Volumetric MRI study of the insular cortex in individuals with current and past major depression[J].J Affect Disord,2010,121 (3):231-238.
[26]LEE BT,SEONG WC,HYUNG SK,et al.The neural substrates of affective processing toward positive and negative affective pictures in patients with major depressive disorder[J]. Prog Neuropsychopharmacol Biol Psychiatry,2007,31(7):1487-1492.
[27]FAIR DA,COHEN AL,POWER JD,et al.Functional brain networks develop from a“local to distributed”organization[J]. PLoS Comput Biol,2009,5(5):e1 000381.
[28]WWTTS DJ,STROGATZ SH.Collective dynamics of'smallworld'networks[J].Nature,1998,393(6684):440-442.
(编辑 韩维栋)
A preliminary study of the functioning network in first-episode medication-naive adolescent depression
CHEN Ce1,JIN Chen-wang2,MA Xian-cang1,GAO Cheng-ge1,ZHANG Ming2
(1.Department of Psychiatry,2.Department of Psychiatry,the First Affiliated Hospital,Medical School of Xi'an Jiaotong University,Xi'an 710061,China)
ObjectiveTo compare the brain function between the first-episode medication-naive depressive adolescents and healthy controls by using the theory of complex network so as to further elucidate the neural pathological mechanism of adolescent depressive patients.MethodsWe recruited 16 patients with depression in this study.All the patients were in accordance with American Diagnostic and Statistical Manual of Mental Disorders Fourth Edition(DSM-IV).All the patients had never
any treatment.Another 16 healthy controls served as controls.The two groups were similar in age and education.All subjects were right-handed.The thresholds of complex brain network construction were made with different correlation coefficients.ResultsThe brain neural network topology presented a relatively chaotic state in the first-episode medication-naive depressive adolescents compared with that in the healthy controls.The characteristics of small world network of brain decreased in the first-episode medication-naive depressive adolescents.The overall efficiency of neural network decreased,too.The value of the amygdala in topological structure was increased.Functional connections between brain areas such as the amygdala and the temporal cortex,the amygdala and the parietal cortex,the amygdala and the postcentral gyrus,prefrontal and inferior parietal lobules were increased.The increases of functional connections were positively correlated with the course of disease.In the resting state background,the values were increased in such areas as anterior cingulate cortex,dorsolateral prefrontal,prefrontal cortex medial segment,prefrontal segment,insular lobe,and temporal lobe cortex.ConclusionThe amygdale plays an important role in the occurrence and development of depression.Abnormality of neural network topology in the amygdala is the biological marker of depression susceptibility in adolescent depressive patients.There are multiple abnormal structures and functions in the brain in depressive patients.
adolescent;depression;functioning network;amygdale
R749.4
A
1671-8259(2014)05-0639-07
10.7652/jdyxb201405014
2014-03-10
2014-04-15
国家自然科学基金资助项目(No.81271487,81271546);陕西省自然科学基金资助项目(No.2013JM4002);西安交通大学第一附属医院新医疗新技术项目Supported by the National Natural Science Foundation of China(No.81271487,81271546)and the Natural Science Foundation of Shaanxi Province(No.2013JM4002);the New Medical Technology Project of the First Affiliated Hospital,Medical School of Xi'an Jiaotong University
高成阁,主任医师.E-mail:yaogaow@163.com
陈策(1972-),女(汉族),硕士,主治医师.研究方向:抑郁症的临床与基础研究.E-mail:chencesohu@sohu.com
时间:2014-07-22 18∶12 网络出版地址:http://www.cnki.net/kcms/detail/61.1399.R.20140722.1815.018.html
