大鼠孤束核内GABAA和GABAB受体对心脏伤害性感受相反的调控作用
2014-06-23刘晓华杨小立杜剑青
刘晓华,韩 曼,杨小立,杜剑青
(1.陕西中医学院生理教研室,陕西咸阳 712046;2.西安交通大学医学院第一附属医院疼痛科,陕西西安 710061;3.西安交通大学医学院生理学与病理生理学系,陕西西安 710061)
大鼠孤束核内GABAA和GABAB受体对心脏伤害性感受相反的调控作用
刘晓华1,韩 曼1,杨小立2,杜剑青3
(1.陕西中医学院生理教研室,陕西咸阳 712046;2.西安交通大学医学院第一附属医院疼痛科,陕西西安 710061;3.西安交通大学医学院生理学与病理生理学系,陕西西安 710061)
目的探讨大鼠孤束核(nucleus tractus solitarius,NTS)内GABAA和GABAB受体对心包内注射辣椒素诱发的心脏-躯体运动反射(cardiac-somatic motor reflex,CMR)的影响,以阐明NTS内GABA能神经元在心脏伤害性感受信息传递中的作用。方法雄性SD大鼠,以心包内注射辣椒素诱发的背斜方肌肌电(electromyogram,EMG)活动为CMR的观测指标。在该心脏伤害性感受模型的基础上,蝇蕈醇组、荷包牡丹碱组、巴氯芬组、CGP组分别在NTS内微量注射GABAA和GABAB受体激动剂或拮抗剂,观测各组给药前后辣椒素诱发EMG活动的情况。结果和给药前比较,NTS微量注射GABAA受体激动剂蝇蕈醇10或20 mmol,CMR均增加(P<0.05);注射拮抗剂荷包牡丹碱10 mmol后,CMR减少(P<0.05);注射GABAB激动剂蝇巴氯芬10或20 mmol,CMR均减少(P<0.05);注射GABAB拮抗剂CGP 10 mmol后,CMR增加(P<0.05)。结论NTS内GABAA和GABAB受体对心脏伤害性信息有相反的调控作用,GABAA有易化作用,而GABAB有抑制作用。
大鼠;孤束核;心脏伤害性刺激;GABA受体;心包内注射;辣椒素
位于延髓的孤束核(nucleus tractus solitarius,NTS)在心血管、呼吸以及胃肠道的初级感觉信息的整合和传递中有重要作用[1]。研究表明心包腔内给予疼痛诱发物质(bradykinin,BK)或者混合致痛剂明显增加了c-Fos免疫阳性细胞在NTS内的表达[2]。NTS内心脏传入纤维以谷氨酸作为兴奋性递质。γ-氨基丁酸(γ-aminobutyric acid,GABA)是中枢神经系统内主要的抑制性递质。GABA受体可分
为GABAA、GABAB和GABAC。其中GABAA、GABAB受体广泛分布于中枢神经系统,而GABAC受体则主要存在于视网膜和视觉通路中。GABA受体激活后通过Cl-内流增加(GABAA和GABAC受体)或K+外流增加(GABAB受体),引起突触后超极化而产生抑制性突触后电位。对NTS内GABA和谷氨酸能神经末梢的超微结构研究显示GABAA和GABAB受体和外周传入末梢有紧密的联系[3-4]。近期有研究表明,NTS内的GABAA和GABAB受体对谷氨酸的释放有相反的调控作用[5]。我们的前期研究表明,NTS内微量注射谷氨酸对心包内注射辣椒素诱发的心脏-躯体运动反射(cardiosomatic motor reflex,CMR)有明显的易化作用。因此,推测NTS内GABAA和GABAB受体对心脏伤害性感觉的调节作用不同。
本实验以心包内注射辣椒素诱发的背斜方肌肌电(electromyogram,EMG)活动为CMR的观测指标。在该心脏伤害性感受模型的基础上,NTS内分别微量注射GABAA和GABAB受体激动剂或拮抗剂,观测其对辣椒素诱发EMG活动的影响,探讨NTS内GABA受体在心脏伤害性感受传递和整合中的作用。
1 材料与方法
1.1 仪器和药品BL-420生物信号采集与分析系统、压力换能器(成都泰盟生物科技有限公司);蠕动泵(BT100-2J,保定兰格恒流泵有限责任公司);小动物呼吸机(DW3000-B型,淮北正华生物仪器设备有限公司);大鼠脑立体定位仪(日本Narishige公司);Olympus生物显微镜(BX51,日本Olympus公司)
辣椒素溶于吐温80和无水乙醇(按1∶1的比例混合)溶液中,配制成1×10-3g/m L的贮存液,实验时用生理盐水稀释到所需质量浓度1μg/m L。辣椒素、GABAA受体激动剂蝇蕈醇及拮抗剂荷包牡丹碱、GABAB受体激动剂巴氯芬及拮抗剂CGP52432 (CGP)购自英国Tocris公司。
1.2 手术健康、雄性SD大鼠40只,体质量260~ 330 g。实验动物称体质量并麻醉(戊巴比妥钠45~55 mg/kg,i.p)。暴露左侧背斜方肌,以记录背斜方肌EMG。气管插管并连接小动物呼吸机,颈动脉插管监测动脉血压,颈静脉插管以便在整个实验过程中维持戊巴比妥钠的麻醉[10~15 mg/(kg·h)]。实验中以动脉血压和瞳孔直径监测实验动物麻醉深度。
心包插管术:左侧第一到第三肋软骨处行开胸术,暴露胸腺。沿中线分离胸腺,暴露心包膜。在心包膜上开1个小孔,将长12~14 cm、远端有数个小洞的硅胶管(内径0.020 mm、外径0.037 mm)经此孔插入心包约2 cm,缝合胸腺和各层胸壁组织,以固定心包插管。
NTS内微量注射:大鼠固定于脑立体定位仪上,暴露枕部脑组织,在闩部水平去除硬脑膜和软脑膜。NTS内微量注射位点以写翮(第四脑室尾侧最后点)为零坐标(前囟后14.3 mm水平),左侧旁开0.5~0.8 mm,吻侧0~0.5 mm,脑表面下0.5~0.8 mm。微量注射使用尖端与玻璃微电极相连的0.5μL微量注射器(Hamilton,Reno,Nevada,USA),微电极尖端直径约50~100μm。NTS内微量注射量为0.1 μL,速度为0.1μL/30 s。
1.3 EMG活动的记录同芯电极以30°的角度插入左侧背斜方肌,心包内注射辣椒素同时记录其EMG信号,根据肌肉大小调节电极插入深度,一般约为1.5~1.7 mm。
1.4 动物分组及处理方法随机分为4组,每组n=10,各组大鼠NTS内分别微量注射相应物质。分别为蝇蕈醇组(蝇蕈醇10或20 mmol)、荷包牡丹碱组(荷包牡丹碱10 mmol)、巴氯芬组(巴氯芬10或20 mmol)、CGP组(CGP 10 mmol)。
手术完毕2~3 h,待动物稳定后记录EMG基线活动60 s,NTS内微量注射生理盐水0.1μL,15 min后,心包腔内注射辣椒素(0.655 nmol/0.2 mL)1 min后回抽并冲洗心包4~6次,同时记录EMG 60~65 s。
50 min后按不同分组,NTS内分别注射GABA受体激动剂或拮抗剂,15 min后,心包腔内注射辣椒素记录EMG 60~65 s,以观察药物对EMG活动的影响。根据以往研究,核团内注射GABA受体激动剂或拮抗剂的作用在50 min左右时消失[6-7],因此1 h后心包腔内注射辣椒素,观察EMG恢复情况。
1.5 组织学定位每只动物实验结束后,NTS微量注射位点原位微注射20 g/L膀胺天蓝0.1μL,以标记药物注射位点以及扩散范围。10 min后大鼠静脉内注射戊巴比妥钠(100 mg/kg)深麻,经左心室插管至升主动脉,先用50 m L生理盐水快速灌注冲洗血液,再用约200 m L的100 m L/L甲醛溶液灌流固定。灌流结束后取脑组织,放置于100 m L/L的甲醛固定液中室温固定4 h,再转移到200 g/L的蔗糖溶液中4℃沉糖48 h。待组织沉糖完全后进行冰冻切片,片厚30μm,行尼氏染色。显微镜下根据Paxinos and Watson大鼠脑图谱进一步确定注射位点(图1)。

图1 NTS内微量注射位点图Fig.1 Microinjection site in the NTS
1.6 数据统计与分析数据分析采用SPSS 10.0统计软件,EMG以反应中的放电单位总数计算,以NTS内注射生理盐水后的EMG反应为对照,将其定义为100%,计算注射药物后EMG变化的百分比。数据以均数±标准误表示,给药前后变化的比较采用重复测量设计资料的方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 NTS内微量注射GABAA受体激动剂对CMR的影响NTS联合部微量注射GABAA受体激动剂蝇蕈醇10和20 mmol,15~20 min后观察其对心包腔内注射辣椒素诱发的背斜方肌的EMG活动的影响。结果显示EMG分别为(143.9±10.2)%和(158.9±9.4)%,和给药前比较均有明显增加(P<0.05,表1,图2)。

表1 各组EMG活动变化的百分率Tab.1 Percentage of EMG activity changes in each group
2.2 NTS内微量注射GABAA受体拮抗剂对CMR的影响NTS内微量注射GABAA受体拮抗剂荷包牡丹碱10 mmol,以拮抗内源性GABA的功能,观察NTS内GABAA受体是否对心脏伤害性感受有紧张性调控作用。结果显示,EMG活动为(66.2±12.3)%,和给药前比较明显下降(P<0.05,表1,图2)。
2.3 NTS内微量注射GABAB激动剂对CMR的影响NTS联合部微量注射GABAB受体激动剂巴氯芬10和20 mmol,15~20 min后观察其对心包腔内注射辣椒素诱发的背斜方肌的EMG活动的影响。结果显示EMG分别为(45.2±10.6)%和(36.8± 14.3)%,和给药前比较均有明显的减少(P<0.05,表1,图2)。
2.4 NTS内微量注射GABAB拮抗剂对CMR的影响NTS内微量注射GABAB受体拮抗剂CGP 10 mmol,以拮抗内源性GABA的功能,观察NTS内GABAB受体是否对心脏伤害性感受有紧张性调控作用。结果显示,EMG活动为(143.2±15.3)%,和给药前比较明显增加(P<0.05,表1,图2)。
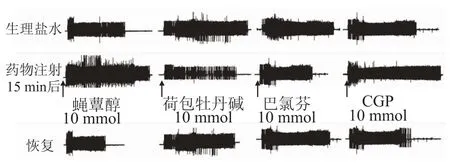
图2 各组药物对CMR影响的EMG变化Fig.2 Changes of EMG activities after intra-NTS injection of different drug
3 讨 论
以往研究表明心脏感觉传入神经纤维至少通过两条通路上传到中枢神经系统,即伴随心交感神经的传入纤维和伴随心迷走神经的传入纤维[8]。迷走传入神经纤维直接投射到位于延髓的NTS[9]。束路追踪研究表明心脏交感传入神经纤维在脊髓颈部和胸部背角换元后也有部分投射纤维终止于NTS[10-11]。免疫组织化学研究表明,心包内注射化学致痛剂可以诱发c-Fos在NTS内的表达[2]。这些结果提示NTS是心脏伤害性感觉信息传递的重要驿站。
内脏传入纤维在NTS内主要以谷氨酸为兴奋性神经递质。GABA作为中枢神经系统主要的抑制性中间神经元,对NTS内神经元的功能起重要的调节作用[12]。对NTS内GABA和谷氨酸能神经末梢的超微结构研究显示GABA能神经元和外周传入末梢有紧密的联系。电镜下发现,NTS内辣根过氧化物酶逆行追踪的迷走传入纤维与GABA免疫阳性神经元有突触联系[13];放射自显影技术研究表明NTS内GABAA受体在大鼠的迷走传入神经元的胞体和末梢均有表达[14]。激活突触前的GABAA受体即可以通过易化神经递质的释放也可以通过抑制神经递质的释放[15-16]。近期研究表明,NTS内的GABAA和GABAB受体对谷氨酸的释放有相反的调控作用,GABAA可以使谷氨酸能兴奋性突触后电位增加,而GABAB则使其减小[5]。这些结果提示NTS内的GABA能神经元可以通过对心脏感觉传入末梢谷氨酸释放的调控而实现对心脏伤害性感觉传递的调控。
在本实验中,NTS联合部微量注射选择性的GABAA和GABAB受体激动剂,对心包腔内注射辣椒素诱发的EMG反应产生相反的调控作用,GABAA受体的激活对心脏伤害性信息有明显的易化作用,而GABAB受体有明显的抑制作用。这一结果提示,GABA能神经元对心脏伤害性感觉的调控是双向的,根据作用的受体不同,产生不同的作用。我们以往的研究证明,NTS联合部注射谷氨酸对心脏伤害性感觉有易化作用[17],因此GABA能不同受体的作用,可能与其对谷氨酸释放的不同作用有关。GABAA的易化作用可能主要依赖于其对谷氨酸释放的易化作用,GABAB对NTS内谷氨酸释放的抑制进而使心脏伤害性信息的传递受到抑制。
为了进一步明确不同的GABA受体对心脏伤害性感受是否有紧张性调控作用。实验中单独注射受体拮抗剂,观察对心脏伤害性反射的影响。结果发现,和激动剂的效应一直,GABAA受体拮抗剂对心脏伤害性信息有明显的抑制作用,而GABAB受体有明显的易化作用。该项结果提示GABAA和GABAB受体在心脏伤害性信息的传递中均有紧张性调控作用。免疫组织化学研究表明[18],NTS内神经元的胞体和末梢均有GABA能免疫阳性表达。因此,对于NTS内GABA能神经元对谷氨酸递质释放的调控,是GABA能抑制性中间神经元的局部作用,还是GABA能下行投射纤维的作用,还需进一步证明。
[1]ANDRESEN MC,KUNZE DL.Nucleus tractus solitarius-gateway to neural circulatory control[J].Annual Rev Physiol,1994,56(6):93-116.
[2]ALBUTAIHI IAM,DEJONGSTE MJL,HORST TGJ.An integrated study of heart pain and behavior in freely moving rats (using Fos as a marker for neuronal activation)[J].Neurosignals,2004,13(5):207-226.
[3]ASHWORTH-PREECE M,KRSTEW E,JARROTT B,et al. Functional GABAAreceptors on rat vagal afferent neurones[J].Br J Pharmacol,1997,120(3):469-475.
[4]FAWLEY JA,PETERSJH,ANDRESEN MC.GABA(B)-mediated inhibition of multiple modes of glutamate release in the nucleus of the solitary tract[J].J Neurophysiol,2011,106(4):1833-1840.
[5]KANG YH,SUN B,PARK YS,et al.GABAAand GABABreceptors have opposite effects on synaptic gumtamate release on the nucleus tractus solitarii neurons[J].Neuroscience,2012,209(5):39-46.
[6]QU CL,TANG JS,JIA H.Involvement of GABAergic modulation of antinociception induced by morphine microinjected into the ventrolateral orbital cortex[J].Brain Res,2006,1073-1074(2):281-289.
[7]CATELLI JM,GIAKIS WJ,SVEF AF.GABAergic mechanisms in nucleus tractus solitarius alter blood pressure and vasopressin release[J].Brain Res,1987,403(2):279-289.
[8]FOREMAN RD.Mechanisms of cardiac pain[J].Annu Rev Physiol,1999,61(3):143-167.
[9]HISATA Y,ZEREDO JL,EISHI K,et al.Cardiac nociceptors innervated by vagal afferents in rats[J].Auton Neurosci,2006,126-127(1):174-178.
[10]KUO DC,ORAVITZ JJ,DEGROAT WC.Tracing of afferent and efferent pathways in the left inferior cardiac nerve of the cat using retrograde and transganglionic transport of horseradish peroxidase[J].Brain Res,1984,321(1):111-118.
[11]MENÉTREY D,BASBAUM AI.Spinal and trigeminal projections to the nucleus of the solitary tract:a possible substrate for somatovisceral and viscerovisceral reflex activation[J].J Comp Neurol,1987,255(3):439-450.
[12]BAILEY TW,APPLEYARD SM,JIN YH,et al,Organization and properties of GABAergic neurons in solitary tract nucleus(NTS)[J].J Neurophysiol,2008,99(4):1712-1722.
[13]MAQBOOL A,BATTEN TF,WILLIAM MPN.Ultrastructural relationship between GABAergic terminals and cardiac vagal preganglionic motoneurons and vagal afferents in the cat;a combined HRP tracing and immunogold labeling study[J].Eur J Neurosci,1991,3(6):51-53.
[14]MARK AP,ELENA K,BEVYN J,et al.Functional GABAAreceptors on rat vagal afferent neurons[J].Bri J Pharmacol,1997,120(3):469-475.
[15]RUIZ A,FABIAN-FINE R,SCOTT R,et al.GABAAreceptors at hippocampal mossy fibers[J].Neuron,2003,39(6):961-973.
[16]STELL BM,ROSTAING P,TRILLER A,et al.Activation of presynaptic GABA(A)receptors induces glutamate release from parallel fiber synapses[J].J Neurosci,2007,27(34):9022-9031.
[17]LIU XH,SUN N,DU JQ,et al,Chemical lesioning and glutamate administration reveal a major role for the nucleus tractus solitarius in the cardiac-somatic reflex in rats[J].Neuroscience,2012,207(4):326-332.
[18]FONG AY,STORNETTA RL,FOLEY CM,et al,Immunohistochemical localization of GAD67-expressing neurons and processes in the rat brainstem:subregional distribution in the nucleus tractus solitarius[J].J Comp Neurol,2005,493(2):274-290.
(编辑 国 荣)
GABAAand GABABreceptors oppositely modulate cardiac nociception in rat nucleus tractus solitarius
LIU Xiao-hua1,HAN Man1,YANG Xiao-li2,DU Jian-qing3
(1.Department of Physiology,Shaanxi University of Chinese Medicine,Xianyang 712046;2.Department of Pain,the First Affiliated Hospital,Medical School of Xi'an Jiaotong University,Xi'an 710061;3.Department of Physiology and Pathophysiology,Medical School of Xi'an Jiaotong University,Xi'an 710061,China)
ObjectiveTo explore the effects of GABAAand GABABreceptors in rat nucleus tractus solitarius (NTS)on cardiac-somatic motor reflex(CMR)induced by intra-pericardiac injection of capsaicin to clarify the role of GABAAand GABABreceptors in cardiac nociception.MethodsMale SD rats were used for recording spinotrapezius muscle electromyogram(EMG)activity induced by intra-pericardiac injection of capsaicin as the index of CMR.Intra-NTS microinjection of GABAAreceptor agonist or antagonist was given to muscimol,bicuculline,baclofen and CGP groups.Then we compared the changes of EMG activities before and after drug administration in each group.ResultsCMR increased after intra-NTS microinjection of GABAAreceptor agonist muscimol 10 or 20 mmol as compared with pre-drug administration(P<0.05).After injection of GABAAreceptor antagonist bicuculline 10 mmol,CMR decreased(P<0.05).After injection of GABABreceptor agonist baclofen 10 or 20 mmol,CMR decreased(P<0.05).Injection of GABABreceptor antagonist CGP made CMR increased(P<0.05).ConclusionGABAAand GABABreceptors oppositely modulate cardiac nociception in the rat NTS,with the former playing a facilitatory role and the latter playing an inhibitory role.
rat;nucleus tractus solitarius;cardiac nociception;GABA receptor;intra-pericardiac injection;capsaicin
R338.2
A
1671-8259(2014)05-0591-04
10.7652/jdyxb201405005
2014-01-21
2014-04-10
国家自然科学基金资助项目(No.31171068) Supported by the National Natural Science Foundation of China(No.31171068)
杜剑青,博士,教授,博士生导师.E-mail:dujianq@mail.xjtu.edu.cn
刘晓华(1980-),女(汉族),讲师,博士.研究方向:痛觉的神经生物学机制.E-mail:rosemadam@163.com
时间:2014-07-22 16∶13 网络出版地址:http://www.cnki.net/kcms/detail/61.1399.R.20140722.1613.002.html
