亚低温联合控制性液体复苏对失血性休克大鼠的影响
2014-06-19陈智峰
陈智峰
(常德市第一人民医院重症医学科,湖南常德415000)
·论著·
亚低温联合控制性液体复苏对失血性休克大鼠的影响
陈智峰
(常德市第一人民医院重症医学科,湖南常德415000)
目的 探索亚低温联合控制性液体复苏对失血性休克大鼠的影响。方法采用断尾法制备未控制创伤失血性休克大鼠模型,依造模第二阶段的不同处理方式分为对照组、常温常规复苏组、亚低温常规复苏组、常温控制性液体复苏组及亚低温+控制性液体复苏组,每组均为12只。记录各组大鼠的存活时间及24 h存活率;比较各组在造模第90 min的血气分析、血乳酸和红细胞压积(Hct)水平。结果低温控制液体复苏组较常温控制液体复苏组生存时间明显延长[(15.47±5.32)h vs(9.27±4.71)h,P<0.01)],常温控制液体复苏组24 h存活率为25%,低温控制液体复苏组为41.7%。低温控制性液体复苏组补液量最小,为(44.46±6.75)ml/kg,在造模90 min时有最高的PO2和最低血乳酸水平。结论亚低温联合控制性液体复苏可有效改善失血性休克大鼠的预后。
失血性休克;液体复苏;亚低温;大鼠
1 材料与方法
1.1 实验对象所有动物实验遵照《美国实验动物使用指引》的要求进行,选用健康清洁级SD雄性大鼠60只,体重(260.25±26.34)g,SD大鼠由中南大学湘雅医学院实验动物中心提供,饲养环境12 h光照/熄灯交替。所有动物在实验前晚禁食,自由饮水。
1.2 实验分组分为对照组、亚低温+常规复苏组、亚低温+控制性液体复苏组及常温+常规复苏组和常温+控制性液体复苏组,每组均为12只,各组区别在于在造模第二阶段出血控制前的复苏处理不同,对照组未行任何特殊治疗,亚低温组通过体表降温控制肛温维持于(34.0±0.5)℃,常温组用红外灯体表照射控制肛温维持于36℃~37℃,控制性液体复苏组通过液体复苏将平均动脉压(MAP)维持于50~60 mmHg,常规复苏组则维持MAP于70~80 mmHg。
1.3 模型建立参照Capone等[7]采用断尾的方法,制备未控制创伤失血性休克大鼠模型。10%水合氯醛以0.32 ml/100 g腹腔注射麻醉,仰卧固定于鼠板上,后每隔1 h予以追加半量维持麻醉。24 G静脉留置针留置股动脉、股静脉,接高敏压力换能器监测有创动脉压,多导生理记录仪(成都泰盟BL-420s)记录心电、血压。实验分为四个阶段。第一阶段急性创伤失血期(0~30 min):通过股动脉分次采血,间隔5 min,第1、2次按1 ml/100 g,第3、4次按0.5 ml/100 g进行采血,采集血液置于肝素化的储血瓶中备用。第4次采血后5 min,距大鼠尾根部25%断尾用肝素棉签擦拭断端以防结痂,造成活动性出血,完成后大鼠血压<40 mmHg;第二阶段创伤出血+急救期(31~90 min):维持尾部持续出血状态,通过输液泵泵入林格氏液与羟乙基淀粉(贺斯)的混合复苏液(比例为1:2),泵入速度150 ml/kg·h开始,达到各组复苏目标后减速稳定于目标压力,对照组此阶段不行特殊处理;第三阶段手术止血+治疗期(91~210 min):大鼠断尾根部用4号丝线结扎,然后用云南白药敷在断尾末端,无菌纱布加压包扎,同时进行自体血液回输和输液等措施,使MAP≥90 mmHg;第四阶段:观察期(211 min~24 h):动物归笼,自由饮水、进食,观察存活时间。
1.4 观察指标观察终点为造模后24 h,记录各组大鼠的存活时间及24 h存活率,比较各组在第二阶段限制性液体复苏期间达到目标复苏压力所需的补液量。在第二阶段末(第90分钟)采股动脉血行血气分析、血乳酸和红细胞压积(Hct)测定(美国雅培便携式血气分析仪i-STAT 300),抽取血样0.3 ml,每次抽血后立即回输同体积的血液加以补充。
1.5 统计学方法采用SPSS15.0软件包进行统计分析,计量资料以均数±标准差(±s)表示。多组间同一参数比较采用One-way ANOVA分析,组间两两比较采用LSD检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组存活情况对照组存活时间最短,为(3.07±1.54)h,低温常规复苏组较常温常规复苏组生存时间稍长[(7.26±2.53)h vs(5.64±2.14)h],低温控制液体复苏组较常温控制液体复苏组生存时间明显延长[(15.47±5.32)h vs(9.27±4.71)h,P<0.01],常温控制液体复苏组25%(3/12)存活至24 h,低温控制液体复苏组41.7%(5/12)存活至24 h,见表1。
2.2 各组第二阶段补液量在各个液体复苏组中,控制性液体复苏组二阶段补液量均明显低于相同温度常规复苏组,而低温复苏组补液量均低于常温相同复苏压力目标组,组间比较有统计学意义(P<0.01或P<0.05),其中常温常规复苏组所需补液量最大,为(64.42±8.14)ml/kg,低温控制性液体复苏组补液量最小,为(44.46±6.75)ml/kg,见表1。
2.3 各组血气及血乳酸各组存活至90 min行血气分析的大鼠数目如表2所示,与对照组比较各复苏组pH、动脉血氧分压(PO2)、乳酸水平均明显改善,Hct则明显下降(P<0.01或P<0.05),动脉血二氧化碳分压(PCO2)各种差异无统计学意义,均存在一定程度过度通气,低温控制性液体复苏组有最佳PO2和最低血乳酸水平,见表2。
表1 各组存活情况及第二阶段补液量比较(±s)
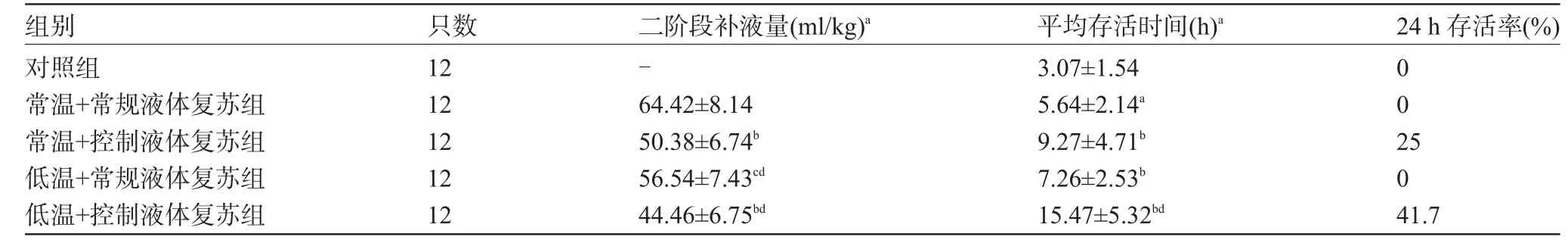
表1 各组存活情况及第二阶段补液量比较(±s)
注:组间比较ANOVA分析,aP<0.01;LSD检验与常温常规复苏组或对照组比较,bP<0.01,cP<0.05;不同温度组相同复苏目标组比较,dP<0.01。
表2 各组血气及乳酸、Hct指标比较(±s)
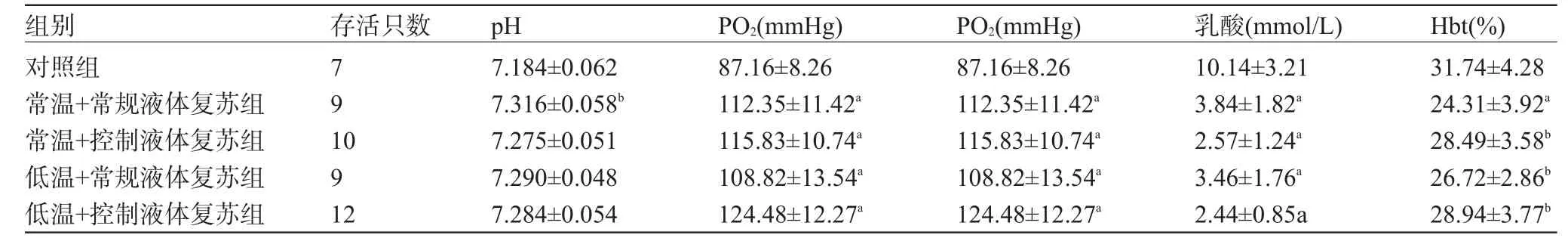
表2 各组血气及乳酸、Hct指标比较(±s)
注:与对照组比较LSD检验,aP<0.01,bP<0.05。
3 讨论
对于未控制的创伤性失血性休克,液体复苏是最重要的治疗手段,但早期积极大量的补液以维持正常血压会造成严重的血液稀释、血凝块脱落及血小板消耗,使得出血量增加,从而增加死亡的风险[8],故控制性液体复苏已被公认为是解决未控制的失血性休克的早期处置方法,在出血得到控制前将MAP维持于50~60 mmHg可大大提高复苏成功率[2-3]。而在脑复苏领域,亚低温的作为也已得到了证实,可减轻心跳骤停[4-5]或脑外伤[9]患者的存活率。但是在创伤领域,低温的作用仍不明确[10],传统观念认为低温可影响酶的活性,并导致凝血功能障碍[11],加重器官损害。而近期的诸多研究证实,亚低温可抑制心肌细胞凋亡[12],并不会造成创伤失血动物模型肠道细菌移位[13],最终可增加创伤出血动物模型的存活率[14],故亚低温联合控制性液体复苏对创伤失血性休克可能会有更好的保护作用。
我们利用断尾法制备未控制创伤失血性休克大鼠模型,通过前期血管内采血及断尾损伤使总失血量达大鼠总血容量的45%以上,休克时平均动脉压降至40 mmHg以下,属重度失血性休克动物模型。造模过程通过4个阶段较好地模拟了急性创伤失血期、院外急救复苏期、院内手术治疗期及术后恢复观察期整个过程。通过第二阶段不同复苏目标的干预,模拟创伤患者在进行手术治疗前的紧急处理过程。本研究证实,在对失血性休克大鼠行液体复苏时控制MAP维持于50~60 mmHg较常规液体复苏维持MAP 70~80 mmHg有更好的生存率,而单纯亚低温处理较常温组比较也有一定的保护作用,亚低温联合控制性液体复苏不仅可以进一步减少出血量,从而减少复苏阶段液体需求,而且可以改善血气状态,降低第二阶段末期乳酸水平,从而增加生存率。
与脑复苏不同,创伤的亚低温处理更强调短期、轻度[15],本研究仅在造模第二阶段进行短时亚低温干预,即在进行手术止血前与液体复苏同步进行,而且温度控制为34℃左右,在这一核心温度下并不会对机体凝血功能造成影响[16]。亚低温可通过体表冰袋降温、静注低温液体及血管内降温等方式便捷实现,而各种降温方式间的区别及最佳的亚低温维持时间仍有待于我们进一步研究。
[1]Esposito TJ,Sanddal TL,Reynolds SA,et al.Effect of a voluntary trauma system on preventable death and inappropriate care in a rural state[J].J Trauma,2003,54(4):663-670.
[2]Li T,Zhu Y,Fang Y,et al.Determination of the optimal mean arterial pressure for postbleeding resuscitation after hemorrhagic shock in rats[J].Anesthesiology,2012,116(1):103-112.
[3]Li T,Zhu Y,Hu Y,et al.Ideal permissive hypotension to resuscitate uncontrolled hemorrhagic shock and the tolerance time in rats[J]. Anesthesiology,2011,114(1):111-119.
[4]胡春林.心跳骤停心肺复苏后亚低温治疗的荟萃分析[J].中华生物医学工程杂志,2009,15(2):135-140.
[5]Safar PJ,Kochanek PM.Therapeutic hypothermia after cardiac arrest[J].N Engl J Med,2002,346(8):612-613.
[6]Yang X,Hachimi-Idrissi S,Nguyen DN,et al.Effect of resuscitative mild hypothermia and oxygen concentration on the survival time during lethal uncontrolled haemorrhagic shock in mechanically ventilated rats[J].Eur J Emerg Med,2004,11(4):210-216.
[7]Capone A,Safar P,Stezoski SW,et al.Uncontrolled hemorrhagic shock outcome model in rats[J].Resuscitation,1995,29(2): 143-152.
[8]Bickell WH,Wall MJ Jr,Pepe PE,et al.Immediate versus delayed fluid resuscitation for hypotensive patients with penetrating torso injuries[J].N Engl J Med,1994,331(17):1105-1109.
[9]Qiu W,Shen H,Zhang Y,et al.Noninvasive selective brain cooling by head and neck cooling is protective in severe traumatic brain injury[J].J Clin Neurosci,2006,13(10):995-1000.
[10]Kheirbek T,Kochanek AR,Alam HB.Hypothermia in bleeding trauma:a friend or a foe[J].Scand J Trauma Resusc Emerg Med,2009, 17:65.
[11]Reed RL 2nd,Johnson TD,Hudson JD,et al.The disparity between hypothermic coagulopathy and clotting studies[J].J Trauma,1992, 33(3):465-70.
[12]Shuja F,Tabbara M,Li Y,et al.Profound hypothermia decreases cardiac apoptosis through Akt survival pathway[J].J Am Coll Surg, 2009,209(1):89-99.
[13]Deniz T,Agalar C,Ozdogan M,et al.Mild hypothermia improves survival during hemorrhagic shock without affecting bacterial translocation[J].J Invest Surg,2009,22(1):22-28.
[14]George ME,Mulier KE,Beilman GJ.Hypothermia is associated with improved outcomes in a porcine model of hemorrhagic shock[J].J Trauma,2010,68(3):662-668.
[15]Li T,Lin X,Zhu Y,et al.Short-term,mild hypothermia can increase the beneficial effect of permissive hypotension on uncontrolled hemorrhagic shock in rats[J].Anesthesiology,2012,116(6):1288-1298.
[16]Brohi K,Cohen MJ,Ganter MT,et al.Acute coagulopathy of trauma:hypoperfusion induces systemic anticoagulation and hyperfibrinolysis[J].J Trauma,2008,64(5):1211-1217.
Effect of hypothermia combined with controlled fluid resuscitation on hemorrhagic shock in rats.
CHEN Zhi-feng.Intensive Care Unit,the First People's Hospital of Changde,Changde 415000,Hunan,CHINA
ObjectiveTo explore the effects of hypothermia combined with controlled fluid resuscitation for uncontrolled hemorrhagic shock in different ages of rats.MethodsSixty rats were divided into control group,conventional resuscitation group,mild hypothermia resuscitation group,controlled fluid resuscitation group and hypothermia+controlled fluid resuscitation group by different treatment in the second phase of uncontrolled hemorrhagic-shock model,with 12 rats in each group.We recorded the survival time and 24 h survival rate of rats in each group and compared the blood gas analysis,blood lactate and hematocrit(Hct)level in each group at 90 min of model.ResultsHypothermia+controlled fluid resuscitation group had a significantly longer survival time than the controlled fluid resuscitation group,(15.47±5.32)h vs(9.27±4.71)h,P<0.01.The 24 h survival rate was 25%in the controlled fluid resuscitation group and 41.7%in the Hypothermia+controlled fluid resuscitation group.Hypothermia+controlled fluid resuscitation group had a minimum amount of fluid[(44.46±6.75)ml/kg]and had a highest PO2and lowest blood lactate levels at 90 min of model.ConclusionMild hypothermia combined with controlled fluid resuscitation can effectively improve the prognosis in rats with hemorrhagic shock.
Hemorrhagic shock;Fluid resuscitation;Mild hypothermia;Rat
R-332
A
1003—6350(2014)21—3133—03
10.3969/j.issn.1003-6350.2014.21.1230
陈智峰。E-mail:476914767@qq.com利于改善预后[2-3]。而在心肺脑复苏领域,亚低温的器官保护作用已得到证实[4-5],有研究发现短时亚低温也可对创伤失血性休克产生保护作用[6],故本研究拟探索亚低温联合控制性液体复苏对失血性休克大鼠的影响。
2014-03-24)
创伤失血性休克是临床上常见的危重症之一,据统计,创伤性死亡原因中66%~80%是由于出血性休克,而有15%~20%的死亡是可以避免的[1]。除了早期包扎、固定、止血外,液体复苏是非常重要的治疗手段。目前普遍认为在活动性失血未得到控制的情况下通过限制性液体复苏将平均动脉压(MAP)维持在50~60 mmHg(1 mmHg=0.133 kPa)的目标水平更有
