RP-HPLC法测定他克莫司聚酸酐纳米制剂中他克莫司的含量
2014-06-15潘小磊关吉斌
张 栋,潘小磊,2,王 尚,关吉斌,孙 进*
(1.沈阳药科大学 药学院,辽宁 沈阳 110016; 2.弗吉尼亚州立邦联大学 药物制剂系,美国 弗吉尼亚州)
RP-HPLC法测定他克莫司聚酸酐纳米制剂中他克莫司的含量
张 栋1,潘小磊1,2,王 尚1,关吉斌1,孙 进1*
(1.沈阳药科大学 药学院,辽宁 沈阳 110016; 2.弗吉尼亚州立邦联大学 药物制剂系,美国 弗吉尼亚州)
目的建立他克莫司聚酸酐纳米制剂的含量测定方法。方法 采用RP-HPLC法。色谱柱为以十八烷基硅烷键合硅胶为填充剂的Kromasil-C18柱(250 mm×4.6 mm, 5 μm),流动相为乙腈-水(体积比为90:10),流速为1.0 mL·min-1,检测波长为216 nm,柱温为60℃,进样量为20 μL。对3批自制他克莫司聚酸酐纳米制剂进行含量测定。结果 他克莫司在 2.0~200.4 mg·L-1内与吸收峰面积呈良好的线性关系 (r=0.999 9),回归方程为 A=12 530 ρ-1 641.4,最低定量限为0.5 mg·L-1,平均回收率 (n=9) 为100.1%,RSD为1.18%。3批自制他克莫司聚酸酐纳米制剂的含量分别为866.3、876.3、878.3 mg·L-1。结论 该方法可用于测定他克莫司聚酸酐纳米制剂的含量。
药剂学;他克莫司;聚酸酐纳米制剂;反相高效液相色潽法;含量测定
他克莫司(tacrolimus, 简称FK-506)是由日本于1979年在从链霉菌株(Streptomyces tssukubaensis)中分离而得的23元大环内酯类抗生素酵产物,具有强力的免疫抑制作用[1]。他克莫司目前作为一线免疫抑制剂,主要用于降低一些器官移植手术后患者的免疫排斥反应,也可用于一些自身免疫性疾病的治疗。上市的他克莫司主要剂型为软膏剂、胶囊剂和注射剂。关于前两者中他克莫司含量测定的方法已有报道[2-3],但有以下不足:流动相成分复杂(正己烷-正丁基氯-乙腈)或(乙腈-水-磷酸)以及分析时间长(28 min)等。此外,关于新剂型他克莫司混悬液中他克莫司含量的测定方法也有报道[4],该方法对高效液相色谱系统的损耗严重(柱温:65℃,流速:1.5 mL·min-1),不宜长时间应用。他克莫司存在生物利用度低和个体差异显著的问题,本文作者将其制成聚酸酐纳米粒,旨在改善这一情况,并建立了反相高效液相色潽法用于聚酸酐纳米粒中他克莫司含量的测定,该方法简便易行,为纳米粒的质量控制提供依据,保证各批次间纳米制剂质量的一致性,排除进一步试验中因制剂因素引入的误差。他克莫司的结构式见图1。

图 1 他克莫司的化学结构式Fig. 1 Structure of tacrolimus
1 仪器与材料
高效液相色谱仪(配有L-2130泵、L-2400紫外可见检测器、D-2000 Elite色谱工作站,日立Hitachi公司),Adventurter 电子分析天平(美国Ohaus公司),UV-1800 紫外分光光度计(北京瑞利分析仪器公司),SZ-96 自动纯水蒸馏器(上海亚荣生化仪器厂)。
他克莫司(纯度质量分数> 99%,批号为090602,成都川抗万乐药业有限公司),他克莫司聚酸酐纳米制剂(自制,批号为 130706-130708),空白聚酸酐纳米制剂(自制),乙腈(色谱纯,天津康科德化学试剂公司),水为重蒸水。
2 方法与结果
2.1 检测波长的选择
精密称量他克莫司20.0 mg,置于100 mL 量瓶中,用乙腈溶解并稀释至刻度,作为他克莫司储备液。在200~400 nm 波长范围内进行紫外波谱扫描,记录紫外吸收光谱。结果表明,他克莫司在208 nm 处有最大吸收。但是由于选用溶剂乙腈在此处存在末端吸收,干扰测定,综合考虑溶剂干扰和检测灵敏度,选择216 nm 为液相检测波长。紫外扫描图谱见图2。

图 2 他克莫司(A)和乙腈(B)的紫外扫描图Fig. 2 UV-spectrum of tacrolimus (A) and acetonitrile (B)
2.2 色谱条件
色谱柱:以十八烷基硅烷键合硅胶为填充剂的Kromasil-C18柱(250 mm×4.6 mm, 5 μm),流动相:乙腈-水(体积比为90:10),流速:1.0 mL·min-1,检测波长:216 nm,柱温:60℃,进样量:20 μL。
理论塔板数按他克莫司计算应不低于2 000,拖尾因子应在0.8~1.2内。
2.3 对照溶液的制备
精密移取他克莫司储备液适量于10 mL量瓶中,加溶剂(V(乙腈):V(水)= 7:3)稀释至刻度,摇匀,室温放置3 h后,得到质量浓度为60 mg·L-1的对照溶液。
2.4 供试溶液的制备
精密量取他克莫司聚酸酐纳米制剂0.5 mL, 置10 mL量瓶中,加溶剂(V(乙腈):V(水)= 7:3)破乳并稀释至刻度,摇匀,滤过,室温放置3 h后,作为供试溶液。
2.5 空白样品溶液的制备
精密量取空白聚酸酐纳米制剂0.5 mL, 置10 mL量瓶中,加溶剂(V(乙腈):V(水)= 7:3)破乳并稀释至刻度,摇匀,滤过,室温放置3 h后,作为空白样品溶液。
2.6 系统适用性试验
精密量取对照溶液20 μL注入液相色谱仪,连续重复6次,计算相应的理论塔板数和拖尾因子,结果见表1。

表1 系统适用性结果 (n=9)Table 1 Results of system suitability(n=9)
2.7 专属性考察
分别将对照溶液、供试溶液和空白样品溶液注入高效液相色谱仪,根据“2.2”条色谱条件进行测定,记录色谱图,见图3。由图可见,辅料对主药峰没有干扰,方法专属性良好。
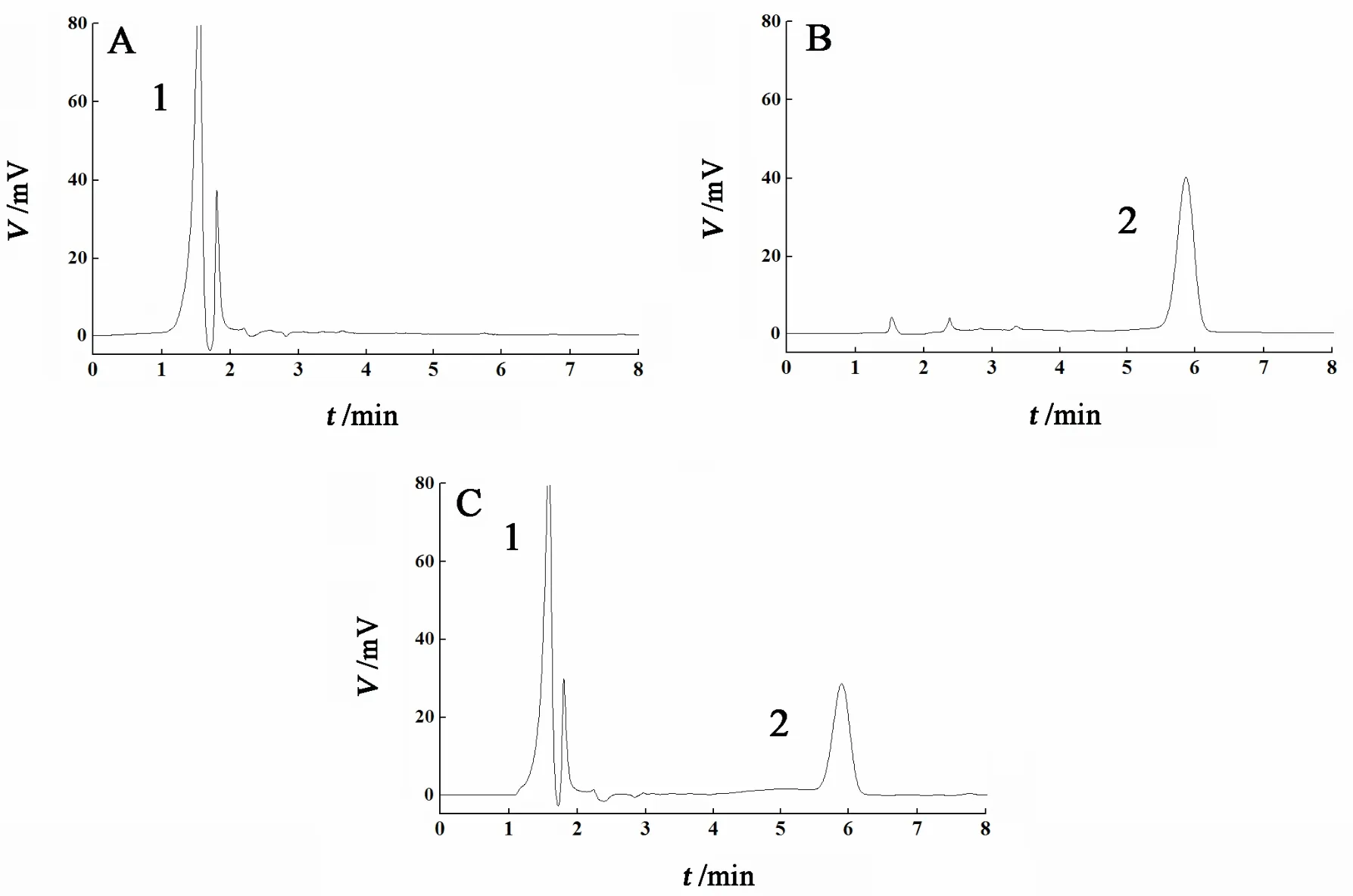
图 3 空白样品溶液(A)、对照溶液(B)和供试品溶液(C)的色谱图Fig. 3 Chromatograms of blank excipient solution (A), tacrolimus standard solution (B) and tacrolimus sample solution (C)
2.8 最低定量下限
取他克莫司储备液稀释得到系列他克莫司标准溶液,注入高效液相色谱仪,记录色谱图。另将溶剂(V(乙腈):V(水)= 7:3)注入高效液相色谱仪,检测基线的噪音。将峰高为基线噪声10 倍的标准溶液的他克莫司浓度作为本方法可测定的最低定量下限,见图4,最低定量下限为0.5 mg·L-1。

图 4溶剂(V(乙腈):V(水)= 7:3)(a)和最低定量下限(b)的色谱图Fig. 4 Chromatograms of solvent(V(acetonitrile):V(water)=7:3) (a) and lower limit of quantitation (LLOQ) (b)
2.9 标准曲线的制备
精密移取“2.1”条中制得的他克莫司储备液0.1、0.5、2.0、3.0、5.0、7.5 mL置于10 mL量瓶中,用溶剂(V(乙腈):V(水)= 7:3)稀释至刻度,摇匀,制备质量浓度分别为2.0、10.0、40.1、60.1、100.2、150.3、200.4 mg·L-1的系列标准溶液。室温放置3 h后,分别取上述溶液20 μL,进行测定,记录色谱峰面积。以测得峰面积A为纵坐标,以他克莫司质量浓度ρ/ (mg·L-1)为横坐标,绘制标准曲线,计算得到回归方程:A=12 530 ρ-1 641.4,r=0.999 9。结果表明,他克莫司在2.0~200.4 mg·L-1内与吸收峰面积呈良好的线性关系。
2.10 精密度试验
取上述浓度为60 mg·L-1的他克莫司标准溶液,室温放置3 h后,精密量取20 μL注入液相色谱仪,连续重复6次,记录色谱峰面积,计算得到6次峰面积值RSD为1.02%,小于2%。结果表明,色谱系统仪器精密度良好。
2.11 回收率试验
分别精密称量他克莫司约8、10、12 mg各3份,置50 mL量瓶中,加入乙腈溶解并稀释至刻度,得到3个浓度的母液共9份;精密移取上述母液各3 mL分别加入至含有空白聚酸酐纳米制剂0.5 mL的10 mL量瓶中,用溶剂(V(乙腈):V(水)= 7:3)稀释至刻度,摇匀,滤过,作为供试样品。另取质量浓度为60 mg·L-1的他克莫司标准溶液作为对照样品。室温放置3 h后,分别取供试样品和对照样品各20 μL注入高效液相色谱仪,记录峰面积。按外标法以峰面积计算样品浓度,并计算平均回收率和相对标准偏差。结果见表2。

表2 回收率实验结果 (n=9)Table 2 Recoveries of samples(n=9)
2.12 稳定性试验
精密移取“2.1”条中制得的他克莫司储备液适量,分别用溶剂(V(乙腈):V(水)= 7:3)和纯乙腈稀释得到浓度为60 mg·L-1的他克莫司标准溶液,室温放置10 h,分别于0、2、4、6、8、10 h进样20 μL,记录峰面积A,结果图5。结果表明,溶剂(V(乙腈):V(水)= 7:3)稀释得到的标准液的峰面积在0~2 h内有6%的降低,之后的8 h之内峰面积变化率小于2%,而纯乙腈稀释得到的标准液的峰面积在10 h内峰面积变化率小于2%,考虑到纳米粒溶液中水的存在难以避免,对照溶液应使用溶剂(V(乙腈):V(水)= 7:3)进行稀释并室温放置3 h后使用,提高测定准确性。
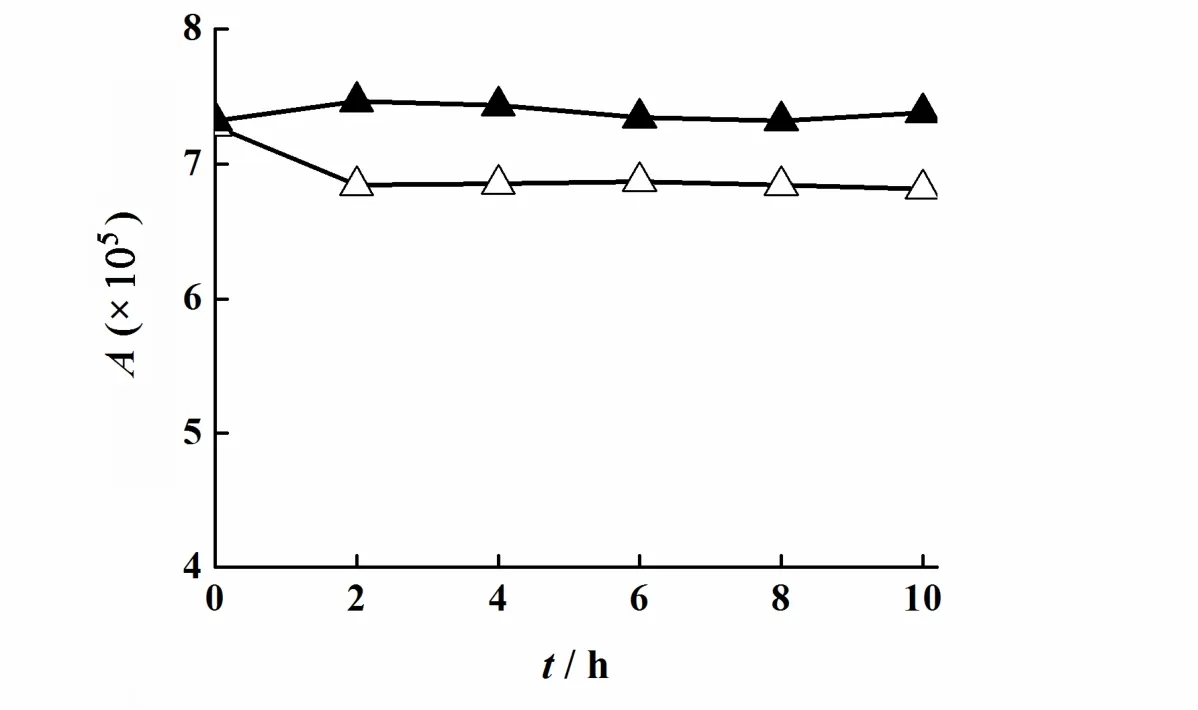
图 5 他克莫司在乙腈和溶剂(V(乙腈):V(水)= 7:3)中的稳定性Fig. 5 The stability of tacrolimus in acetonitrile and solvent (V(acetonitrile):V(water)=7:3)
2.13 重复性试验
精密量取他克莫司聚酸酐纳米制剂(批号为130706)0.5 mL,按照“2.4”条制备供试溶液,平行操作6次,按“2.2”条色谱条件分别进样分析,记录色谱峰面积。计算聚酸酐纳米制剂中他克莫司含量的RSD为0.78%,表明本方法重复性良好。
2.14 样品含量测定
精密量取他克莫司聚酸酐纳米制剂(批号为130706-130708)各0.5 mL,按照“2.4”条制备供试溶液,平行操作6次,按“2.2”条色谱条件分别进样分析,记录色谱峰面积。外标法计算3批他克莫司聚酸酐纳米制剂中药物的含量,结果分别为866.3、876.3、878.3 mg·L-1,RSD为0.73%,可见不同批次制得纳米制剂的含量几近相同,质量可控。
3 讨论与结论
作者建立了一种可操作性强,实验成本低的高效液相色谱法用于他克莫司聚酸酐纳米制剂的含量测定,该方法采用简单的乙腈水二元系统,并将柱温设定为60℃,可以保证他克莫司较高的理论塔板数,提高方法的实际应用价值。对方法的专属性、最低定量限、线性、精密度、准确度、重复性以及稳定性进行了方法学验证,除稳定性外,其他考察指标均符合要求。由稳定性试验可知,水分的存在会导致他克莫司发生异构体转化,使含量降低。但鉴于样品制备中水的存在难以避免同时选择乙腈-水(体积比为7:3)做为破乳剂,可以使纳米结构充分破坏,药物释放完全并全部溶解在溶剂中,减少药物的损失,因此,最终选择乙腈-水(体积比为7:3)为溶剂。为降低他克莫司异构体转化引入的误差,要求对照溶液和样品溶液均需室温放置3 h后测定,使操作规范化,可有效地控制他克莫司聚酸酐纳米制剂的质量。
[1] BOWMAN L J, BRENNAN D C. The role of tacrolimus in renal transplantation [J]. Expert Opin Pharmacother, 2008, 9 (4): 635-643.
[2] 李国辉, 李磊, 张厚才, 等. HPLC检测他克莫司软膏剂中他克莫司的含量[J]. 成都医学院学报, 2011, 6(2): 150-152.
[3] 刘冰冰, 朱克旭. HPLC法测定他克莫司胶囊的含量[J]. 安徽医药, 2008, 12(8): 693-694.
[4] LABBERTON L, HERDER R E, BOLHUIS M S. Formulation of a tacrolimus suspension with an extended expiry date in a hospital pharmacy [J]. Practice Research & Innovation, 2011, 7(6): 36-40.
Determination of content of tacrolimus in polyanhydride nanoparticles by RP-HPLC
ZHANG Dong1, PAN Xiao-lei1,2, WANG Shang1, GUAN Ji-bin1, SUN Jin1*
(1. School of Pharmacy, Shenyang Pharmaceutical University, Shenyang 110016, China; 2. Department of Pharmaceutics, Virginia Commonwealth University, Virginia, USA)
ObjectivesTo establish an RP-HPLC method for the determination of tacrolimus in polyanhydride nanoparticles. Methods RP-HPLC method was adopted. Kromasil-ODS (250 mm×4.6 mm, 5 μm)column was used. The mobile phase consisted of acetonitrile-water (V:V=90:10). The flow rate was1.0 mL·min-1and the detection wavelength was set at 216 nm. The column temperate was 60℃. The sample volume was 20 μL. The contents of tacrolimus in 3 batches polyanhydride nanoparticles were determined. Results Good linear correlation (r=0.999 9) between peak areas (A) and concentration (ρ) of tacrolimus ranging from 2.0 to 200.4 mg·L-1was obtained, and the calibration curve was A=12 530 ρ-1 641.4. The lower limit of quantitation (LLOQ) for tacrolimus was 0.5 mg·L-1. The average recovery was 100.1% (n=9) and RSD was 1.18%. The contents of tacrolimus in 3 batches of polyanhydride nanoparticles were 866.3,876.3,878.3 mg·L-1, respectively. Conclusions RP-HPLC method established here was competent for the assay of tacrolimus in polyanhydride nanoparticles.
pharmaceutics; tacrolimus; polyanhydride nanoparticles; RP-HPLC; content determination
R94
A
(2014)01–0010–07
(本篇责任编辑:吕向一)
2013–12–16
张栋(1988-), 男(汉族), 辽宁海城人, 硕士研究生, E-mail zhangdong328@126.com;*通讯作者:孙进(1975-), 男(汉族), 安徽金寨人, 教授, 主要从事药剂学研究, Tel. 024-23986325, E-mail sunjin66@21cn.com。
