Na2CrO4-NaOH-H2O体系中Na2CrO4蒸发结晶工艺研究*
2014-06-11刘欢张炳烛田颖张小飞张洋徐红彬张懿
刘欢 ,张炳烛 ,田颖 ,张小飞 ,张洋 ,徐红彬 ,张懿
(1.河北科技大学化学与制药工程学院,河北石家庄050018;2.中国科学院过程工程研究所湿法冶金清洁生产技术国家工程实验室;3.中国科学院绿色过程与工程重点实验室)
现行铬盐生产工艺根据铬铁矿与碱的反应方式可分为焙烧法工艺和液相法工艺[1]。针对国内焙烧法工艺存在的铬资源利用率低、铬渣污染严重等问题[2-3],中国科学院过程工程研究所开发了亚熔盐液相氧化法铬盐清洁工艺[4-6]。目前以氢氧化钾为反应介质的钾系亚熔盐法铬盐清洁工艺已在河南义马建成了万吨级示范装置并实现连续稳定运行[7-8],以氢氧化钠为反应介质的钠系亚熔盐法铬盐清洁工艺已完成实验室开发。钠系亚熔盐液相氧化法制备铬酸钠的工艺流程[9]:铬铁矿在NaOH溶液中加压氧化分解后,铬铁矿中的三价铬被氧化成六价铬并以Na2CrO4的形式进入系统,铝以NaAlO2形式进入系统。将浸取后得到的浆料降温后进行首次固液分离,可得到含Na2CrO4粗晶的浸取渣和浸取液。将浸取渣加水溶解后再次固液分离,得到的溶解液首先通过添加氧化钙脱除少量的Al和Si杂质,再通过蒸发盐析结晶的方法分离出Na2CrO4晶体;首次浸取液和蒸发结晶母液返回反应体系中循环使用,再次参加与铬铁矿的浸取反应。因蒸发结晶工艺过程获得的Na2CrO4晶体的质量,将直接影响下游产品转化过程所制备的重铬酸钠、铬酸酐、氧化铬等铬盐产品的质量,因此对Na2CrO4晶体的质量控制成为了上述工艺过程的关键环节。
邹兴等[10]研究了 30~110 ℃下 Na2CrO4-NaOHH2O体系的溶解度等温线,发现在NaOH质量浓度<550 g/L时,Na2CrO4溶解度随温度变化不大,适合采用蒸发结晶的方法分离。如采用常压蒸发结晶工艺,具有操作温度较高、对蒸发器的材质要求较高且容易结垢等问题,而真空蒸发结晶工艺则兼有流程简单、耗能低、产品质量好等优势[11]。笔者通过对Na2CrO4-NaOH-H2O体系相图的分析,研究了Na2CrO4的真空蒸发盐析结晶工艺,确定了最优化操作条件,为工业生产过程提供技术指导。
1 相图分析
在水盐体系分离中,常用相图来确定生产流程和探讨最佳的生产条件[12]。由30~110℃的Na2CrO4-NaOH-H2O 体系溶解度等温线[10]可知:在 60~95 ℃时的Na2CrO4-NaOH-H2O体系溶解度数据变化不大,并且也没有物相的变化。因此笔者针对90℃的Na2CrO4-NaOH-H2O体系相图做了研究,以此温度相图(图1)为例,通过分析相图可找到合适的结晶终点。

图1 90℃时Na2CrO4-NaOH-H2O体系相图
由图1可知,aEb为饱和液相线,aE为NaOH的液相饱和线,bE为Na2CrO4液相饱和线。E点为NaOH、Na2CrO4的共饱和点。而aOb为不饱和区域,bEB为Na2CrO4的结晶区域,aEA为NaOH结晶区域,AEB为NaOH、Na2CrO4的共结晶区。通过分析发现,结晶液原始组成在m1点,因此该点为起始溶液的组成点,在90℃下等温蒸发时,体系m1中的水将逐渐减少,而NaOH、Na2CrO4的比例不会发生变化,溶液在蒸发过程中,系统点m1沿Om1向背离O点的方向移动,当移至m2点时,铬酸钠晶体开始析出;当移动到m3点时,若继续蒸发,体系开始进入NaOH、Na2CrO4共结晶区,会有NaOH析出,影响晶体纯度,所以理论上应选取m3点为结晶终点,此时相对于1 050 g结晶初始液,根据杠杆规则算得蒸发水量约为670 mL,液相碱质量浓度约为868 g/L,结晶率约为92%。考虑到终点碱浓度过高,黏度较大,会影响过滤效果,并且液相夹带严重,因此可适当减少蒸发水量以降低液相碱浓度。实验中选取m4为结晶终点,算得蒸发水量约为590 mL,液相碱质量浓度约为650 g/L,结晶率约为83.5%。经由X射线衍射分析确定固相成分为无水铬酸钠。
温度是影响晶体生长的重要因素[13]。在真空蒸发结晶过程中,为保证蒸发速度,溶液一般都处于沸腾状态,沸点即为蒸发温度。不同浓度溶液的沸点不同,要想使整个蒸发结晶过程中保持温度一致,需确定不同浓度的溶液体系保持特定温度所需的真空度,图2为不同NaOH浓度下Na2CrO4-NaOH混合溶液沸点与真空度间的关系。

图2 不同NaOH浓度下Na2CrO4-NaOH-H2O体系沸点与真空度间的关系
由图2可以看出,在同一浓度的Na2CrO4-NaOHH2O体系中,沸点随体系真空度的升高而降低;对于不同浓度的Na2CrO4-NaOH-H2O体系,在相同沸点下,体系NaOH浓度越大,所需真空度越高。根据图2结果,可通过控制体系的真空度使体系温度保持一致,为下文考察结晶温度的影响时提供指导。
2 实验部分
2.1 实验装置
图3为NaOH-Na2CrO4-H2O体系真空蒸发结晶实验装置示意图。

图3 蒸发结晶实验装置
2.2 实验步骤
1)量取模拟配制的 NaOH-Na2CrO4混合溶液800 mL加入1 L的结晶器中,开启搅拌器,打开恒温水浴加热。待溶液温度升至一定值时,开启真空泵,调节系统内真空度,开始蒸发结晶。在同一蒸发终点下分别考察结晶温度、搅拌强度、蒸发速度和添加晶种等因素对结晶过程的影响。
2)通过观察冷凝水系统中收集的冷凝水体积,当水量达到一定值时,打开缓冲瓶阀门放空,关闭真空泵和冷凝水,停止搅拌,关闭所有电源。
3)将蒸发器中的悬浮液迅速保温过滤,得到晶体产品。晶体经饱和铬酸钠溶液洗涤后,再用无水乙醇洗涤。洗涤后的样品干燥后采用Hydro2000M型粒度分析仪分析产品的粒度和粒度分布。比较不同操作条件制备的产品,确定最优工艺条件。
2.3 结果与讨论
2.3.1 搅拌强度的影响
在结晶温度为80℃、蒸发速度为200 mL/h的条件下,分别考察了 150、200、250、300、350 r/min 等不同搅拌速度对蒸发结晶过程的影响。图4为不同搅拌速度下所得晶体产品的粒度分布对比。表1为不同搅拌速度下所得晶体产品的平均粒度对比。
由图4、表1可见,蒸发结晶过程所得晶体产品的平均粒度随搅拌速度的增大而减小。当搅拌速度为150 r/min时,所得铬酸钠晶体的平均粒度为511 μm;当搅拌速度为350 r/min时,所得铬酸钠晶体的平均粒度仅为168 μm。当搅拌强度过大时,二次成核占主导地位,已有的晶粒与晶粒、晶粒与器壁、晶粒与搅拌桨间的碰撞几率与强度均增加,导致二次成核速率加快,故得到的晶粒较小;当搅拌强度过小时,固液混合不均匀,得到的晶体产品粒度分布较宽,大小不一,故应选择能使晶体离底悬浮的最小搅拌强度。综合考虑,实验选择适宜的搅拌速度为300 r/min。

图4 不同搅拌速度下所得晶体产品的粒度分布对比
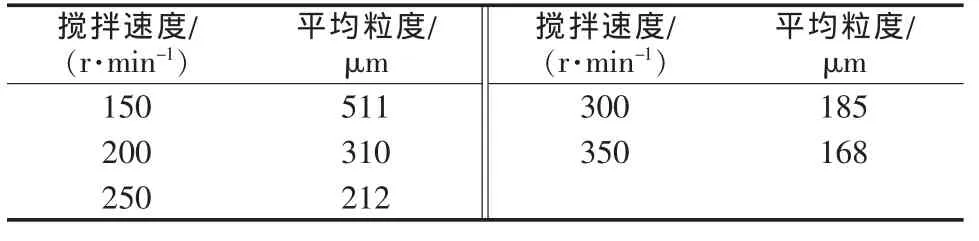
表1 不同搅拌速度下所得晶体产品的平均粒度对比
2.3.2 蒸发速度的影响
设定水浴温度为90℃,通过调节真空度来控制蒸发速率,忽略体系温度的变化,在搅拌速度为300 r/min的条件下,分别考察了蒸发速度为60、140、220、300、380 mL/h 时对工艺的影响。 图 5 为不同蒸发速度下所得晶体产品的粒度分布对比。表2为不同蒸发速度下所得晶体产品的平均粒度对比。

图5 不同蒸发速率下所得晶体产品的粒度分布对比

表2 不同蒸发速率下所得晶体产品的平均粒度对比
从图5、表2可以看出,蒸发结晶过程所得晶体的粒度随蒸发速度的加快而减小,当蒸发速度为60 mL/h时,所得晶体产品的平均粒度为290 μm;当蒸发速度为380 mL/h时,所得晶体产品的平均粒度仅为107 μm。蒸发速度过快时,溶液的过饱和度增大,容易导致爆发成核,从而得到的晶粒较小。故在保证正常操作时间的情况下,应尽可能选择较小的蒸发速率。综合考虑,实验选择适宜的蒸发速率为140 mL/h。
2.3.3 结晶温度的影响
将结晶温度变化控制在±2℃内,在蒸发速率约为150 mL/h、搅拌速度为300 r/min的条件下分别考察了体系温度为70、80、90℃时对蒸发结晶过程的影响。图6为不同结晶温度下所得晶体产品的粒度分布对比。表3为不同结晶温度下所得晶体产品的平均粒度。

图6 不同结晶温度下所得晶体产品的粒度分布对比

表3 不同结晶温度下所得晶体产品的平均粒度对比
从图6、表3可以看出,在蒸发速率一定的情况下,结晶温度的升高有利于晶体的生长,当结晶温度为90℃时,所得晶体产品的平均粒度为310 μm;当结晶温度为70℃时,所得晶体产品的平均粒度为159 μm。结晶温度越高,溶质的溶解度增大,溶解平衡向溶解方向移动,当微小晶体与较大晶体共存于溶液中时,如果溶液对较大晶体是饱和的,则对小晶体为未饱和,因此小晶体最先溶解,再从大晶体表面上重新析出,促进晶体长大,从而获得的晶体粒度较大[14]。综合考虑,实验选择适宜的结晶温度为90℃。
2.3.4 晶种的影响
在间歇操作的结晶过程中,在介稳区内添加晶种[15]是获得粒度较均匀的晶体产品的有效手段。在蒸发速率为300 r/min的条件下加入粒度为123 μm的晶种13.4 g。图7和表4分别为添加和未添加晶种的操作条件下所得晶体产品的粒度分布对比和平均粒度。

图7 有、无晶种添加条件下所得晶体产品的粒度分布对比

表4 有、无晶种添加条件下所得晶体产品的平均粒度对比
从图7、表4可以明显看出,添加晶种后所得晶体产品的粒度变大,分布较窄,同时晶型也较完整。
3 结论
针对Na2CrO4-NaOH-H2O体系,采用真空蒸发结晶的方法制备了Na2CrO4晶体:1)90℃时Na2CrO4-NaOH-H2O体系相平衡研究结果表明,采用真空蒸发结晶的方法可从Na2CrO4-NaOH-H2O中分离出Na2CrO4晶体。2)Na2CrO4-NaOH-H2O体系中真空蒸发结晶分离Na2CrO4的最优工艺条件:搅拌速度为能使晶体离底悬浮所需的最小转速;每1 050 g原料所需蒸发速度为140 mL/h;结晶温度为90℃;添加晶种。在此最优工艺条件下,得到的Na2CrO4晶体产品的平均粒度为300 μm。
[1]丁翼.我国铬盐生产状况及发展建议[J].无机盐工业,2000,32(4):28-30,44.
[2]Gao Yang,Xia Jun.Chromium contamination accident in China:viewing environment policy of China[J].Environmental Science&Technology, 2011,45(20):8605-8606.
[3]翟超.铬盐清洁工艺中铬渣的处理及利用[D].北京:北京化工大学,2010.
[4]郭雅杰.亚熔盐法铬盐清洁生产工艺多元电解质水溶液基础物性研究[D].北京:北京化工大学,2010.
[5]Zheng Shili,Zhang Yi,Li Zuohu,et al.Green metallurgical processing of chromite[J].Hydrometallurgy,2006,82(3/4):157-163.
[6]Xu Hongbin,Zhang Yi,Li Zuohu,et al.Development of a new cleanerproductionprocessforproducingchromicoxidefromchromite ore[J].Journal of Cleaner Production,2006,14 (2):211-219.
[7]Zhang Yi,Li Zuohu,Qi Tao,et al.Green manufacturing process of chromium compounds[J].Environmental Progress,2005,24 (1):44-50.
[8]沈镇平.河南义马建成万吨铬盐项目[J].杭州化工,2002,32 (3):13.
[9]徐红彬,张懿,李佐虎,等.一种铬铁矿加压浸出清洁生产铬酸钠的方法:中国,101817561A[P].2010-09-01.
[10]邹兴,张懿.NaOH-NaAlO2-Na2CrO4-H2O四元水盐体系相平衡[J].化工冶金,1998, 19(2):118-121.
[11]戴建军.钛白粉生产中真空结晶工艺技术的开发[J].化工设计通讯,2002,28(2): 21-24.
[12]杨仁春,何立惠,李佐虎,等.铬酸钠与氯化钠的分离[J].无机盐工业,2001,33 (5):5-7.
[13]Hicks J F,Templeton A C,Chen S,et al.The monolayer thickness dependence of quantized double-layer capacitances of monolayerprotected gold clusters[J].Analytical Chemistry,1999,71(17):3703-3711.
[14]张建国,张同来,杨利.起爆药的结晶控制技术与单晶培养[J].火工品,2001(1):50-54.
[15]张纲,王静康,熊晖.沉淀结晶过程中的添加晶种技术[J].化学世界,2002,43(6): 326-328.
