甘草次酸及其衍生物在肝靶向药物中的应用*
2014-06-05米雪,赵岩,杨慧
米 雪,赵 岩,杨 慧
(内蒙古医科大学药学院,呼和浩特010110)
甘草次酸及其衍生物在肝靶向药物中的应用*
米 雪,赵 岩,杨 慧
(内蒙古医科大学药学院,呼和浩特010110)
甘草次酸(GA)因具有良好的肝组织分布特征,作为一种肝靶向小分子化学载体被广泛研究。本文综述近年来对甘草次酸进行结构修饰得到的具有肝靶向作用的甘草次酸类载体分子的合成及其在肝靶向药物分子和药物制剂设计中的应用。
甘草次酸,肝靶向药物,小分子化学载体
甘草(Radix Glycyrrhiza)属于豆科植物,分布于我国西部及俄罗斯等欧洲国家,且在许多国家广为应用,其主要药理学活性物质是甘草酸(glycyrrhizic acid,GL)及其苷元甘草次酸(glycyrrhetinic acid,GA)(结构见图1)等[1]。甘草酸类药物在人体内主要经胃酸水解或经肝中β-葡萄糖醛酸酶分解为甘草次酸,再在肝肠循环中经肠内菌作用部分生成3-表-甘草次酸及少量3-脱氢甘草次酸而发生药物活性。故甘草酸类药物的作用实质上是甘草次酸发挥的效用[2,3]。现代医学研究表明,GA具有抗菌、抗炎、抗病毒、抗肿瘤、抗氧化、抗心律失常及免疫调节等多种作用[4,5],因此被广泛研究。
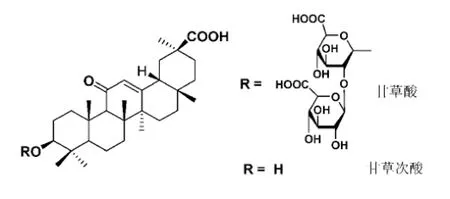
图1 甘草酸和甘草次酸的化学结构式
20世纪90年代初,Negishi等[6]证实了大鼠肝细胞膜组分中含有大量GA特异结合位点,GA与该位点的结合呈可饱和性和高度特异性,且该位点具蛋白质性质。国内也有多个课题组研究证实了肝细胞表面确实存在大量GA受体[7,8]。此后,GA作为一种具有肝靶向性的小分子载体在肝靶向药物的研究中受到了广泛的关注。本文就此领域的研究进展做一综述,期望对GA及其衍生物的进一步开发应用提供参考。
1 具有肝靶向性的甘草次酸类载体分子的合成与活性
Shiro等[9]报道了参与甘草酸及甘草次酸肝主动转运的载体可能是有机阴离子转运多肽(OATP),若将GA分子中的3-羟基或30-羧基进行衍生化可能对受体的亲和力有利,提高载体的肝靶向性能;此外,GA在较高剂量或较长期用药时,在体内会产生水钠潴留和高血压等皮质激素样副作用,研究认为这些不良反应主要由11-位羰基引起[10],所以11-脱氧甘草次酸衍生物可作为一类不良反应小的肝靶向主动转运载体。因此,目前肝靶向性甘草次酸类载体分子的研究主要集中在甘草次酸3-位或(和)30位衍生物以及脱氧甘草次酸衍生物的合成。
金辉等[11]合成了甘草次酸及11-脱氧甘草次酸(DGA)的30-位酰胺衍生物(见图2),通过Wistar离体大鼠肝细胞摄取GA实验和GA衍生物对肝细胞摄取GA的抑制实验,研究了离体大鼠肝细胞对GA的摄取规律。结果显示,合成的GA衍生物可竞争性地抑制离体大鼠肝细胞对GA的摄取,表明GA和DGA的30-酰胺衍生物与GA竞争细胞膜相同的受体,因此均可能作为肝靶向载体;此外,衍生物对GA摄取的抑制常数结果表明,30-羧基连有氨基酸酯和30-羧基连有氨基酸的化合物对GA摄取的抑制没有显著差异,说明在GA分子中,30-羧基附近有无阴离子基团对GA的转运影响较小,连接其他分子时应在30-羧基处成键。
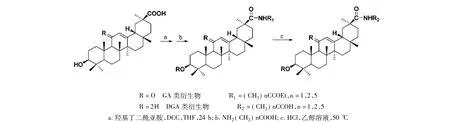
图2 金辉等合成的甘草次酸衍生物及合成路线
作为载体的甘草次酸有两种光学异构体,即18β-甘草次酸和18α-甘草次酸。研究表明,18α-甘草酸的肝分布能力比18β-甘草酸更强[12],然而其在天然产物中的含量甚微。因此,合成18α-甘草次酸及其衍生物,可能对肝细胞具有更强的靶向性。木合布力·阿布力孜等[13]将18β-甘草次酸先经化学反应进行构型转化,制成其光学异构体18α-甘草次酸,再将两种异构体11-脱氧后,对18β-甘草次酸和18α-甘草次酸及其11-脱氧产物的3-羟基进行酯化、30-羧基进行酯化和酰胺化,得到了一系列衍生物(图3和图4),肝靶向性研究实验正在进行中。
2 肝靶向甘草次酸类药物分子的设计与合成
靶向药物指的是利用对某些组织细胞具有特殊亲和力的分子作载体,与药物偶联后将其定向输送到靶器官部位的一种药物设计方法[14]。因甘草次酸具有良好的肝靶向性,将其与肝病治疗药物通过化学键偶联,即可达到将药物定向输送到肝脏的目的,从而提高药物生物利用度,降低药物对其他组织毒副作用。
张惠斌等[15]将甘草次酸或其3-位羟基的糖苷衍生物通过30-位羧基与保肝药物茴三硫偶联,制备了一系列甘草次酸与茴三硫的偶联物(见图5)。药理实验结果显示,茴三硫搭载了甘草次酸这个肝靶向载体后,所得的偶联物对受损小鼠肝细胞的保护作用优于茴三硫和甘草次酸单独给药,生物利用度得到了有效提升,并且甘草次酸可以保护茴三硫避免其与体内金属离子或自由基等反应,增加了其稳定性。
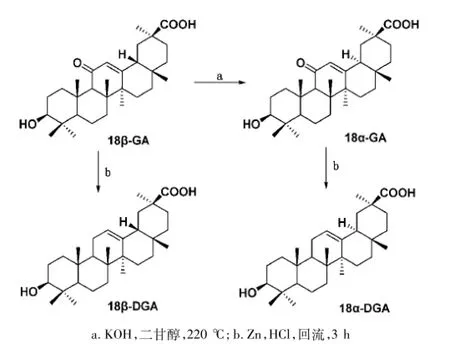
图318 α甘草次酸及11脱氧甘草次酸的合成方法
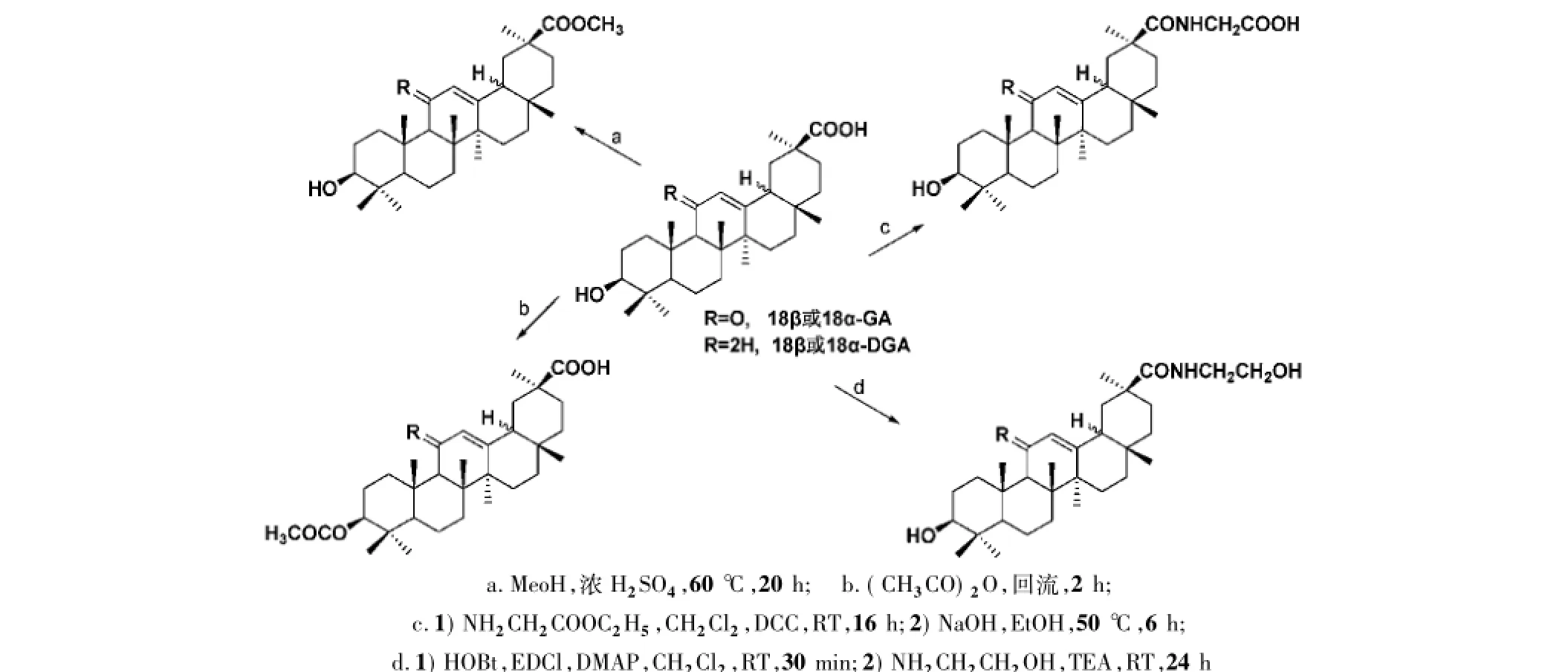
图4 木合布力·阿布力孜等合成的甘草次酸酯和酰胺类衍生物及合成方法
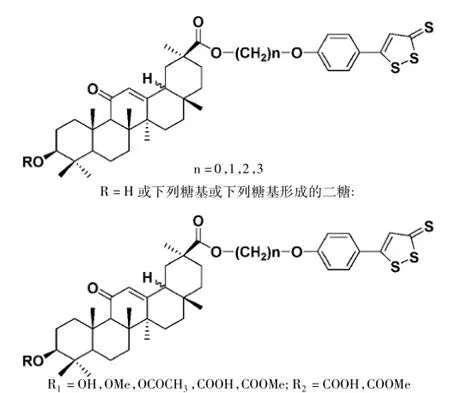
图5 甘草次酸衍生物与茴三硫偶联物
马淑燕等[16]将18β-和18α-甘草次酸甲酯的3-位羟基与抗癌药物环磷酰胺的抗癌活性结构片段——磷酰氮芥二氯相联接,制成具有抗癌潜能的肝靶向前药18β-和18α-甘甲磷氮芥(合成路线见图6),期望达到主动肝靶向作用。

图618 β和18α甘甲磷氮芥的合成方法
高苗苗等[17]将甘草次酸3-位羟基氧化成酮后,与抗实体肿瘤药物氟尿嘧啶的羟甲基化衍生物1,3-二羟甲基氟尿嘧啶缩合,得到具有前药性质的肝靶向甘草次酸-氟尿嘧啶类化合物(合成路线见图7)。甘草次酸作为小分子肝靶向载体,可提高氟尿嘧啶在肝脏病灶部位的浓度,提高抗肝癌疗效;此外甘草次酸本身也具有抗癌活性,能促进肝癌细胞的凋亡[18],从而可能与氟尿嘧啶产生协同抗癌作用。
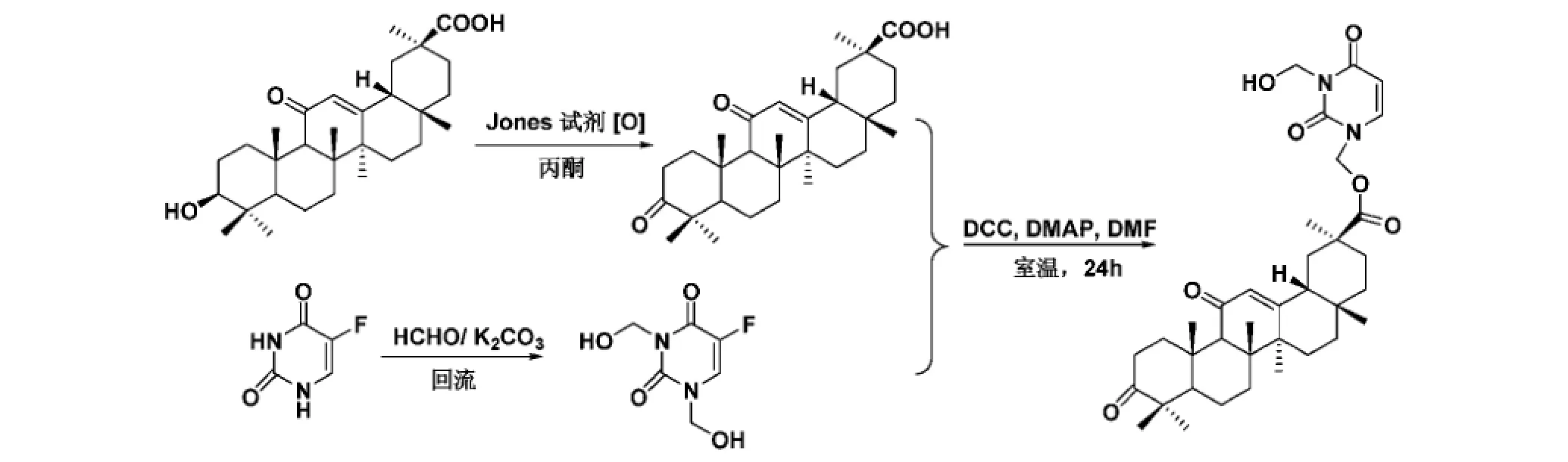
图7 甘草次酸-氟尿嘧啶衍生物类抗癌复合物的合成路线
3 肝靶向甘草次酸类药物制剂的制备与应用
靶向制剂指的是一类能使药物浓集于靶器官、靶组织、靶细胞且疗效高、毒副作用小的靶向给药系统[19]。目前国内外正在研究且取得一定进展的靶向抗癌药物载体系统主要有大分子载体系统(单克隆抗体、壳聚糖等)、微粒载药系统(脂质体、毫微粒等)以及磁性药物载体系统(磁性药物微球等)[20]。甘草次酸类肝靶向药物制剂主要集中在以脂质体和纳米粒为载体系统的研究。
3.1 甘草次酸表面修饰脂质体的研究毛声俊等[21]将GA与硬脂醇和琥珀酸酐偶联,合成了两亲性导向分子(Suc-GAOSt),将其掺入脂质体中,介导该修饰脂质体与肝细胞表面的GA受体特异结合,以期达到肝细胞主动靶向作用。
吴超等[22]以甘草次酸为骨架分子,将其30-位羧基与硬质醇成酯,3-位羟基与同样具有肝靶向性的半乳糖分子[23]成苷,制备了一端为半乳糖苷,一端为硬质醇酯的两亲性导向分子,并用其修饰去甲斑蝥素脂质体。小鼠肝靶向性试验显示,在给药(相当于去甲斑蝥素20 mg/kg)后10、20、30、60、120、240和360 min,试验组(尾静脉注射半乳糖-甘草次酸-硬质醇修饰的去甲斑蝥素脂质体)小鼠肝脏中去甲斑蝥素的浓度均显著高于对照组(尾静脉注射去甲斑蝥素脂质体),而其他组织(心、肺、肾)中去甲斑蝥素的浓度均不同程度地低于对照组。表明半乳糖-甘草次酸-硬脂酸具有良好的肝靶向性,可作为肝病治疗药物的优良载体。
何治尧等[24,25]开发了一种GA修饰的载基因长循环阳离子脂质体,研究结果显示,发现经GA修饰后的脂质体作为基因载体,可明显提高HepG2细胞的转染效率,比普通阳离子脂质体具有更高的基因表达效率。该课题组进一步对肝靶向载体材料的合成工艺及GA修饰的载基因长循环阳离子脂质体的制剂工艺进行优化,利用聚乙二醇(PEG)的两个羟基,分别与丁二酰甘草次酸(suc-GA)和丁二酰胆固醇(suc-Chol)发生酯化制备肝靶向载体材料(GA-PEG-Chol),然后采用Pre-PEGylation和Post-PEGylation两种方法制备阳离子脂质体DNA复合物。所得的GA-PEGChol的临界胶束浓度(CMC值)较低,具有良好的表面活性作用,易于自组装形成胶束。利用post-PEGylation法制备的5%GA-PEG-Chol阳离子脂质体DNA复合物的粒径及粒径分布均较优,可能是较好的肝靶向基因载体,其体内外基因转染效率尚需进一步的GA配体密度测试及体内外的基因转染实验验证。
3.2 甘草次酸修饰纳米粒的研究壳聚糖(CTS)来源广泛、廉价易得,且具有很好的生物相容性和可降解性,作为一种新型药用辅料在缓控释给药系统中,特别是在微球中的应用已引起了人们浓厚的兴趣[26]。查瑞涛等[27]将甘草次酸30-羧基与壳聚糖氨基缩合,合成了修饰甘草次酸的壳聚糖(GA-CTS),并采用离子交联法制备了GA-CTS纳米粒子,所得的纳米粒子粒径分布较窄、稳定性高,该材料可能具有肝细胞主动靶向作用,为进一步的肝靶向药物控释研究奠定了基础。
张闯年等[28]将甘草次酸30-羧基通过乙二胺连接臂与具有优良生物相容性和生物可降解性的海藻酸钠(ALG)偶联,合成了甘草次酸改性的海藻酸钠(GA-ALG),并对广谱抗癌药物阿霉素(DOX)进行包封,成功制备了载阿霉素纳米粒,以期达到主动靶向治疗肝癌的目的。对GA-ALG载阿霉素纳米粒的释药特性及细胞毒性的研究结果显示,GA-ALG载药纳米粒在生理条件下具有良好的药物缓释作用,体外药物释放可达20 d;其对7703肝癌细胞具有明显的杀伤作用。
透明质酸(hyaluronic acid,HA)可与肿瘤细胞表面富含的CD44等受体结合,激活针对HA的细胞内信号通路或激活HA的内化作用而调节细胞的运动等行为[29],具有良好的生物相容性、生物可降解性,并对肿瘤细胞有高度亲和性。张莉等[30]以乙二胺为连接臂,通过两步成酰胺反应,将疏水性甘草次酸分子与亲水性透明质酸分子偶联得到两亲性GA-HA偶联物,以其作为载体,以抗肿瘤药物紫杉醇(PTX)作为模型药物制备纳米粒。由于GA-HA偶联物具有两亲性,在水性介质中可自组装形成特殊的核-壳结构。其中GA的链段聚集成疏水内核可增溶PTX,HA成壳起保护和稳定的作用,能够阻止包裹在内部的药物与外界环境的相互作用,减少巨噬细胞的识别与吞噬,提高纳米粒的血浆稳定性和延长药物的血浆半衰期。体外细胞毒性试验结果显示,所制备的PTX/GA-HA纳米粒可明显抑制HL-60细胞(人早幼粒白血病细胞)、B16F10细胞(小鼠黑色素瘤细胞)和HepG2细胞(人肝癌细胞)3种肿瘤细胞的生长,尤其针对HepG2细胞效果最强,因此推测由于GA的肝靶向作用,HepG2细胞能够特异性识别GA-HA纳米粒,并在HA及GA受体协同作用下,形成特殊包被的内吞泡,更易将PTX转运至细胞内部,有效地发挥细胞杀伤作用。
甘草次酸本身就具有保肝解毒、抗肿瘤、抗炎抗菌、抗病毒、抗心血管疾病、免疫调节、抗氧化及肾上腺皮质激素样作用等多方面的药理作用,同时还具有较高的肝组织分布特征和肝细胞靶向性,使其不仅可作为药物载体,也可与药物产生协同作用。因此,甘草次酸类化合物是一类具有广阔前景的肝靶向载体,随着进一步研究的开展,将来很有可能研制出具有开发潜力的治疗肝脏疾病的肝靶向候选药物。
1胡志厚.甘草酸类药物的研制及应用[J].药学学报,1988,23 (7):553
2Kobash i Kyoich,i N anba Tsun eo,H attori Yuk io,et al.Preparat ion of 32ep i2glycyrrh et ic acid[P].JP:59 14 799,1984-01-25
3郝飞.甘草酸国外研究进展[J].中国药房,2001,12(8):500
4金敏,吴金红.甘草次酸药理作用的研究进展[J].医学综述,2009,15(11):1712
5雍建平,张毓洪,赵巍,等.甘草次酸及甘草次酸衍生物药理活性研究进展[J].时珍国医药,2010,21(12):3335
6Negishi M,Irie A,Nagata N,et al.Specific binding of glycyrrhetinic acid to the rat liver membrane[J].Biochim Biophys Acta,1991,1066: 77
7顾云娣,周方成,杨山麦,等.甘草次酸和甘草酸对离体大鼠肝细胞膜效应的电镜观察[J].上海医科大学学报,2000,27:270
8杨山麦,周方成,顾云娣,等.离体鼠肝细胞膜上甘草次酸和甘草酸受体的表达[J].中华肝脏病杂志,1999,(7):27
9Shiro I,Sakiya Y,Ichikawa T,et al.Uptake of glycyrrhizin by rat hepatocytes[J].Bio Pharm Bull,1993,16(3):293
10Vicker N,Su X,Lawrence H,et al.A novel 18β-glycyrrhetinic acid analogue as a potent and selective inhibitor of 11β-hydroxysteroid dehydrogenase[J].Bioorg Med Chem Lett,2004,114(12):3263
11金辉,毛声俊,张昆,等.甘草次酸类衍生物的合成及其离体大鼠肝细胞摄取的研究[J].华西药学杂志,2010,25(6):652
12范益,丁建花,刘苏怡,等.α-和β-甘草酸在小鼠体内分布的研究[J].中国临床药学与治疗学,2004,9(6):619
13木合布力·阿布力孜,董长治,Massicot,等.具有肝靶向潜力的甘草次酸酯和酰胺类衍生物的合成研究[J].新疆医科大学学报,2013,36(2):162
14徐文方主编.药物设计学[M].第2版.北京:人民卫生出版社,2011:166
15张惠斌,周金培,韩瑶聃,等.甘草次酸衍生物的制备方法和作为保肝药物的医药用途[P].CN 102690316 A,2012
16马淑燕.甘草有效成分的制备及甘草次酸类肝靶向抗癌前药的合成研究[D].新疆医科大学,2008:2-4
17高苗苗,木合布力·阿布力孜,徐方野,等.甘草次酸-氟尿嘧啶类抗癌复合物的合成及表征[J].新疆医科大学学报,2013,36(2): 156
18Xie S M,Cui H F,Zang H C,et al.The preparation of deoxyglycyrrhetinic acid[J].Chin J Biochem Pharm,2007,28:74-76
19陆彬.药物新剂型与新技术[M].北京:人民卫生出版社,1998: 2-4
20陈秀丽,吴泽志,冯全义,等.抗癌药物靶向制剂的研究现状[J].重庆大学学报,2004,27(9):92
21毛声俊,侯世祥,金辉,等.肝细胞靶向甘草次酸表面修饰脂质体的制备[J].中国中药杂志,2003,28(4):328
22吴超,郭伟英,张磊.甘草次酸衍生物修饰去甲斑蝥素脂质体的制备及小鼠肝靶向性实验研究[J].中国药房,2009,20(28): 2184-2186
23Jin Y,Li J,Rong L F.Pharmacokinetics and tissue distribution of 5-fluouracil encapsulated by galactosylceramide liposomes in mice[J].Acta Phamacol Sin,2005,26(2):2501
24He Z Y,Zheng X,Wu X H,et al.Development of glycyrrhetinic acidmodified stealth cationic liposomes for gene delivery[J].Int J Pharm,2010,397(1-2):147
25何治尧,何谷,宋相容,等.甘草次酸修饰长循环阳离子脂质体DNA复合物的制备[J].中国药学杂志,2011,46(11):846
26郑建华,刘朝武,包德才,等.克拉霉素漂浮-生物粘附胶囊的制备及性能研究[J].高等学校化学学报,2006,27(6):1182
27查瑞涛,贺晓婷,杜田,等.肝靶向甘草次酸修饰的壳聚糖纳米粒子的合成及表征[J].高等学校化学学报,2007,28(6):1098
28张闯年,王蔚,王春红,等.肝靶向海藻酸钠载药纳米粒的细胞毒性研究[J].中国科学B辑:化学,2009,39(9):943
29Karjalainen J M,Tammi R H,Tammi M I,et al.Reduced level of CD44 and hyaluronan associated with unfavorable prognosis in clinical stage I cutaneous melanoma[J].Am J Pathol,2000,157(3):957
30张莉,周建平,姚静.紫杉醇甘草次酸修饰透明质酸纳米粒的制备及性能研究[J].中国药科大学学报,2012,43(3):226
Application of glycyrrhetinic acid and its derivatives in the liver-targeted drugs
Mi Xue,Zhao Yan,Yang Hui
(College of Pharmacy,Inner Mongolia Medical University,Hohhot 010110)
Glycyrrhetinic acid(GA)has been widely studied as a liver-targeted small molecular chemical carrier due to its good distribution in liver tissue.Recent research in the synthesis of liver-targeted carrier molecules based on structural modification of GA and their application in the design of liver-targeted drug molecules and preparations are reviewed in this article.
glycyrrhetinic acid,liver-targeted drugs,small molecular chemical carriers
R969.1
A
1006-5687(2014)01-0041-05
2014-01-04
内蒙古医科大学科技百万工程资助项目(No.NY2011BW010)
